南昆山毛葉茶對tBHP誘導損傷NIH3T3細胞的保護效果
劉詩妤,陳忠正,林曉蓉,張媛媛,周浪花,高 雄,李 斌,*
(1.華南農業大學食品學院,廣東廣州 510642; 2.廣東省科學院廣東省微生物研究所,廣東廣州 510070)
南昆山毛葉茶(CamelliaptilophyllaChang)是二十世紀八十年代初中山大學植物分類學家張宏達教授在廣東省龍門縣南昆山首次發現的一種天然低或無咖啡堿的茶樹資源[1]。與傳統茶葉[Camelliasinensis(L).O.Kuntze]同屬不同種,其主要代謝產物——兒茶素、生物堿具有明顯差異,傳統茶葉以順式兒茶素和咖啡堿含量高,而南昆山毛葉茶以反式兒茶素和可可堿含量高[2-3]。功能特性研究表明,該茶葉具有抗氧化[4]、抗癌[5]、抗肥胖[6]、抗血管生成[7]等功能。2011年Peng等[4]以南昆山毛葉白茶、綠茶、紅茶為材料,采用化學抗氧化法,與龍井、碧螺春、英紅九號、祁門紅茶等比較發現,南昆山毛葉綠茶的抗氧化性顯著強于其他茶類。2012年Li等[8]用化學抗氧化法比較南昆山毛葉茶、苦茶、龍井茶抗氧化性的結果表明,南昆山毛葉茶抗氧化活性最強。2017年高雄等[9]采用細胞抗氧化活性法(cellular antioxidant activity,CAA)和化學抗氧化法研究表明,南昆山毛葉茶水提物抗氧化性強于云南大葉種茶水提物;2019年曠小珊等[2]采用化學抗氧化法及氧化應激細胞模型法研究南昆山毛葉茶中多酚物質的抗氧化活性表明,沒食子兒茶素沒食子酸酯(gallocatechin gallate,GCG)具有較強的化學抗氧化活力,但其抗氧化機理并未深入研究。
正常人體內存在氧化系統和抗氧化系統平衡,氧化應激則是由于體內自由基產生過多或清除能力降低,引起體內平衡發生紊亂,自由基大量積累,導致細胞衰老和組織損傷[10-11]。自由基主要由活性氧自由基和活性氮自由基組成,抗氧化系統則分為酶系統[過氧化氫酶(catalase,CAT)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)]和非酶系統[谷胱甘肽(glutathione,GSH)、維生素E、輔酶Q10][12-13]。目前抗氧化研究可分為體內和體外二類。體內抗氧化法成本高、耗時長。體外抗氧化法又可分為化學抗氧化法和細胞模型法,其中細胞模型法具有用時短、成本低,比化學抗氧化法更具生物相關性,結果更具說服力等優點[14]。常用的細胞模型造模劑有叔丁基過氧化氫(tert-butyl hydroperoxide,tBHP)、過氧化氫等。tBHP是一種脂質的短鏈氫過氧化物類似物,與H2O2相比,化學性質更穩定,不易降解,因此應用廣泛[15-16]。tBHP在損傷過程中產生叔丁基自由基,導致脂質過氧化,蛋白質巰醇基修飾和胞質鈣離子濃度失調,膜滲透能力變化[17]。研究發現,tBHP可導致大量細胞凋亡,但也能導致壞死,甚至是鐵死亡[16-18]。
為探討南昆山毛葉茶抗氧化的作用機理,本研究采用tBHP作為誘導損傷劑,構建NIH3T3細胞氧化應激模型,在全面分析茶葉水提物的茶多酚等理化成分含量基礎上,通過測定細胞存活率、活性氧(reactive oxygen species,ROS)生成量、抗氧化酶活性以及線粒體膜電位,研究其抗氧化活性,并通過測定凋亡蛋白的表達,系統地探究其觸發細胞死亡途徑及保護損傷機理,為南昆山毛葉茶的抗氧化等功能特性研究和開發利用提供理論研究基礎。
1 材料與方法
1.1 材料與儀器
南昆山毛葉茶 2019年4月采自廣東省惠州市龍門縣南昆山采用微波殺青、微波干燥加工成干茶;NIH3T3細胞 源于廣東省微生物研究所;杜氏改良高糖培養基(Dulbecco’s Modified Eagle Medium,DMEM)、胰蛋白酶、杜氏磷酸鹽緩沖液(Dulbecco’s Phosphate Buffered Saline,DPBS)、胎牛血清(Fetal bovine serum,FBS) 美國Gibco公司;1%青霉素(100U/mL)和鏈霉素(100μg/mL) 瑞典Hyclone公司;SOD、CAT、GSH-Px活性檢測試劑盒、MMP檢測試劑盒、ROS檢測試劑盒 碧云天生物技術有限公司;LDH、T-GSH、MDA檢測試劑盒 南京建成生物工程研究所;caspase-3、caspase-9檢測試劑盒 江蘇凱基生物技術股份有限公司;細胞色素c、β-actin抗體 美國CST公司;MTT、兒茶素[(-)-catechin,C,≥98%]、表兒茶素(epicatechin,EC,≥98%)、兒茶素沒食子酸酯(catechin gallate,CG,≥98%)、表沒食子兒茶素(epigallocatechin,EGC,≥98%)、沒食子兒茶素(gallocatechin,GC,≥98%)、表兒茶素沒食子酸酯(epicatechin gallate,ECG,≥98%)、沒食子兒茶素沒食子酸酯(GCG,≥98%)、表沒食子兒茶素沒食子酸酯(epigallocatechin gallate,EGCG,≥95%)、沒食子酸(gallic acid,GA,≥97.5%~102.5%)、可可堿(≥99%)、茶堿(≥99%)、茶氨酸(≥98%) 美國Sigma公司;咖啡堿(99.9%) 上海生工生物有限公司;三氟乙酸色譜級、福林酚 麥克林生化科技有限公司;乙腈色譜級 德國Merck公司;硫酸分析純 廣州化學試劑廠;Poroshell 120 Bonus-RP色譜柱(4.6 mm×50 mm,2.7 μm) 美國Agilent公司。
Milli-Q Integral 3純水機 德國Merk-Millipore公司;Alpha 1-2 LD plus冷凍干燥機 德國Martin Christ公司;VersaMax酶標儀 美國Molecular Devices公司;Agilent 1200高效液相色譜儀 美國Agilent公司;Axio Observer A1倒置熒光顯微鏡 德國Carl Zeiss公司;CytoFLEx流式細胞儀 美國Beckman Coulter;OmegaLum G化學發光儀 美國Aplegen公司。
1.2 實驗方法
1.2.1 南昆山毛葉茶水提物制備 取干茶用研缽磨碎并篩分(20~30目),按茶水比1∶25 (w/v)加入100 ℃的一級水,100 ℃水浴浸提45 min,隔10 min振搖一次,趁熱抽濾,濾液冷凍干燥,-20 ℃儲存備用。
1.2.2 南昆山毛葉茶水提物主要化學成分含量測定
1.2.2.1 茶多酚的測定 采用福林酚比色法[19],適當修改。稱取一定量的茶葉水提物,配制成0.2 mg/mL的試液,取1與5 mL福林酚試劑(10%)混合,反應5 min內,加入7.5%的Na2CO3溶液4 mL,混勻,加水定容,避光放置60 min。測定樣品在765 nm波長下的吸光值,以GA為標準品制作標準曲線y=0.0109x+0.0035,R2=0.9995,計算樣液中茶多酚濃度(mg/mL),并換算成占茶葉水提物的百分比(%),換算公式如下:
式中:C1:經標準曲線計算出樣液中的茶多酚濃度(mg/mL);C2:加入的水提物濃度(mg/mL)。
1.2.2.2 兒茶素和生物堿的測定 參照Gao等[5]測定兒茶素生物堿含量的方法,進行適當修改。使用Agilent 1200高效液色譜儀及Poroshell 120 Bonus-RP(4.6 mm×50 mm,2.7 μm)色譜柱進行分離,柱溫30 ℃,檢測波長為280 nm,進樣量為5 μL,流動相A為乙腈,B為0.05%三氟乙酸,進行線性梯度洗脫(0~26 min,A:0~28%,B:100%~72%),流速為0.8 mL/min,后運行4 min。由Agilent Chemstation B.04.02軟件積分,擬合兒茶素和生物堿單體的標準曲線(如表1),采用歸一化法計算其濃度(mg/mL),并換算成占茶葉水提物的百分比(%),換算公式如下:
式中:C1:經標準曲線計算出樣液中的兒茶素/生物堿單體的濃度(mg/mL);C2:加入的水提物濃度(mg/mL)。

表1 兒茶素和生物堿單體的標準曲線表Table1 Stadard curves of catechin and alkaloid monomer
1.2.3 細胞培養 小鼠成纖維細胞NIH3T3經解凍復蘇后,培養于37 ℃、5% CO2培養箱中,每隔2 d繼代一次。培養液組成為89%的DMEM培養基、10% FBS、1%青霉素(100 U/mL)和鏈霉素(100 μg/mL)。
1.2.4 tBHP誘導損傷NIH3T3細胞模型的建立
1.2.4.1 誘導劑tBHP誘導損傷NIH3T3細胞濃度的確定 將NIH3T3細胞以5×104cell/mL,每孔200 μL,接種于96孔板中,于37 ℃、5%CO2培養箱中培養24 h,棄去舊培養液,同時加入100 μL tBHP溶液和100 μL新鮮培養液,使tBHP終濃度分別為0、25、50、100、200、300、400 μmol/L,24 h后棄去,加入MTT溶液,37 ℃培養2 h后棄去,加入二甲基亞砜(dimethyl sulfoxide,DMSO),37 ℃,100 r/min振搖15 min,用酶標儀測定其在550 nm處的吸光值。細胞存活率計算公式如下:
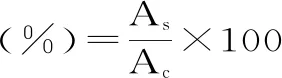
式中:As:不同濃度茶葉水提物處理后的吸光值;Ac:正常培養對照組的吸光值,將正常培養對照組細胞存活率當做100%。
其中正常培養的NIH3T3細胞為對照組,以使細胞存活率為50%~60%的tBHP濃度為誘導劑合適作用濃度。
1.2.4.2 南昆山毛葉茶水提物對NIH3T3細胞存活率影響的測定 細胞鋪板培養同1.2.4.1,24 h后棄去舊培養液,同時加入100 μL茶葉水提物和100 μL新鮮培養液,使茶葉水提物終濃度分別為25、50、100、200、300、400 μg/mL,培養24 h后棄去,同1.2.4.1方法測定細胞存活率。
1.2.4.3 南昆山毛葉茶水提物對tBHP誘導損傷NIH3T3細胞存活率影響的測定 細胞鋪板培養同1.2.4.1,24 h后棄去舊培養液,同時加入100 μL茶葉水提物(終濃度分別為25、50、100 μg/mL)和100 μL tBHP溶液(終濃度為200 μmol/L),24 h后棄去,同1.2.4.1方法測定細胞存活率。正常培養的NIH3T3細胞為對照組,tBHP單獨處理為tBHP損傷組,tBHP和南昆山毛葉茶水提物共處理為樣品組。
1.2.5 南昆山毛葉茶水提物處理NIH3T3細胞相關抗氧化指標測定
1.2.5.1 LDH酶活力的測定 細胞鋪板培養及加樣同1.2.4.3一致,tBHP和茶葉水提物共同作用24 h后,取細胞培養上清液,按試劑盒說明書,測定LDH活性。
1.2.5.2 抗氧化酶活力及MDA、GSH含量的測定 將NIH3T3細胞接種于培養皿中,細胞培養、加樣及細胞分組同1.2.4.3一致,各處理組細胞經tBHP和水提物培養24 h后,收集細胞,用相應的細胞液裂解液充分裂解后,離心,取上清,以BCA蛋白定量試劑盒測定的細胞蛋白濃度為基礎,按各試劑盒說明,分別測定SOD、CAT、GSH-Px的酶活力和MDA、GSH含量。
1.2.5.3 ROS含量的測定 將NIH3T3細胞接種于6孔板中,細胞培養、加樣方式及細胞分組同1.2.4.3一致,tBHP和水提物共培養6h,棄去,加入2′,7′-二氯熒光素雙乙酸鹽(2′,7′-dichlorofluorescin diacetate,DCFH-DA)熒光探針溶液,37 ℃中避光孵育30 min,置于倒置熒光顯微鏡下觀察,進行定性分析,用流式細胞儀進行定量分析。
1.2.5.4 MMP的測定 同1.2.5.3方法接種細胞于6孔板中,加樣及細胞分組同1.2.4.3方法一致,共培養24 h,按試劑盒說明書的方法,孵育熒光染料,用流式細胞儀進行分析。
1.2.6 細胞凋亡檢測 同1.2.5.2方法處理細胞并同1.2.4.3方法對其細胞進行分組,得到各處理組的細胞蛋白上清液,分別按5×上樣緩沖液與蛋白樣品1∶4 (v/v)比例混合煮沸后,插入冰上分裝使用。以每孔20 μg蛋白上樣量對蛋白進行電泳分離,濕轉至膜上,5%脫脂奶粉封閉1 h,分別用細胞色素c及β-actin一抗,4 ℃孵育過夜;隨后加入辣根過氧化物酶標記的二抗孵育1h,化學發光試劑盒顯影,OmegaLum G化學發光成像系統曝光并拍照記錄結果。
同1.2.5.2方法處理細胞,得到各處理組的細胞蛋白上清液,按照caspase-9、caspase-3試劑盒的方法對凋亡蛋白caspase-9、caspase-3的表達進行定量分析。
1.3 數據分析
圖表數據以平均值±標準偏差,每個實驗重復兩次以上。利用軟件Origin Pro 9.0進行統計分析和繪圖。采用FluorChem分析蛋白條帶光密度,以β-actin為內參蛋白做相對定量。采用CytExpert 2.0分析流式細胞儀結果。
2 結果與分析
2.1 南昆山毛葉茶水提物主要理化組成分析
為明確南昆山毛葉茶水提物的主要理化成分含量,本研究采用全量法提取、凍干,得到水提物,其得率為40.37%。采用相關國家標準等方法,測定茶多酚等主要理化成分含量并分析計算,結果如表2所示。
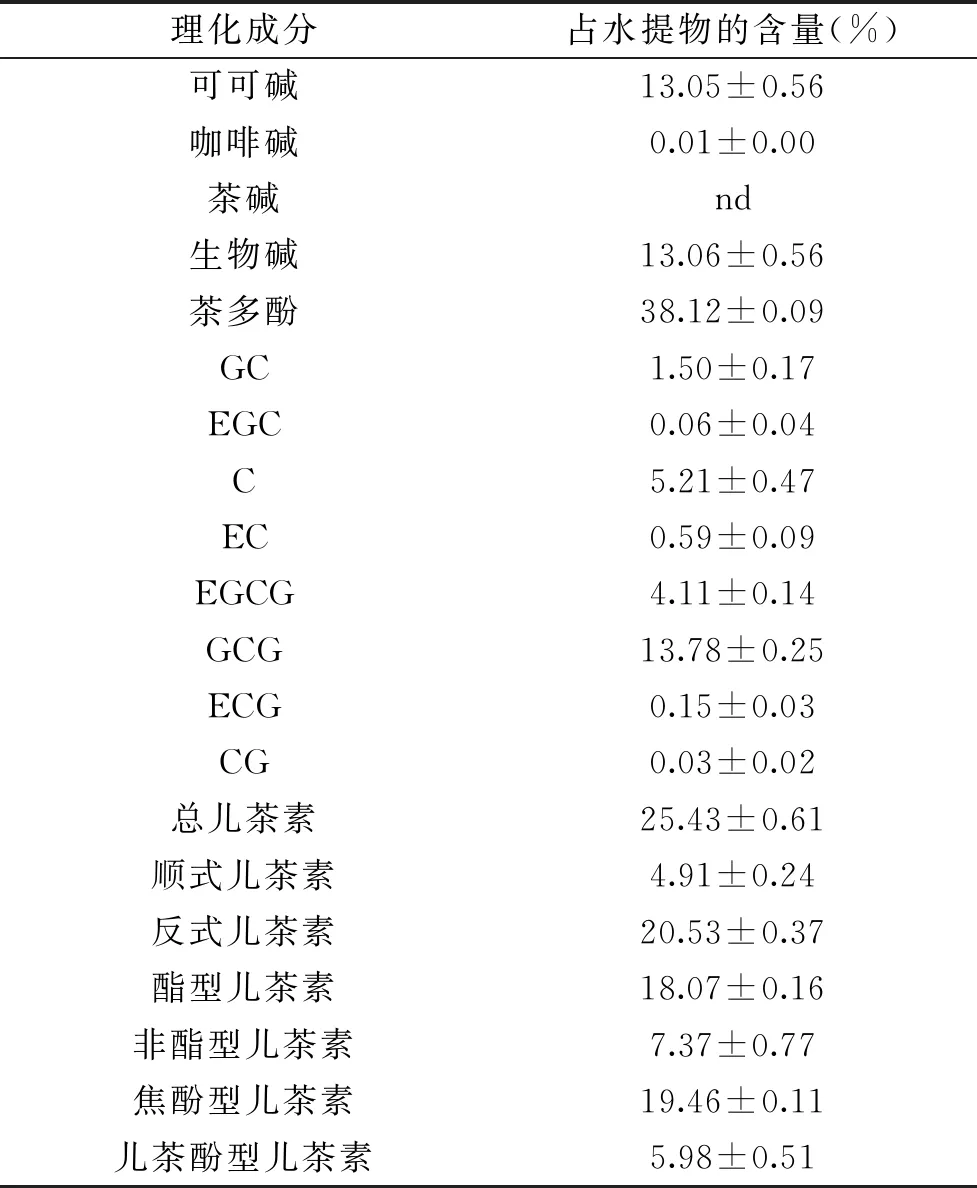
表2 南昆山毛葉茶水提物主要理化成分含量Table 2 Contents of major chemical components in water extracts of Camellia ptilophylla Chang
由表2結果可知,南昆山毛葉茶水提物含有約13.06%的生物堿,其以可可堿為主,占比高達99.92%,咖啡堿含量極低,未檢測到茶堿;水提物含有較高比例的茶多酚,其中主要兒茶素單體占比為66.71%,且以GCG含量最高,占總兒茶素的54.19%;兒茶素組成以反式構象、酯型和焦酚型結構為主,占總兒茶素比例依次為80.73%、71.06%、76.52%。茶葉的抗氧化活性不僅受茶多酚含量影響,還與多酚組成有關[8]。Guo 和沈生榮等[20-21]研究表明,在較低濃度下(0.02 mmol/L),反式兒茶素GCG、GC、C清除自由基能力強于其差向異構體,其空間構象比順式兒茶素更穩定,清除自由基效果更好。曠小珊等[2]發現GCG在30~60 μg/mL濃度范圍內,清除DPPH自由基能力強于EGCG。3個相鄰羥基是兒茶素清除自由基的關鍵結構,酯型、焦酚型兒茶素清除自由基能力強于非酯型、兒茶酚型結構[22]。在前人研究基礎上,本研究對南昆山毛葉茶水提物這一茶多酚含量豐富,兒茶素含量高,且反式、酯型和焦酚型兒茶素占比高,而具有強抗氧化功效的可能機理開展相關研究。
2.2 NIH3T3細胞氧化損傷模型構建
為探究南昆山毛葉茶抗氧化活性,本研究以tBHP為誘導劑,采用NIH3T3細胞建立氧化損傷模型。結果如圖1所示,不同濃度tBHP對NIH3T3細胞損傷程度不同;隨著tBHP濃度的提高,細胞存活率逐漸降低。在濃度為200 μmol/L時,細胞存活率為54.00%,達到建模要求,故以該濃度建立氧化損傷模型。
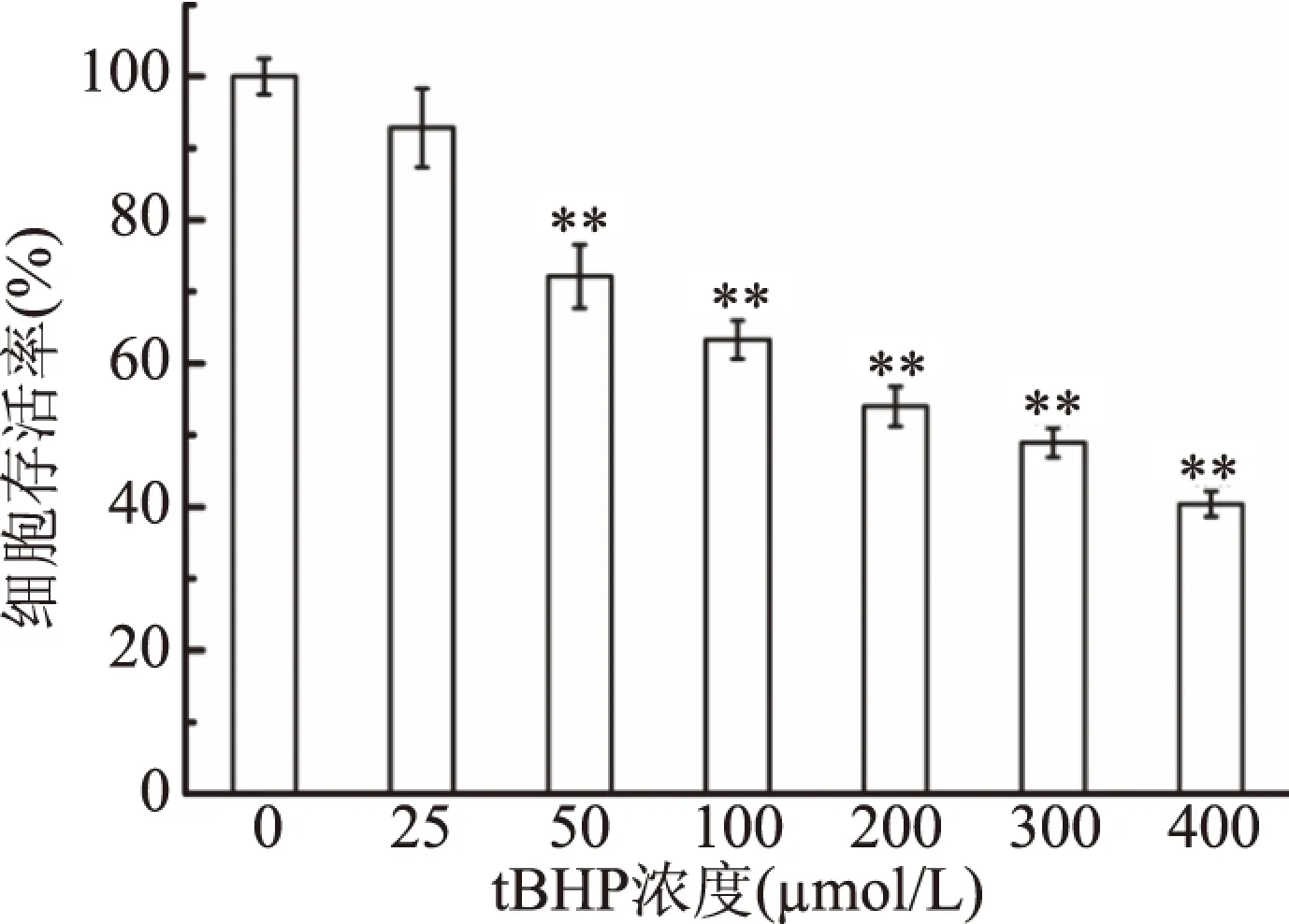
圖1 不同濃度tBHP對NIH3T3細胞存活率的影響Fig.1 Effects of different concentrations of tBHP on the viability of NIH3T3 cells注:*代表樣品組與對照組相比,*有顯著差異, 即P<0.05,**有極顯著差異,即P<0.01。
2.3 南昆山毛葉茶水提物對NIH3T3細胞存活率的影響
在探究茶葉樣品對NIH3T3細胞氧化應激保護作用之前,本研究采用MTT法進行細胞毒性實驗,確定茶葉水提物無毒副作用的濃度范圍,以防止其對實驗結果的干擾,結果如圖2所示。
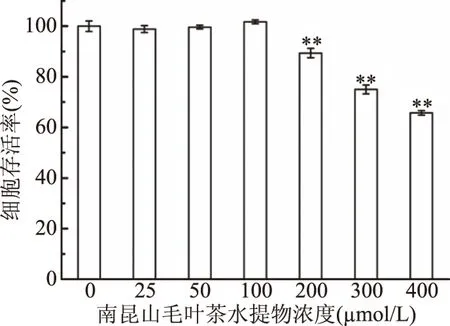
圖2 南昆山毛葉茶中水提物對NIH3T3細胞存活率的影響Fig.2 Effect of Camellia ptilophylla Chang water extract on the viability of NIH3T3 cells 注:*代表樣品組與對照組相比,*有顯著差異, 即P<0.05,**有極顯著差異,即P<0.01。
由圖2結果可知,與對照組相比,南昆山毛葉茶水提物在25~100 μg/mL濃度范圍內,細胞存活率無顯著差異,在200~400 μg/mL濃度范圍內,隨著其濃度增加,NIH3T3細胞存活率極顯著下降,低于89.38%,顯示在該濃度范圍內的南昆山毛葉茶水提物對該細胞的正常生長有毒副作用。故選擇南昆山毛葉茶水提物25~100 μg/mL的濃度范圍進行后續實驗。
2.4 南昆山毛葉茶水提物對tBHP損傷NIH3T3細胞的保護作用
LDH作為細胞內標志性酶,其釋放與細胞膜完整性相關[23]。LDH含量越高,表示細胞膜損傷程度越大,當損傷達到一定程度時,細胞死亡,整體存活率降低。因此本研究用MTT法測定南昆山毛葉茶水提物對tBHP誘導的NIH3T3細胞存活率的影響,用試劑盒法檢測LDH活性,分析細胞損傷程度,結果如圖3所示。

圖3 南昆山毛葉茶水提物對tBHP誘導的 NIH3T3細胞存活率及細胞上清LDH活性的影響Fig.3 Effects of Camellia ptilophylla Chang water extract on the viability of tBHP-induced NIH3T3 cells andthe activity of LDH in cell supernatant注:A:細胞存活率;B:LDH活性;#代表tBHP組與對照組 相比,*代表樣品組與tBHP組相比,#(*)有顯著差異, 即P<0.05,##(**)有極顯著差異,即P<0.01。
圖3表明,200 μmol/L的tBHP使NIH3T3細胞存活率降低至49.68%,LDH酶的活力顯著提高,提高至對照組的1.43倍。當加入的南昆山毛葉茶水提物濃度在25~100 μg/mL范圍內時,能極顯著提高NIH3T3細胞存活率和降低LDH酶活性,并呈劑量依賴關系。說明200 μmol/L的tBHP會損傷NIH3T3細胞,但加入特定濃度的南昆山毛葉茶水提物后,能減輕細胞膜損傷程度,提高細胞存活率,保護細胞免受氧化損傷。
2.5 氧化應激模型中SOD、CAT、GSH-Px酶活力和MDA、GSH含量的變化
SOD、CAT、GSH-Px均為內源性抗氧化酶,其活力增高代表細胞內的抗氧化活性增強[24]。MDA是脂質過氧化的第二產物,其含量越高代表脂質氧化程度越高,因此被廣泛作為評價氧化應激狀態的主要指標[25]。GSH是主要的氧化還原緩沖物,可清除ROS,含量越高,清除的ROS越多[26]。因此本研究采用試劑盒法檢測南昆山毛葉茶對tBHP誘導NIH3T3細胞中SOD、CAT、GSH-Px抗氧化酶活力以及MDA、GSH的含量的影響,結果如圖4所示。

圖4 南昆山毛葉茶水提物對tBHP損傷NIH3T3細胞的SOD、CAT、GSH-Px酶活力和MDA、GSH含量的影響Fig.4 Effects of Camellia ptilophylla Chang water extract on the activity of SOD,CAT,GSH-Px and contents of MDA,GSH by tBHP damage in NIH3T3 cells注:A:CAT酶活力;B:SOD酶活力;C:GSH-Px酶活力;D:MDA含量;E:GSH含量;#代表tBHP組與對照組相比, *代表樣品組與tBHP組相比,#(*)有顯著差異,即P<0.05,##(**)有極顯著差異,即P<0.01。
據圖4結果可知,tBHP處理的NIH3T3細胞,與對照組相比,SOD、CAT、GSH-Px三種抗氧化酶活力和GSH含量極顯著降低;而MDA含量極顯著升高。而加入南昆山毛葉茶水提物的樣品組,在25~100 μg/mL濃度范圍內,三種抗氧化酶的活力均升高,且與tBHP組之間存在極顯著差異,其中SOD和GSH-Px酶活力在茶葉水提物濃度為25 μg/mL時達到最高值,而CAT酶活力在50 μg/mL時方達到最高值;MDA含量極顯著降低,并呈濃度依賴關系;GSH含量顯著提高。綜上所述,tBHP通過降低細胞內SOD、CAT、GSH-Px酶活力,導致細胞脂質氧化,MDA大量形成,GSH耗竭,從而打破體內氧化-抗氧化平衡,進而使細胞損傷。而南昆山毛葉茶水提物在本實驗的25~100 μg/mL濃度范圍內,能顯著提高三種抗氧化酶的活力,抑制MDA的形成,提高GSH含量,從而對tBHP誘導的NIH3T3細胞氧化損傷起到保護作用,其中濃度為25 μg/mL時效果最佳。
2.6 氧化應激模型中ROS含量和MMP變化
ROS是導致細胞氧化損傷的主要因素,ROS含量越高,表明細胞損傷越大[24]。MMP指生物膜兩側離子濃度不同而產生的跨膜電位差,反應了線粒體膜的功能性,其下降是細胞凋亡早期的一個檢測指標[27]。本研究利用倒置熒光顯微鏡和流失細胞儀分析了南昆山毛葉茶水提物對tBHP誘導的NIH3T3細胞ROS產生及MMP變化的影響,結果如圖5、圖6所示。

圖6 南昆山毛葉茶水提物對tBHP損傷NIH3T3細胞MMP的影響Fig.6 Effects of Camellia ptilophylla chang water extract on MMP by tBHP damage in NIH3T3 cells注:A:流式細胞儀中熒光強度分布;B:流式細胞儀中平均熒光強度;#代表tBHP組與對照組相比, *代表樣品組與tBHP組相比,#(*)有顯著差異,即P<0.05,##(**)有極顯著差異,即P<0.01。
由圖5的熒光顯微鏡定性觀察和流式細胞儀定量分析結果可知,與對照組相比,tBHP處理導致ROS大量產生,二者存在極顯著差異。與tBHP組相比,南昆山毛葉茶水提物處理組極顯著的降低ROS含量,且隨茶葉水提物濃度的增加,ROS的產生量降低,呈劑量依賴關系。MMP結果從圖6中可知,據圖6A所示,對照組97.41%的細胞呈紅色熒光,表明MMP和細胞狀態較正常。而tBHP處理組中78.26%細胞呈綠色熒光,即MMP下降,細胞處于凋亡早期。南昆山毛葉茶水提物處理的樣品組中,呈綠色熒光細胞的比例隨水提物濃度的提高而逐漸降低,呈劑量依賴關系。當樣品濃度達到100 μg/mL時,呈綠色熒光細胞的比例降低至10.63%,表明MMP隨著水提物濃度的提高而增加,細胞中線粒體膜的損傷減少。由此說明,tBHP會導致MMP降低,細胞受損;而南昆山毛葉茶水提物隨著添加濃度的升高,MMP升高,顯示了其對NIH3T3細胞的氧化損傷具有保護作用。有研究發現tBHP能誘導的氧化應激損傷線粒體的軟骨膜,而導致MMP降低[28]。同時MMP也是線粒體通透轉換孔(mitochondrial permeablity transition pore,MPTP)開放的表征,而ROS則可以誘導MPTP開放,同時也促進自身線粒體產生ROS[27]。結合MMP和ROS結果可知,tBHP會導致NIH3T3細胞MMP降低,ROS含量增加,從而細胞受損;而南昆山毛葉茶水提物則會提高細胞MMP,降低ROS含量,減輕細胞受損程度,對細胞進行保護。
2.7 NIH3T3細胞凋亡相關蛋白的表達
caspase-3、caspase-9、細胞色素c均為凋亡蛋白,它們的活化程度越高及相對蛋白表達量升高,代表細胞發生凋亡[29-30]。為探究南昆山毛葉茶水提物對tBHP誘導NIH3T3細胞氧化損傷機制,本實驗采用分光光度法檢測caspase-3,caspase-9 蛋白活化程度,WB法檢測細胞色素c蛋白表達,結果如圖7所示。
Caspases在細胞凋亡過程中起關鍵作用,caspase-9可被線粒體向細胞質釋放的細胞色素c激活,激活的caspase-9可引起caspase-3的活化,活化后的caspase-3能裂解相應的底物,最終導致細胞凋亡[29]。細胞色素c是一種高度保守的電子轉運蛋白,也是定位于線粒體膜間隙的呼吸鏈的一部分,它的釋放與MMP的下降有關[30-31]。由圖7A、7B可看出,tBHP處理組的caspase-9、caspase-3凋亡蛋白的活性顯著提高,而南昆山毛葉茶水提物處理的樣品組中的caspase-9、caspase-3蛋白活性相較于tBHP組顯著降低,并呈劑量依賴關系。圖7C、7D結果顯示,本實驗tBHP處理組的細胞色素c蛋白表達顯著增強,而南昆山毛葉茶水提物處理樣品組的表達顯著降低,并呈劑量依賴關系。綜上結果表明,tBHP通過活化caspase-3、caspase-9蛋白,增強細胞色素c表達,導致NIH3T3細胞凋亡;而南昆山毛葉茶水提物則隨著添加濃度的升高,caspase-3、caspase-9的活化程度降低,細胞色素c表達降低,部分抑制NIH3T3細胞凋亡。說明南昆山毛葉茶水提物能部分抑制tBHP導致的NIH3T3細胞凋亡。
3 結論
本研究通過構建tBHP誘導NIH3T3細胞氧化損傷模型,評估南昆山毛葉茶水提物的抗氧化活性,并對其抗氧化機理進行初步探究。
南昆山毛葉茶水提物具有高可可堿、低咖啡堿,高GCG、低EGCG含量的特點;tBHP能誘導NIH3T3細胞氧化損傷,并導致細胞凋亡;南昆山毛葉茶水提物在25~100 μg/mL濃度范圍內,通過提高NIH3T3細胞中CAT、SOD、GSH-Px抗氧化酶酶活力,提高GSH含量,降低MDA含量,阻止脂質過氧化,減少ROS的積累,維持正常的MMP,同時減少細胞色素c的釋放,抑制caspase-9、caspase-3凋亡蛋白的表達,抑制線粒體細胞凋亡途徑,從而有效減緩tBHP誘導的NIH3T3細胞的氧化損傷。

