外排泵抑制劑對泛耐藥鮑曼不動桿菌生物被膜的影響*
王清會,藺 飛,袁明勇,凌保東△
1.成都醫(yī)學(xué)院 結(jié)構(gòu)特異性小分子藥物研究四川省高校重點實驗室(成都 610500); 2.成都醫(yī)學(xué)院 藥學(xué)院(成都 610500);3.成都醫(yī)學(xué)院臨床醫(yī)學(xué)院·第一附屬醫(yī)院(成都 610500)
細(xì)菌主要以浮游態(tài)和生物被膜態(tài)兩種形態(tài)存在于環(huán)境中,臨床上80%的細(xì)菌感染性疾病的持續(xù)與生物被膜的形成有關(guān)[1],由于臨床抗菌藥物的廣泛使用,促進(jìn)了細(xì)菌生物被膜的形成,導(dǎo)致細(xì)菌的耐藥性、致病性不斷提升,慢性感染、反復(fù)感染率不斷增加[2-3]; 研究[4-5]表明,外排泵在生物分子的細(xì)胞間信號傳遞中起重要作用,以協(xié)助生物被膜形成,通過對胞外多糖(exopolysaccharide,EPS)或群體感應(yīng)(quorum-sensing,QS)因子的外排,調(diào)控參與生物被膜形成的基因;阻止生物被膜中細(xì)菌的黏附等作用方式影響生物被膜的形成,是導(dǎo)致細(xì)菌耐藥的主要機(jī)制之一。對抗耐藥性的一種可能機(jī)制是采用外排泵抑制劑阻斷外排泵的相關(guān)功能,最終阻礙生物被膜的形成[6-7]。本研究擬探討泛耐藥鮑曼不動桿菌浮游狀態(tài)與生物被膜狀態(tài)下外排泵基因表達(dá)是否存在差異和外排泵抑制劑對生物被膜形成是否存在影響。
1 材料與方法
1.1 菌株來源
從成都醫(yī)學(xué)院第一附屬醫(yī)院收集9株2018—2019年住院患者臨床標(biāo)本的非重復(fù)泛耐藥鮑曼不動桿菌菌株(extensivelydrugresistantAcinetobacterbaumannii,XDRAB),經(jīng)過法國Bio-merieux公司Vitek32全自動微生物分析系統(tǒng)鑒定。質(zhì)控菌株鮑曼不動桿菌ATCC19606購自美國ATCC標(biāo)準(zhǔn)菌株數(shù)據(jù)庫,金黃色葡萄球菌ATCC29213、大腸埃希菌ATCC25922、銅綠假單胞桿菌ATCC27853為本實驗室留存。
1.2 實驗儀器
恒溫培養(yǎng)箱(上海一恒)、生物安全柜、恒溫?fù)u床、酶標(biāo)儀(SpectraMa190)、熒光定量PCR儀(biorad);96孔細(xì)胞培養(yǎng)板(科茲莫)、6孔細(xì)胞培養(yǎng)板(科茲莫)等。
1.3 抗菌藥物
美西林、氨芐西林鈉、美羅培南、亞胺培南、頭孢噻肟、頭孢他定、慶大霉素、阿米卡星、環(huán)丙沙星、左氧氟沙星、多西環(huán)素、米諾環(huán)素、替加環(huán)素、氨芐西林舒巴坦、頭孢哌酮舒巴坦、磺胺甲惡唑、多粘菌素B均購自大連美侖生物公司。試劑:維拉帕米(大連美侖生物公司)、奧美拉唑(上海源葉生物)、PAβN、CCCP購自上海皓元生物醫(yī)藥科技有限公司。胰酪大豆胨液體培養(yǎng)基(trypticase soy broth,TSB)、CAMHB肉湯培養(yǎng)基購自青島海博生物技術(shù)有限公司。酵母提取物、胰蛋白胨、瓊脂(英國OXOID公司);二甲基亞砜(成都市科龍化工試劑廠)、氯化鈉、無水乙醇、異丙醇(成都市科龍化工試劑廠)。
1.4 實驗方法
1.4.1 最低抑菌濃度(minimum inhibitory concentration,MIC)測定實驗 參照美國臨床實驗室標(biāo)準(zhǔn)化協(xié)會(clinical and laboratory standards institute,CLSI) 2019標(biāo)準(zhǔn)采用微量肉湯稀釋法測定浮游狀態(tài)下9株XDR AB對17種抗菌藥物的MIC值;參照文獻(xiàn)[6-8]測定生物被膜狀態(tài)下的最低抑菌濃度,即在96孔細(xì)胞培養(yǎng)板中加入190 μL TSB培養(yǎng)基和OD600為0.1的鮑曼不動桿菌重懸液10 μL,37 ℃孵育24 h,移除浮游菌,加入200 μL PBS洗滌3次,再加入CAMHB肉湯培養(yǎng)基和抗菌藥物的混合培養(yǎng)基,在37 ℃下孵育16~20 h,記錄結(jié)果。
1.4.2 外排泵抑制劑工作濃度的確定 PAβN、奧美拉唑、維拉帕米對9 株XDR AB的MIC值均>512 mg/L,CCCP的MIC值為16 mg/L,最終確定PAβN、奧美拉唑、維拉帕米選取128 mg/L,CCCP選取8 mg/L,在該工作濃度下均不影響細(xì)菌的生長。
1.4.3 生物被膜形成實驗 結(jié)晶紫染色法:9株XDR AB菌株解凍后接種在LB固體培養(yǎng)基中過夜,用0.9%生理鹽水調(diào)整其OD600=0.1。然后,接種到96孔細(xì)胞培養(yǎng)板,平板在37 ℃靜置培養(yǎng)24 h。用1×PBS清洗3遍去除浮游細(xì)菌,靜置30 min晾干96孔板;每孔加入200 μL 0.1%結(jié)晶紫,染色15 min。移除結(jié)晶紫,無菌PBS輕輕洗3次,靜置30 min使96孔板晾干;在每孔中加入200 μL 95%的乙醇溶液,靜置15 min,使結(jié)晶紫完全溶解,測定OD570。
1.4.4 實時定量聚合酶鏈反應(yīng)(qRT-PCR) 測定9株XDR AB浮游狀態(tài)與生物被膜狀態(tài)下外排泵基因adeB、adeG、adeJ的表達(dá)情況.以16S rRNA基因作為內(nèi)參基因,進(jìn)行RNA提取(高純RNA分離試劑盒,生工生物)和cDNA合成(cDNA合成試劑盒,諾維贊)。使用熒光染料SYBR Premix Ex Taq Ⅱ(諾維贊),一式三份測量參與外排泵基因的表達(dá)水平。qRT-PCR總反應(yīng)體積為10 μL反應(yīng)條件:95 ℃預(yù)變性2 min, 95 ℃ 5 s,60 ℃ 30 s共40個循環(huán),融解曲線95 ℃ 5 s,60 ℃ 5 s,95 ℃ 50 s。16S rRNA作內(nèi)部對照,以標(biāo)準(zhǔn)化每個基因轉(zhuǎn)錄本的水平,統(tǒng)計學(xué)分析采用配對樣本t檢驗。內(nèi)參基因及外排泵基因引物序列如下(表1)。

表1 qRT-PCR檢測外排泵基因表達(dá)引物情況
1.5 統(tǒng)計學(xué)方法
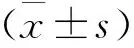
2 結(jié)果
2.1 17種抗菌藥物對浮游狀態(tài)下 9 株XDR AB的 MIC 值
參照CLSI 2019標(biāo)準(zhǔn), 浮游狀態(tài)下9 株 XDRAB除對替加環(huán)素、多黏菌素 B敏感外,對包括碳青霉烯類、 β-內(nèi)酰胺類、氨基糖苷類、氟喹諾酮類、 四環(huán)素類等抗菌藥物均耐藥(表2)。

表2 17種抗菌藥物對9株 XDR AB浮游狀態(tài)下的 MIC值
2.2 17種抗菌藥物對生物被膜狀態(tài)下 9 株XDR AB的 MIC 值
生物被膜狀態(tài)下, 9 株XDR AB對 17種抗菌藥物的 MIC進(jìn)一步增加,其中多黏菌素B的MIC值上升了4~16倍,替加環(huán)素的MIC值上升了8~32倍(表3)。

表3 17種抗菌藥物對9株XDR AB生物被膜狀態(tài)下的MIC值
2.3 9株XDR AB生物被膜形成前后的MIC值比較
對浮游狀態(tài)與生物被膜狀態(tài)下 9株XDR AB的MIC50和MIC90進(jìn)行了比較,除氨芐西林舒巴坦外,抗菌藥物在生物被膜狀態(tài)下MIC50和MIC90均呈現(xiàn)不同程度的上升(表4)。

表4 9株XDR AB生物被膜形成前后的MIC值比較(mg/L)
2.4 4種EPIs對XDR AB生物被膜形成的影響
在工作濃度下4種EPIs對XDR AB生物被膜的形成均有不同程度的抑制作用,與對照組(1.39±0.06)相比,PAβN(0.74±0.04)的抑制作用最強(qiáng),其次分別為CCCP(0.78±0.04)、維拉帕米(0.93±0.10)和奧美拉唑(0.95±0.09),生物被膜形成的減少量差異有統(tǒng)計學(xué)意義(P<0.05)(圖1)。

圖1 4種外排泵抑制劑對XDR AB生物被膜形成的影響
2.5 浮游與生物被膜狀態(tài)外XDR AB排泵基因表達(dá)結(jié)果
qRT-PCR測定9株XDR AB的實驗結(jié)果表明,在生物被膜狀態(tài)下,3種外排泵基因中除adeG表達(dá)量無明顯變化外,adeB和adeJ的表達(dá)量分別為(0.95±0.03)、(1.99±0.27),與浮游狀態(tài)adeB(0.21±0.01)、adeJ(0.87±0.04)相比差異有統(tǒng)計學(xué)意義(P<0.05)(圖2)。

圖2 9株XDR AB的浮游狀態(tài)與生物被膜狀態(tài)外排泵基因表達(dá)情況
3 討論
目前,國內(nèi)外對XDR AB生物被膜形成前后耐藥性變化與外排泵的關(guān)系研究不多。本研究實驗結(jié)果顯示,與浮游菌相比較,生物被膜狀態(tài)下鮑曼不動桿菌對于抗菌藥物的耐藥性呈倍數(shù)增加,與藺飛等[9]的研究結(jié)果一致。XDR AB生物被膜狀態(tài)下外排泵基因adeB表達(dá)水平增強(qiáng)了4倍,adeJ表達(dá)水平增強(qiáng)了2倍。本研究應(yīng)用的4種外排泵抑制劑均能不同程度減少XDR AB生物被膜的形成,以PAβN的抑制效果最明顯,其次是CCCP、維拉帕米和奧美拉唑。有研究[10]表明,細(xì)菌的生物被膜形成后,其耐藥性和黏附性進(jìn)一步增強(qiáng),使其能夠不可逆地附著于生物或者非生物的表面,表現(xiàn)出相對于浮游菌在結(jié)構(gòu)、基因表型和生化特性的改變[11];而PAβN是一種廣譜的外排泵抑制劑,能夠增加生物被膜狀態(tài)下細(xì)菌外膜的通透性[12],使抗菌藥物更容易進(jìn)入細(xì)菌細(xì)胞發(fā)揮作用[13-15]。在生物被膜細(xì)菌中,外排泵抑制劑與外排泵結(jié)合發(fā)揮作用時,其作用機(jī)制主要包括,EPIs可與底物結(jié)合在同一位點,發(fā)揮競爭性抑制的作用,當(dāng)外排泵表達(dá)時,優(yōu)先排出EPIs,減少了抗菌藥物的流失;另一方面,EPIs可通過阻礙外排泵的功能起作用。 EPIs還能通過影響生物被膜細(xì)菌的 QS系統(tǒng)和毒力基因的表達(dá),減少生物被膜的產(chǎn)生,同時降低細(xì)菌毒性[16-18]。外排泵抑制劑通過以上方式影響著生物被膜的形成及細(xì)菌的耐藥性,不失為一種減少細(xì)菌生物被膜形成與降低細(xì)菌耐藥性的有效方式。

