桔青霉產核酸酶P1酶分離純化及其酶學性質
李 明,余華順,喻 晨,吳 堯,龔大春,
(1.三峽大學生物與制藥學院,湖北宜昌 443002;2.中國輕工業功能酵母重點實驗室(三峽大學),湖北宜昌 443002;3.安琪酵母股份有限公司 特種酶制劑事業部,湖北宜昌 443003)
核酸酶P1,又名5’-磷酸二酯酶,它是一種含鋅金屬酶。桔青霉(Penicillium citrinum)來源的核酸酶P1,分子量約為44 kDa,由331個氨基酸多肽單鏈構成,含有2個二硫鍵,其活性中心存在一個三鋅結構。核酸酶P1的作用為水解RNA和催化水解熱變性DNA中的磷酸二酯鍵得到5’-核苷酸。5’-核苷酸具有很好的營養保健作用,其中5’-GMP和5’-AMP是天然的風味增強劑,能夠顯著提高產品的風味特征,還可以作營養補充劑、藥物前體物質。隨著人們對健康生活需求的提升,酶法水解核酸得到的天然核苷酸的需求不斷增長,其廣泛應用于食品、藥品、保健品及飼料中[1-3]。核酸酶P1在核苷酸工業化生產中的應用至關重要。核酸酶P1還可以應用于分子生物學方面的研究,如測定病毒RNA的5’-末端核苷酸序列[4]。Bai等[5]利用核酸酶P1具有使適配體與磺胺二甲氧基形成偶聯物的原理建立了一種檢測磺胺二甲氧基的電化學檢測方法。隨著核酸酶P1在更多領域的應用,對該酶的分離純化及其酶學性質開展研究,將對高純度核酸酶P1工業化生產及其應用具有重要意義。
目前,有文獻報道了對核酸酶P1菌株選育[6-10]和發酵工藝[11-14]的相關研究,李兆飛等[6]將桔青霉菌株經氯化鋰-離子束復合誘變篩選得到核酸酶P1高產菌株;鄭美娟等[7]以桔青霉AG-R1為出發菌株,研究了甲苯胺藍-RNA平板篩選方法,為工業化快速選育產核酸酶P1菌種提供高效方法;田呂明等[12-13]以Logistic方程和Luedeking-Piret方程為基礎,研究了桔青霉發酵生產核酸酶P1的發酵動力學特性,還運用響應面法和爬坡路徑法等多種方法優化得到桔青霉產核酸酶P1的最佳發酵培養基;喻晨等[14]采用部分析因試驗設計、中心組合實驗設計和響應面分析法對桔青霉產核酸酶P1培養基進行優化研究。但對該酶的分離純化及其酶學性質研究報道較少[15-16]。本研究擬通過脫色、鹽析、凝膠層析等分離步驟將桔青霉產核酸酶P1濃縮液純化后,測定核酸酶P1的酶學動力學常數Km、Vm、Kcat,并開展其酶學性質研究,為核酸酶P1的開發奠定了科學基礎。
1 材料與方法
1.1 材料與儀器
核酸酶P1濃縮液 桔青霉發酵生產,由安琪酵母特種酶生產部提供;硫酸銨、活性炭、酵母RNA均為分析純。
HiTripTMDesalting和SuperdexTM75 10/300 GL
美國GE AKTA;Pure 25 M1蛋白純化儀 美國GE AKTA;UV-2802H紫外可見分光光度計 上海尤尼柯儀器有限公司;Pilot 2-4hH真空冷凍干燥機 北京博醫康實驗儀器有限公司;DYY-5電泳儀 北京市六一儀器廠。
1.2 實驗方法
1.2.1 分離純化工藝 核酸酶P1濃縮液→活性炭吸附脫色→硫酸銨分級沉淀→HiTripTMDesalting脫鹽→SuperdexTM75 10/300 GL凝膠層析→純化酶→凍干
活性炭吸附脫色:于8個三角瓶中稱取一定量的核酸酶P1濃縮液,然后分別添加0.3%、0.5%、0.7%、0.9%、1.1%、1.3%、1.5%、1.7%的粉末活性炭,于60 ℃機械攪拌1 h。去除活性炭殘渣后,將脫色酶液在420 nm下測定OD,計算脫色率[17]。選擇脫色最理想的活性炭用量,將核酸酶P1濃縮液脫色處理,得到脫色酶液。
硫酸銨分級沉淀[18]:量取上述脫色酶液,逐級添加硫酸銨,使其飽和度依次達到40%、50%、60%、65%、70%、75%、80%、85%,收集各級沉淀。
HiTripTMDesalting脫鹽:將上述比酶活最高的沉淀用醋酸緩沖液(10 mmol/L,pH5.5)溶解,上HiTripTMDesalting柱,上樣量為0.5 mL,用醋酸緩沖液(10 mmol/L,pH5.5)洗脫,選擇合適的流速(流速初設為0.5 mL/min),收集主要蛋白峰,根據在線監測電導率,驗證脫鹽效果[19],將收集的目的峰樣品凍干保存。
SuperdexTM75 10/300 GL凝膠層析:將脫鹽后的凍干樣品用醋酸緩沖液(10 mmol/L,pH5.5)溶解,用SuperdexTM75 10/300 GL凝膠柱層析,上樣量為0.5 mL,流速為0.8 mL/min,用醋酸緩沖液(10 mmol/L,pH5.5)洗脫,分段收集第一個蛋白峰,每分鐘收集1管,依次收集5管,將收集的樣品凍干,得到純化酶。
凍干:將需要凍干保存的樣品放在真空冷凍干燥機樣品盤內,經過預凍、升華干燥、解析干燥得到凍干純化酶。
1.2.2 分析檢測方法
1.2.2.1 蛋白濃度測定 用考馬斯亮藍法(Bradford法)[18],以考馬斯亮藍R-250溶液為顯色劑,通過可見光分光光度法,參照牛血清蛋白制作的標準曲線測定每個樣品的蛋白濃度。
1.2.2.2 SDS-PAGE電泳分析 使用SDS-PAGE連續電泳,按要求配制分離膠、濃縮膠、染色液及脫色液。以考馬斯亮藍R-250為染色液,標準蛋白Marker的分子量分別為5、15、30、35、50、65、95、130 kDa。上樣樣品的蛋白濃度均稀釋至1~2 mg/mL范圍內再處理上樣。
1.2.2.3 核酸酶P1酶活檢測 采用紫外分光光度法[7],以酵母RNA為底物,在68 ℃水浴中與稀釋酶液反應,用核酸沉淀劑終止反應后,在260 nm波長下測OD260,以先加沉淀劑者為對照,計算光密度差(△OD)。在上述條件下,每分鐘生成的核苷酸使260 nm處的光密度差值為1.0時的酶量為一個酶活單位。
1.2.3 酶學特性研究
1.2.3.1 最適pH和pH穩定性 在pH4.0、4.5、5.0、5.5、6.0、6.5環境下分別檢測純酶酶活,研究該酶最適pH;將純酶分別在pH3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0 醋酸緩沖液體系中靜置1 h后檢測殘余酶活,研究該酶的酸堿耐受度。
1.2.3.2 最適溫度和溫度穩定性 在40、50、60、65、70、75、80、85、90、95 ℃溫度條件下測定純酶酶活,研究該酶最適溫度;將純酶分別在40、50、60、65、70、75、80、85 ℃幾個溫度條件下保溫1 h后檢測殘余酶活,研究該酶耐熱特性。
1.2.3.3 金屬離子的影響 將純酶分別用終濃度為1、5、10、50 mmol/L的金屬離子(Ni2+、Fe2+、Cu2+、Zn2+、Mg2+、Mn2+、Ca2+、Co2+、Pb2+)溶液溶解,于25 ℃靜置60 min后測定殘余酶活,將不外加金屬離子時的酶活設置為100%。
1.2.3.4 動力學參數米氏常數Km、最大反應速度Vm和催化常數Kcat的測定 以酵母RNA為底物,分別在底物濃度為1.52、2.28、3.04、3.81、4.57 mmol/L測定反應時間分別為5、7、9、11、13、15 min的酶活,繪制每個底物濃度下酶活-反應時間圖,擬合趨勢線,求出斜率即為該底物濃度下的酶促反應速率[20],再依據Lineweaver-Burk作圖法[21-24]作圖,由米氏方程的變形式得出米氏常數Km和最大反應速度Vm。Km表示酶與底物的親和能力,Km值越小,親和能力越強。催化常數Kcat(s-1)是酶的催化常數,表示單位時間內每一活性中心或每分子酶所能轉換的底物分子數,反映了酶催化特定底物的能力大小。根據每秒鐘核酸酶P1蛋白分子數所能轉化的核酸RNA分子數的比值[25-27],計算出Kcat。
1.3 數據處理
本研究用OriginPro 9.0和Excel 2007進行數據處理。
2 結果與討論
2.1 核酸酶P1的純化
2.1.1 活性炭用量對核酸酶P1脫色效果的影響 由圖1可知,當活性炭用量小于0.9%時,脫色率隨著活性炭用量的增加而急劇增加,當活性炭用量大于0.9%時,脫色率緩慢增加,當活性炭用量達到1.5%,再繼續增大用量,脫色效果增加不明顯。因此活性炭用量1.5%為最佳用量,此時脫色率達到91%。
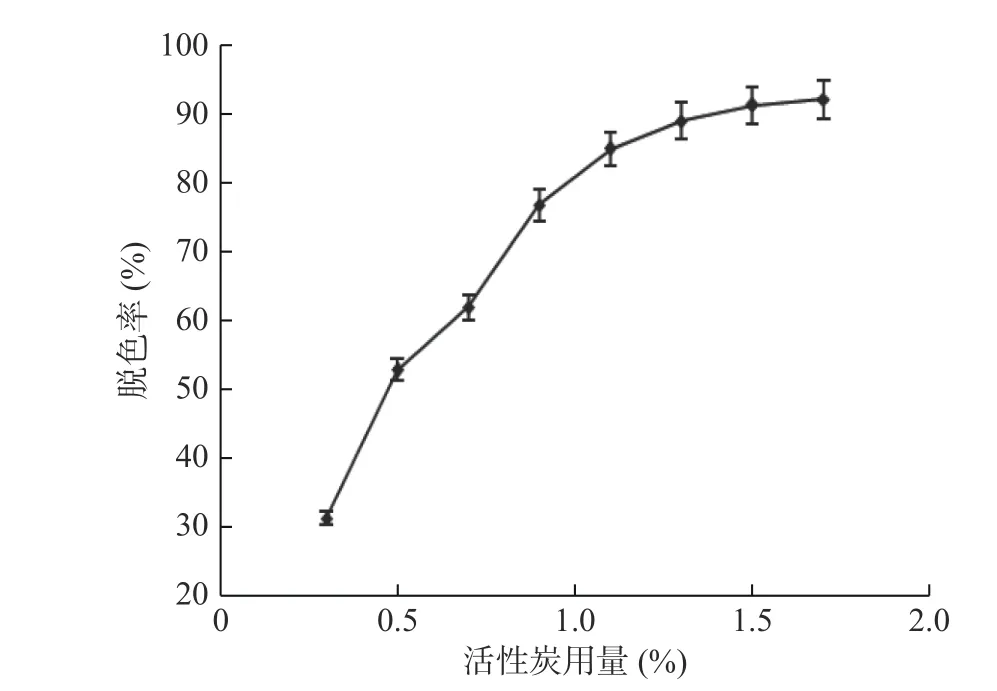
圖1 不同活性炭用量對脫色效果的影響Fig.1 Effect of diffrent amount of activated carbon on decolorization
2.1.2 硫酸銨濃度對核酸酶P1的分級沉淀效果的影響為了考察硫酸銨的濃度對核酸酶P1的沉淀效果,按照1.2.1進行分級沉淀,實驗結果見表1。由表1可知,在脫色酶液中逐級添加硫酸銨,上清液比酶活逐漸減小,沉淀比酶活先增后減,當硫酸銨飽和度達到65%時,收集的沉淀酶的比酶活最高,可以達到15157 U/mg,后期再增加硫酸銨濃度會導致部分酶失活,比酶活反而下降。
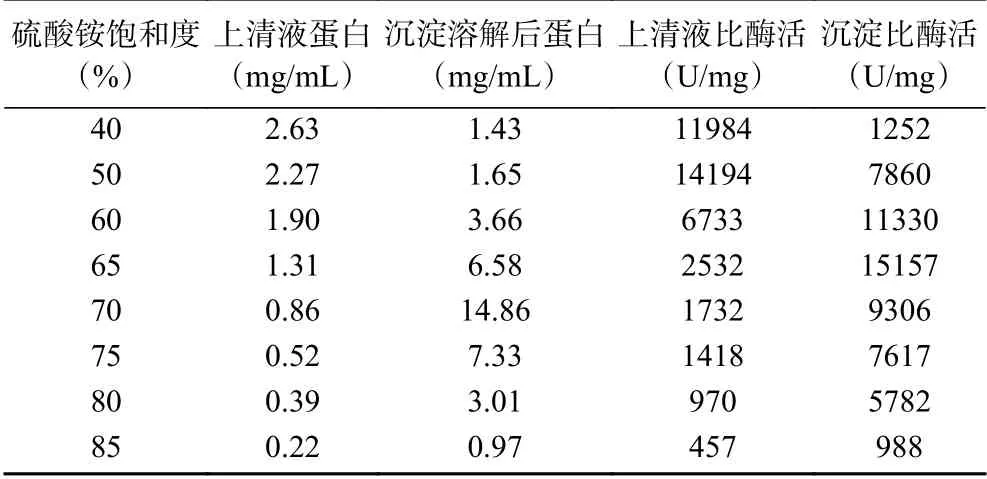
表1 不同濃度硫酸銨分級沉淀的比酶活Table 1 The specific enzyme of (NH4)2SO4 fractionation
2.1.3 HiTripTMDesalting脫鹽效果 利用美國GE公司蛋白質純化儀,采用脫鹽柱HiTripTMDesalting,上樣量為0.5 mL,用醋酸緩沖液(10 mmol/L,pH5.5)洗脫,當流速為0.5 mL/min時,鹽分與目的蛋白峰很難分開,當流速為0.3 mL/min時,樣品中的鹽分與目的峰(第一個蛋白峰)有效分開,收集第一個蛋白峰洗脫液,見圖2。第一個含鹽較少的蛋白峰收集樣電導率為0.85 mS/cm,第二個蛋白峰電導率為7.45 mS/cm。由此可見,該脫鹽柱可將鹽析沉淀樣中的大部分鹽分除去。
2.1.4 SuperdexTM75 10/300 GL凝膠層析 由圖3可知,將脫鹽后的凍干樣經過SuperdexTM75 10/300GL凝膠層析(該層析柱對球狀蛋白最佳分離范圍是3~70 kDa),共收集到兩個蛋白峰,其中,第一個蛋白峰酶活最高,將該蛋白峰依次收集的5管樣品凍干后分析,其中第3管如圖4泳道4所示,主帶清晰,且比酶活最高,達到33967 U/mg。
2.1.5 SDS-PAGE電泳實驗 在上樣前將各個樣品的蛋白濃度稀釋至1~2 mg/mL范圍內,然后再進行處理,上樣。純化效果如圖4所示,泳道1為核酸酶P1發酵濃縮液。發酵濃縮液經過活性炭脫色、硫酸銨沉淀、脫鹽柱層析及SuperdexTM75 10/300 GL凝膠層析后,獲得純化酶(圖4泳道4所示),該純化酶電泳條帶清晰且雜帶較少,分子量約為44 kDa。
按照1.2.1的方法,將核酸酶P1濃縮液經過脫色、鹽析、脫鹽、凝膠層析等分離純化過程,其中,分別將鹽析沉淀稀釋至120 mL,脫鹽收集酶液凍干后稀釋至60 mL,凝膠層析收集酶液凍干后稀釋至40 mL,再進行蛋白濃度及酶活力測定,結果見表2。從表2中可以看出,經過5步分離純化后,比酶活達到33967 U/mg,純化倍數為8.48倍。
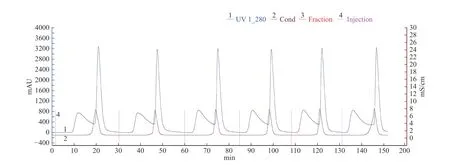
圖2 HiTripTM Desalting脫鹽圖譜Fig.2 The desalination spectrum of HiTripTM Desalting

圖3 SuperdexTM 75 10/300 GL凝膠層析圖譜Fig.3 The chromatogram of SuperdexTM 75 10/300 GL
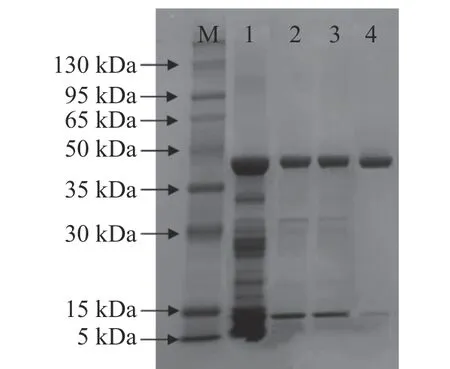
圖4 核酸酶P1純化SDS-PAGE電泳圖Fig.4 SDS-PAGE electrophoresis of purification of the nuclease P1
2.2 核酸酶P1酶學特性分析
2.2.1 pH對核酸酶P1酶促反應的影響 按照1.2.3方法,開展核酸酶P1對不同酸度的耐受度。pH對核酸酶P1酶促反應影響如圖5所示,核酸酶P1最適反應pH為5.5,該酶作用pH偏酸性且范圍較廣,在pH4.0~6.0環境中仍然具有80%以上的相對酶活。
2.2.2 溫度對核酸酶P1酶促反應的影響 溫度對核酸酶P1酶促反應的影響如圖6A所示,短時間內核酸酶P1的最適反應溫度為75 ℃。核酸酶P1的一級結構中有54%為疏水性氨基酸,從而形成較為緊密的結構,這種結構可能使其具有良好的熱穩定性[14]。通過將純酶置于40~85 ℃條件下,且pH5.5,處理1 h后檢測殘余酶活,研究其穩定性,結果見圖6B。從圖中可以看出,該酶在65 ℃以下儲存穩定性很好,高于65 ℃其酶的穩定性開始下降,70 ℃時候酶活下降到相對酶活的80%。本研究表明綜合考慮酶活損失與催化效率,該核酸酶P1在核苷酸生產工藝中適宜溫度范圍為60~75 ℃之間。
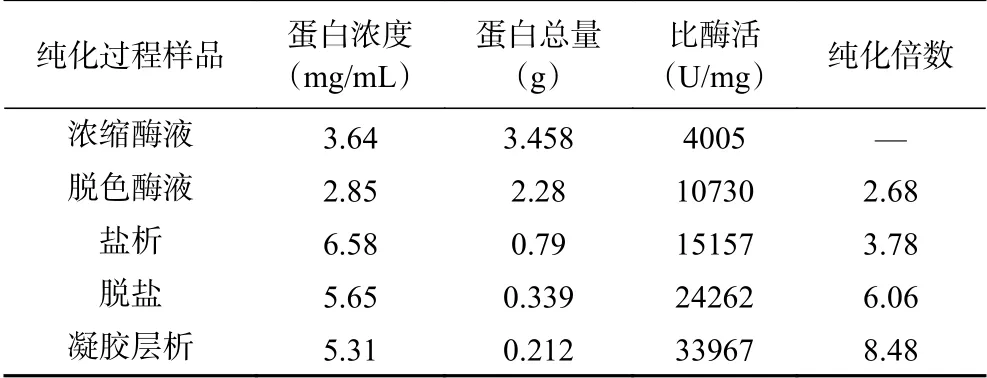
表2 各分離步驟的純化結果Table 2 Purification result of each separation step
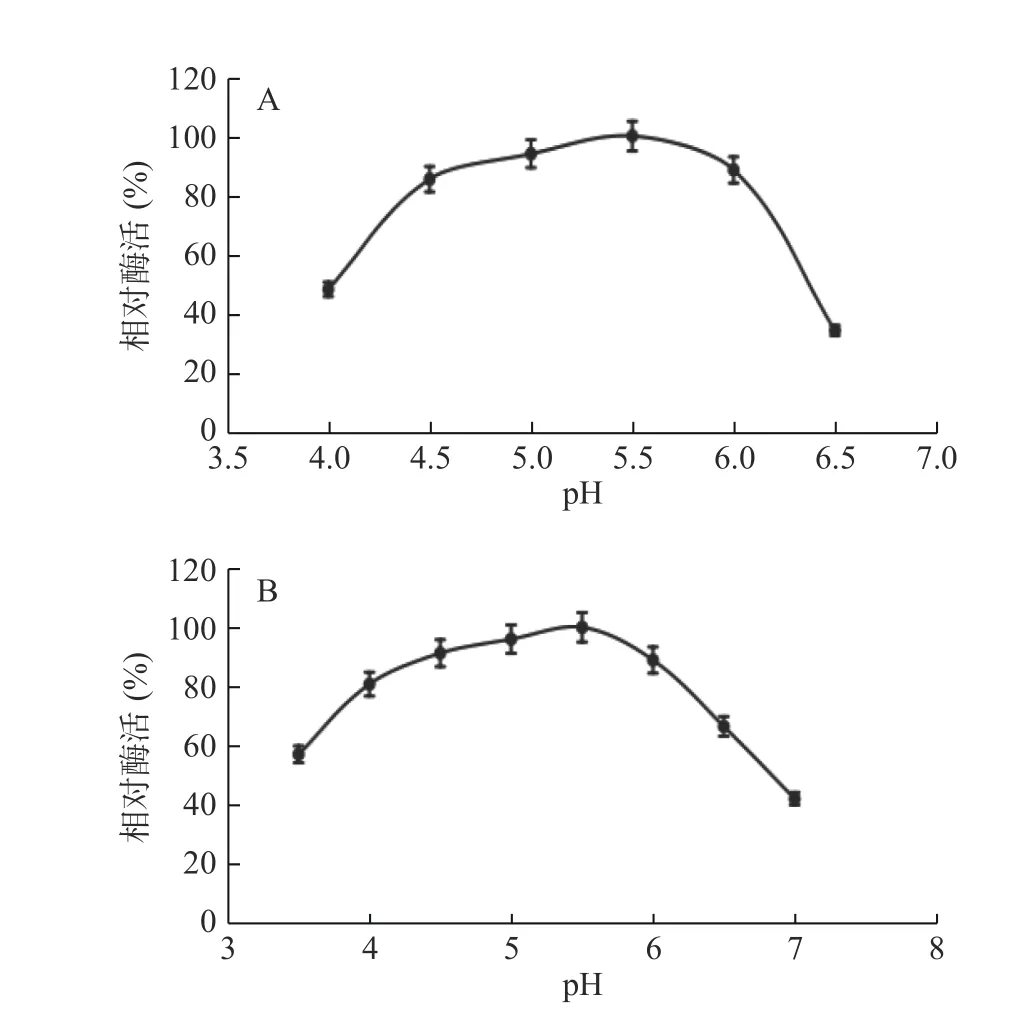
圖5 核酸酶的最適pH和pH穩定性Fig.5 Optimum pH and pH stability of nuclease P1
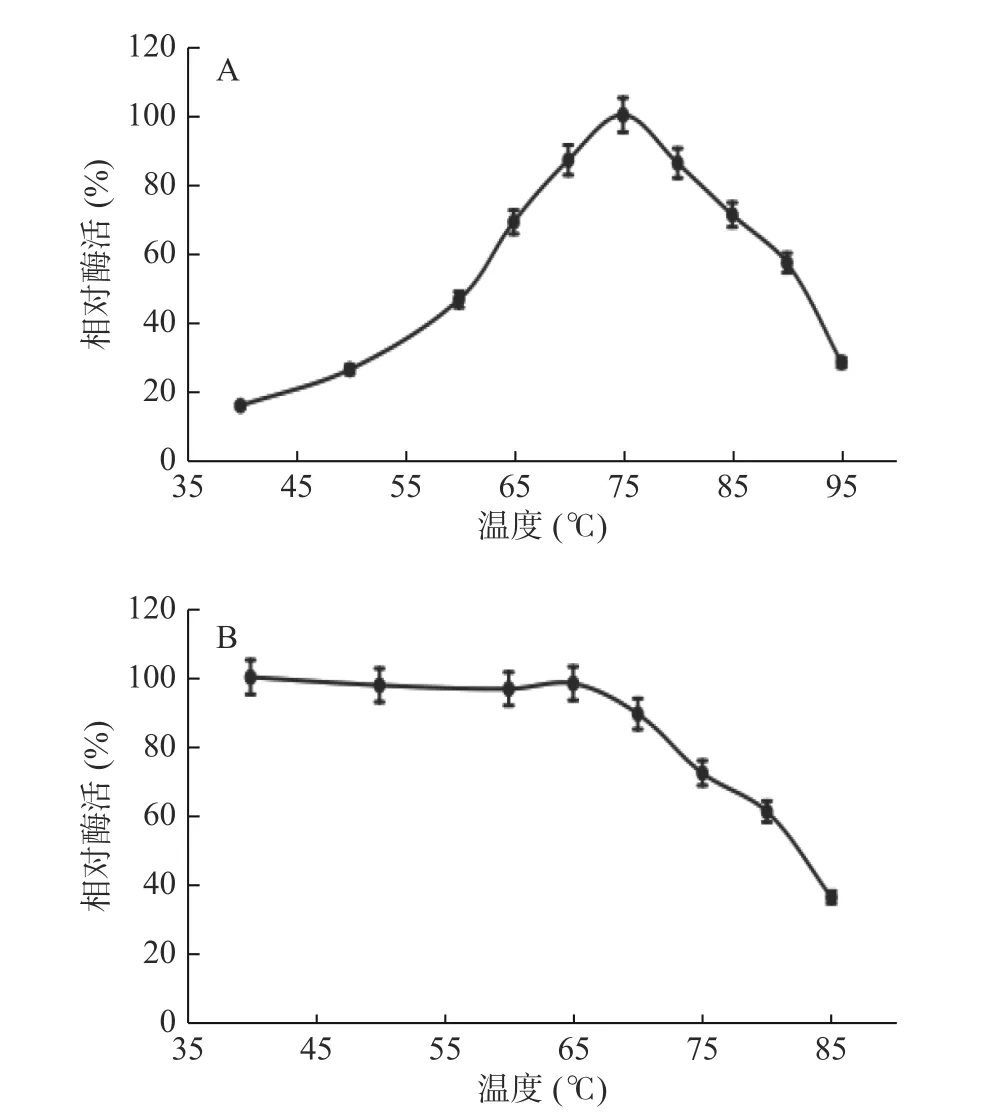
圖6 核酸酶P1最適反應溫度和溫度穩定性Fig.6 Optimum reaction temperature and temperature stability of nuclease P1
2.2.3 金屬離子對酶活性的影響 金屬離子對核酸酶P1催化水解RNA反應的影響如圖7所示。從圖7中可以看出,在1 mmol/L條件下Zn2+對核酸酶P1有明顯激活作用,Mg2+、Mn2+、Ca2+在1 mmol/L條件下有輕微激活作用,而Ni2+、Fe2+、Cu2+、Mn2+、Co2+在50 mmol/L條件下有明顯的抑制作用,酶活分別下降到64%、55%、3%、67%和55%,特別是Cu2+在1~50 mmol/L之間有酶活明顯下降趨勢,說明Cu2+對核酸酶P1具有強烈抑制作用。因此在核苷酸生產過程中可以添加適當濃度的Zn2+,但應當避免接觸含銅、鈷離子的化合物,其他離子應控制在10 mmol/L以下。
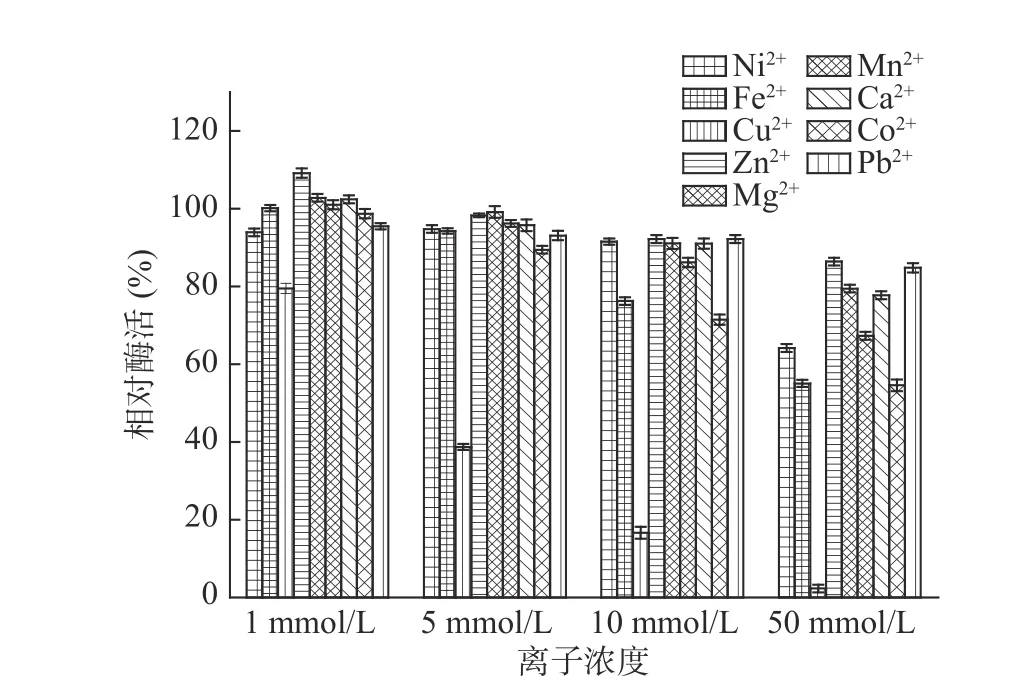
圖7 金屬離子對核酸酶P1活性的影響Fig.7 The effect of metal ion on nuclease P1 activity
2.2.4 核酸酶P1動力學參數Km、Vm和Kcat的測定由圖8可得該酶的最大反應速度Vm為0.0864 mmol/(mL·min),米氏常數Km為2.50 mmol/L,根據核酸酶P1的分子量和底物濃度得出催化常數Kcat為252.43 s-1,即理論上該核酸酶P1每秒鐘可以將252個RNA底物分子周轉化成產物。
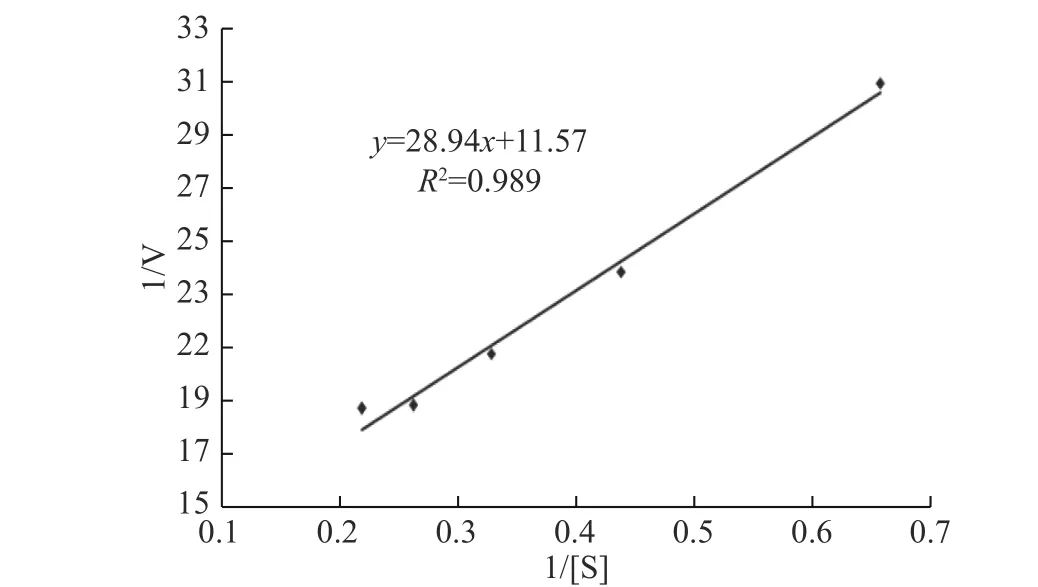
圖8 核酸酶P1的動力學參數測定雙倒數圖Fig.8 Double-reciprocal plot for determination of nuclease P1 dynamics parameters
3 結論
本研究設計的純化方法簡單、快速,利用脫色、鹽析、色譜分離等手段純化得到核酸酶P1純組分,酶蛋白經SDS-PAGE電泳分析,呈現單一主帶,該核酸酶P1組分比酶活為33967 U/mg,純化倍數為8.48倍;測定了該酶的米氏常數Km、最大反應速度Vm和催化常數Kcat,分別為2.50 mmol/L、0.0864mmol/(mL·min)和252.43 s-1;該 酶 在60~70 ℃,pH4.0~6.0條件下仍具有較高相對酶活。與其他核酸酶P1相比,該核酸酶P1具有較好的熱穩定性及更廣的應用pH范圍,且與底物RNA有更強的親和能力。Zn2+對該酶有很好的激活作用,Cu2+對其有抑制作用,該酶可廣泛應用于酵母深加工和核苷酸生產領域。
近幾年,核酸酶P1除了應用于核苷酸生產中,還被應用于分子生物學及檢測方法等方面的研究,如測定病毒RNA的5’-末端核苷酸序列,檢測磺胺二甲氧基的電化學檢測方法。隨著對核酸酶P1越來越深入的研究,它將具有更廣闊的應用前景,同時,也對核酸酶P1提出了更高的要求,需要進一步探究并開發高品質產品。

