超高效液相色譜-串聯質譜法同時測定玉米中9種真菌毒素
譚 莉,孟繁磊,范 宏,ANNA Nowacka,魏春雁,
(1.吉林省農業科學院農業質量標準與檢測技術研究所/農業農村部農產品質量安全風險評估實驗室(長春),吉林長春 130033;2.波蘭國立植物保護研究所,波茲南 60-318)
真菌毒素(Mycotoxin)又稱霉菌毒素,是真菌在適宜的環境條件下產生的有毒次級代謝產物[1],糧食在生長期、收獲期和儲存期都可能被真菌毒素污染,直接或間接進入人類食物鏈中,威脅人類健康[2-3]。黃曲霉毒素(Aflatoxins,AFT)是迄今發現的毒性最強的一類真菌毒素,主要由黃曲霉和寄生曲霉產生,AFTB1、AFTB2、AFTG1和AFTG2四種是其重要的代表性成分,其中,AFTB1的毒性最強[4]。伏馬毒素(Fumonisins, FB)主要是由串珠鐮刀菌屬真菌產生的一類強毒和致癌性的真菌毒素,FB1、FB2、FB3是其代表性成分,其中,毒性最強的FB1是其主要成分[5]。嘔吐毒素(又名脫氧雪腐鐮刀菌烯醇Deoxynivalenol, DON)和玉米赤霉烯酮(Zearalenone,ZEN)主要由鐮刀菌屬真菌產生,是目前為止對糧食污染最普遍的毒素[6-7]。真菌毒素污染是全球性問題,有研究對來自全球72個國家的18757個農產品樣品進行篩查,發現部分樣品受到不同程度的真菌污染,其中,我國樣品中FB、AFTB、ZEN和DON等檢出率均超過25%,并且存在混合污染現象[8-9]。嚴格控制這些真菌對玉米等糧油作物及其他農產品的污染,是保障人類健康的必然要求[10]。
開發玉米等農產品中真菌毒素高效檢測技術,是掌握玉米等農產品中真菌毒素污染水平的重要手段,是為玉米等農產品生產中疫情監測和適宜防疫措施的建立提供的一種有力技術支持,對玉米等產業持續健康發展具有重要作用。目前,真菌毒素的檢測方法主要有液相色譜法[11-12]、熒光光度法[13-14]、酶聯免疫吸附法[15-16]、薄層色譜法[17-18]和液相色譜-串聯質譜法[19-20]等。樣品中真菌毒素凈化方法一般用免疫親和柱等凈化柱進行固相萃取,不僅存在過程繁瑣,成本較高等問題,并且在檢測過程中同時測定毒素種類較少;而本文綜合利用UPLC-MS/MS和QuEChERS法的優勢,在相關研究的基礎上,建立了快速準確的測定玉米中9種真菌毒素的方法。
本文借助超高效液相色譜-串聯質譜儀,通過對提取方法的改進,以及對色譜、質譜條件優化降低基質干擾,旨在建立玉米中AFTB1、AFTB2、FB1、FB2、FB3、DON、15-ADON、3-ADON和ZEN 9種真菌毒素同時檢測的一種高效方法,為玉米等農產品中真菌毒素的檢測、污染監測及風險評估提供技術支撐。
1 材料與方法
1.1 材料與儀器
待測玉米樣品 2019年秋收時節采集自吉林省,共240份;空白玉米樣品 本實驗室2018年檢測并留存的無生物毒素污染的玉米樣品1份;標準物質AFTB1(2.02 μg/mL)、AFTB2(0.502 μg/mL)、ZEN(100.2 μg/mL)、FB1(50.1 μg/mL)、FB2(50.0 μg/mL)、FB3(50.3 μg/mL)、DON(100.0 μg/mL)、15-ADON(100.1 μg/mL)和3-ADON(100.3 μg/mL)ROMER公司;乙腈、甲醇、甲酸 色譜級,美國Thermo Fisher公司;萃取包填料為4 g無水硫酸鎂、1 g氯化鈉、1 g檸檬酸鈉二水合物和0.5 g檸檬酸二鈉 美國Agilent公司。
QTRAP 5500質譜儀 美國AB Sciex公司;LC-30A超高效液相色譜儀 日本Shimadzu公司;GENIUS 3渦旋混勻器 德國IKA公司;MULTIFUGE X3R離心機 美國Thermo Fisher公司;HZQ-C空氣浴振蕩器 東聯電子技術開發有限公司;FW-100高速萬能粉碎機 北京市永光明醫療儀器有限公司。
1.2 實驗方法
1.2.1 樣品前處理 取玉米試樣,高速粉碎機粉碎過18目篩子,混勻,稱取2.00 g于50 mL離心管內,加入20 mL 80%乙腈-0.1%甲酸水溶液,恒溫振蕩器內振蕩提取30 min,加入萃取包,振搖2 min凈化,10000 r/min離心5 min,取上清液2.0 mL于試管內,50 ℃水浴氮吹至近干,用1.0 mL甲醇-水溶液(v/v=1:1)溶解,渦旋1 min,過0.22 μm濾膜于樣品瓶內,待上機。
1.2.2 標準溶液的配制
1.2.2.1 單標溶液的配制 移取FB1、FB2、FB3標準物質各10 μL,DON、15-ADON、3-ADON和ZEN標準物質各5 μL分別用甲醇定容到10 mL容量瓶內,移取AFTB1標準物質120 μL用甲醇定容到5 mL容量瓶內,移取AFTB2標準物質200 μL用甲醇定容到2 mL容量瓶內,即:將9種真菌毒素分別配制成50 μg/L的單標溶液。
1.2.2.2 混合標準中間液的配制 取10 mL容量瓶1只,分別準確移入FB1、FB2和FB3標準品溶液各100 μL,配制濃度為0.50100、0.50000、0.50300 μg/mL;移入DON、15-ADON、3-ADON和ZEN標準品溶液各50 μL,配制濃度為0.50020、0.50020、0.50060 μg/mL;移入AFTB1標準品溶液200 μL,配制濃度為0.04004 μg/mL;AFTB2標準品溶液400 μL,配制濃度為0.02008 μg/mL;用甲醇定容至刻度,-20 ℃保存備用。
1.2.2.3 混合標準工作液的配制 取空白玉米樣品,按照1.2.1項處理,得到空白玉米基質提取液,根據9種毒素在質譜中的響應值,用空白基質配制FB1、FB2、FB3、DON、15-ADON、3-ADON和ZEN質量濃度為6.25、31.25、62.5、125、250 μg/L,AFTB1質量濃度為0.5、2.5、5、10、20 μg/L,AFTB2質量濃度為0.25、1.25、2.5、5、10 μg/L的混合標準工作溶液,現用現配。
1.2.2.4 標準曲線繪制 采用空白玉米樣品提取溶液分別配制成系列基質對照品溶液。其中FB1、FB2、FB3、DON、15-ADON、3-ADON和ZEN濃度為6.25~250 μg/L,AFTB1濃度為0.5~20 μg/L,AFTB2濃度為0.25~10 μg/L,以毒素濃度(X)為橫坐標,峰面積(Y)為縱坐標,擬合標準曲線。
1.2.3 儀器條件
1.2.3.1 色譜條件 色譜柱:C18(2.1 mm × 100 mm,1.7 μm;);柱溫:40 ℃;流速:0.3 mL/min;進樣量:3 μL;流動相:A-0.1%甲酸+5 mmol/L甲酸銨水溶液,B-甲醇;梯度洗脫模式見表1。
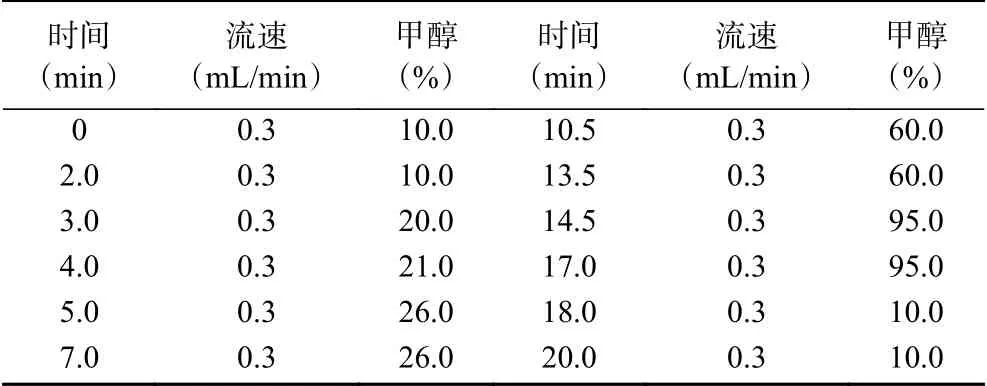
表1 梯度洗脫程序Table 1 Gradient elution procedures
1.2.3.2 質譜條件 離子源為ESI源;掃描方式:Scheduled MRMTM采集模式,正負離子同時掃描;離子化電壓:正模式5500 V,負模式-4500 V;氣簾氣30 Psi;霧化溫度:550 ℃;霧化氣:55 Psi;輔助氣:55 Psi。
1.3 數據處理
采用Analyst Softwaer軟件進行采集數據;用MultiQuant 3.0.2軟件進行處理,本文所用數據平行及重復次數、數據表示形式、統計學分析方法、顯著性水平均采用Excel辦公軟件;繪圖軟件采用Orign8.0軟件處理。
2 結果與分析
2.1 儀器條件優化
2.1.1 質譜條件優化 將9種真菌毒素單標溶液,分別通過針泵直接注射進入質譜中,測定其正負模式下質譜信號強度,確定各個毒素的母離子質量數。通過優化可知,AFTB1、AFTB2、FB1、FB2、FB3、DON、3-ADON和15-ADON在正模式下[M+H]+靈敏度最高,而ZEN在正模式下[M-H]-離子響應值大。確定母離子后,對母離子進行全掃描分析二級質譜圖,確定其子離子,最后對碰撞能量(CE)和去簇電壓(DP)優化,確定9種真菌毒素質譜條件如表2。
在一次進樣過程中,為了監測更多的離子對,采用Scheduled MRMTM采集模式,預設保留時間,在短時間窗口內采集單個離子對,使每個分析物的占空比大大增加,結合快速級性轉換,實現了一次進樣,正負模式同時采集,縮短了樣品的分析時間。
2.1.2 色譜條件優化 選擇C18色譜柱為分離柱;通過對比等度洗脫和梯度洗脫模式,最終優化出在梯度洗脫模式下,使色譜峰分離效果好;并分別使用甲醇和乙腈分離這9種真菌毒素,結果顯示,在甲醇溶液中加入0.1%甲酸和5 mmol/L甲酸銨,有利于被分析組分離子化;3-ADON和15-ADON在色譜中保留時間相同,但質譜條件不同,不影響定性定量分析,而FB2和FB3在質譜中的母離子和子離子相同,在色譜中卻得到很好分離,因而也不影響定性定量分析(圖1)。
2.2 方法學考察
2.2.1 方法的線性范圍、檢出限及定量限 以毒素質量濃度(X)為橫坐標,峰面積(Y)為縱坐標,擬合標準曲線,列于表3。9種真菌毒素在相對應的線性范圍內,線性關系良好,相關系數均大于0.9999。
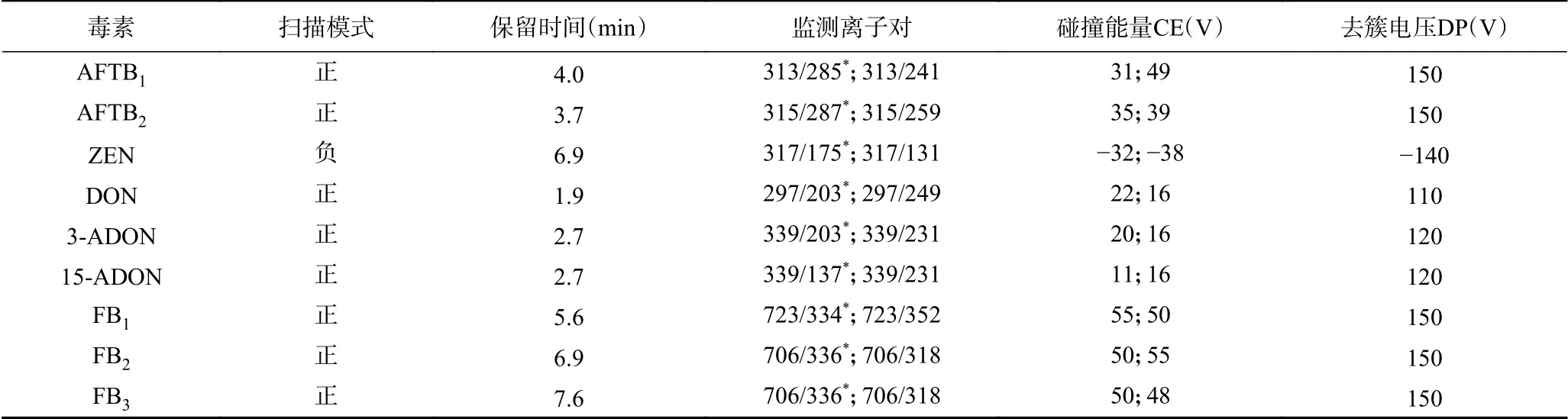
表2 質譜條件Table 2 Mass spectrum conditions
當信噪比S/N=3時確定檢出限(LOD),信噪比S/N=10時確定定量限(LOQ),ZEN檢出限為0.73 μg/kg,定量限為2.4 μg/kg;AFTB2和AFTB1的檢出限分別為0.079、0.14 μg/kg,定量限為0.26和0.48 μg/kg;FB1、FB2、FB3的檢出限依次為1.3、0.26、1.8 μg/kg,定量限為4.3、0.86、6.0 μg/kg;DON、3-ADON和15-ADON的檢出限為1.4、1.1、1.1 μg/kg,定量限為4.6、3.8、3.8 μg/kg,結果見表3。

圖1 9種真菌毒素離子流圖Fig.1 Ion flow diagram of 9 fungal toxins

表3 方法的線性范圍、檢出限及定量限Table 3 Linear range, detection limit and quantitative limit of the method
2.2.2 方法的準確度及精密度 取空白玉米基質,加入不同濃度的混合標準工作溶液,平行測定6次,計算平均回收率和相對標準偏差,結果見表4。9種真菌毒素平均回收率在80.2%~113.8%之間,RSD在0.2%~7.7%之間,表明該方法準確度和精密度均較好,達到歐盟法規要求[21]。
2.2.3 基質效應 分別測定空白玉米基質提取液配制的混合標準工作液和50%甲醇水溶液配制的混合標準工作液,計算峰面積比可得到9種真菌毒素的基質效應值。計算公式如下:
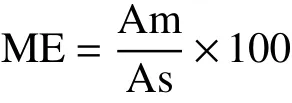
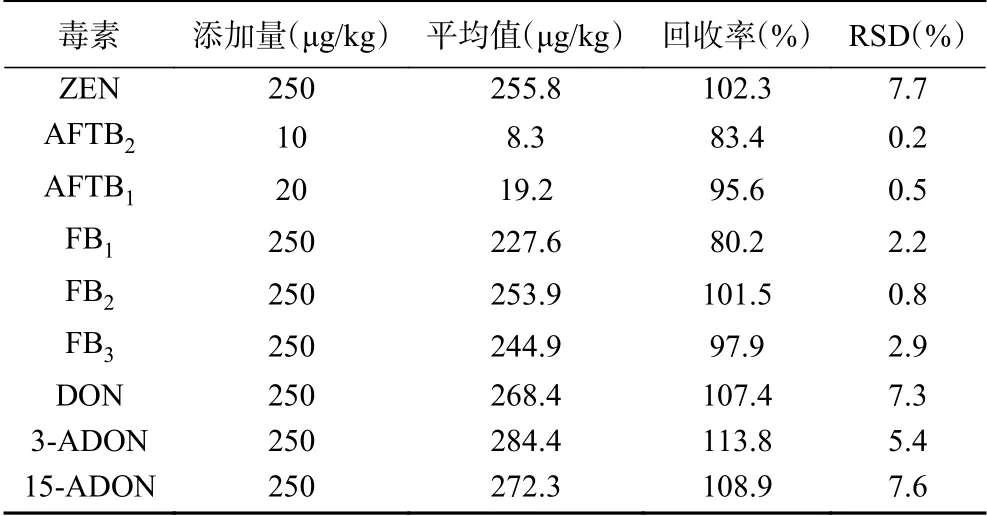
表4 9種真菌毒素平均回收率和精密度(n = 6)Table 4 Average recovery and precision of 9 mycotoxins (n = 6)
式中:ME:基質效應(%);Am:空白基質配制的混合標準溶液色譜峰面積;As:50%甲醇水溶液配制的混合標準溶液色譜峰面積。
當ME=100%時,沒有基質效應;當ME<100%時,為基質抑制效應;ME>100%時,為基質增強效應。實際檢測過程中,很難存在ME=100%的理想狀態,ME在85%~115%之間時,即認定為基質效應不明顯。
圖2給出的是9種真菌毒素基質效應結果。由圖2可知,9種真菌毒素均具有基質效應,其中FB1、FB2、FB3和15-ADON基質效應分別為110.05%、106.96%、107.67%和89.29%均在85%~115%之間,表明基質效應不明顯;DON基質效應為125.57%,只有DON為基質增強效應,而ZEN、AFTB1、AFTB2、3-ADON基質效應分別為63.87%、71.34%、56.68%和83.85%,基質效應均小于85%,表現基質抑制效應,AFTB2的抑制效應最強。在實際檢測過程中,應選用空白玉米基質提取液配制標準溶液,外標法定量來降低基質抑制效應的影響。
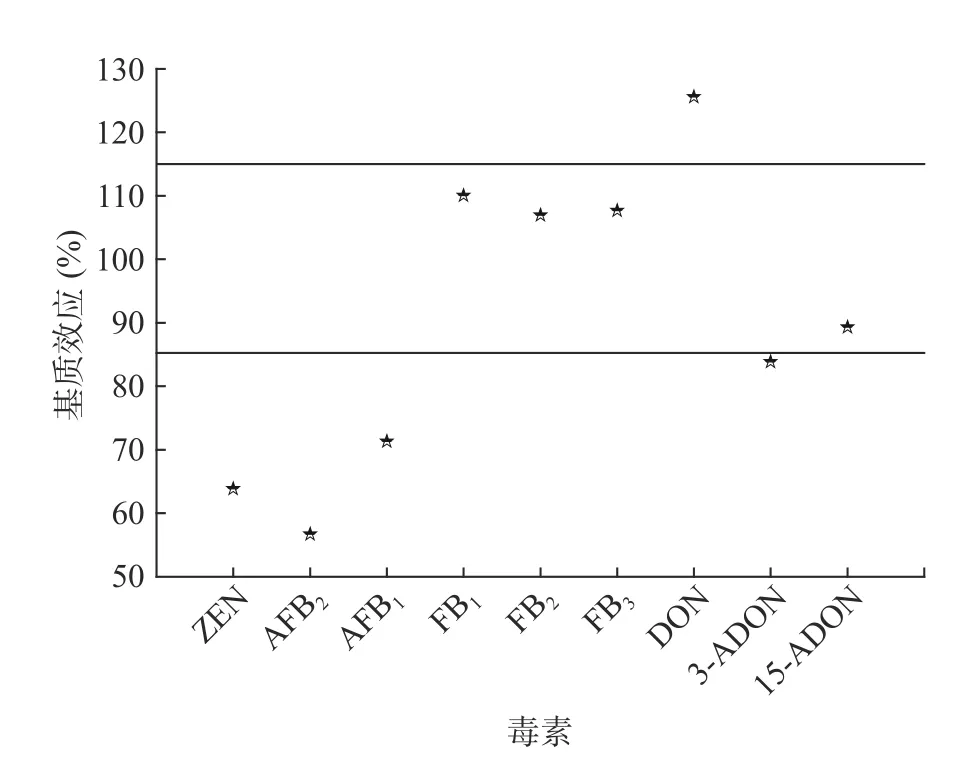
圖2 9種真菌毒素基質效應散點圖Fig.2 Scatter plots of matrix effects of 9 mycotoxins
2.2.4 與國標儀器方法對比 取空白玉米基質溶液,按25 μg/kg加標,制成陽性樣品,分別按照GB 5009.240-2016《食品中伏馬毒素的測定》[22]、GB 5009.22-2016《食品中黃曲霉毒素B族和G族的測定》[23]、GB 5009.209-2016《食品中玉米赤霉烯酮的測定》[24]、GB 5009.111-2016《食品中脫氧雪腐鐮刀菌烯醇及其乙酰化衍生物的測定》[25]中的液相色譜-串聯質譜法和本法進行測定,平行測定6次。結果見表5。比較發現,本方法與國標方法檢測結果沒有顯著性差異(P>0.05),表明本方法既準確可靠,切實可行,又操作更簡單、用時更短、效率更高(同時檢測9種成分)。
2.2.5 樣品檢測 應用本法對吉林省產240份玉米樣品進行檢測,結果發現,240份樣品中,AFTB1和AFTB2未有檢出,但不同程度檢出ZEN、DON、3-ADON、15-ADON、FB1、FB2和FB3,其中ZEN檢出率為14.6%,含量為9.9~13530.5 μg/kg;DON檢出率為52.9%,含量為9.5~1806.3 μg/kg;3-ADON檢出率為30.4%,含量為10.1~205.6 μg/kg;15-ADON檢出率為45.1%,含量為11.0~1472.2 μg/kg;伏馬毒素檢出率最高,FB1檢出率達到96.7%,含量為14.5~23270.1 μg/kg;FB2檢出率為98.3%,含量為29.8~5877.1 μg/kg;FB3檢出率為85.8%,含量為17.3~3365.5 μg/kg;具體結果見表6。而且一個樣品中同時檢出幾種毒素現象較多,表7給出樣品中同時檢測出5種毒素情況,表明吉林省玉米存在真菌毒素混合污染問題。
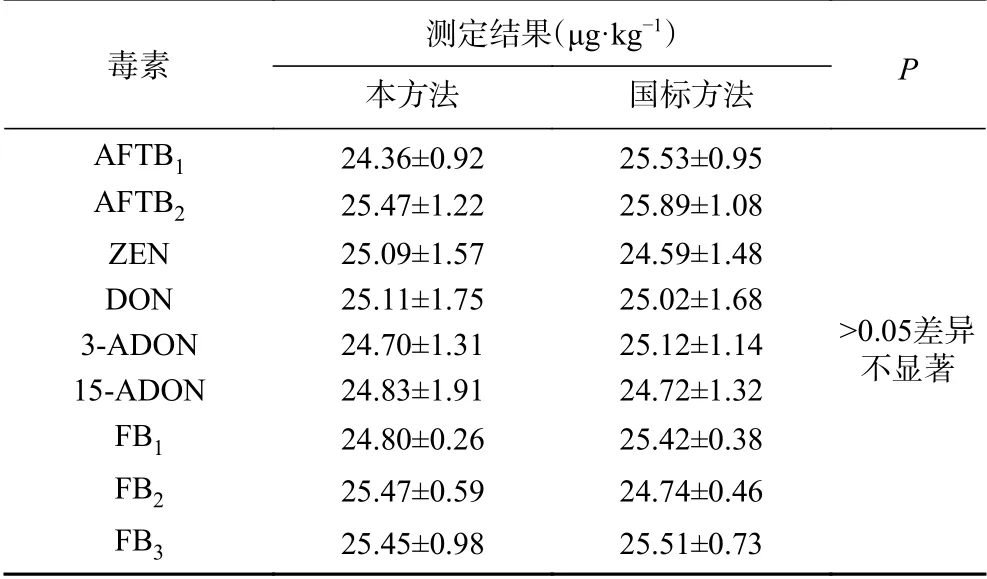
表5 本方法與國標方法對比結果(n = 6)Table 5 Comparison results between this method and GB method (n = 6)
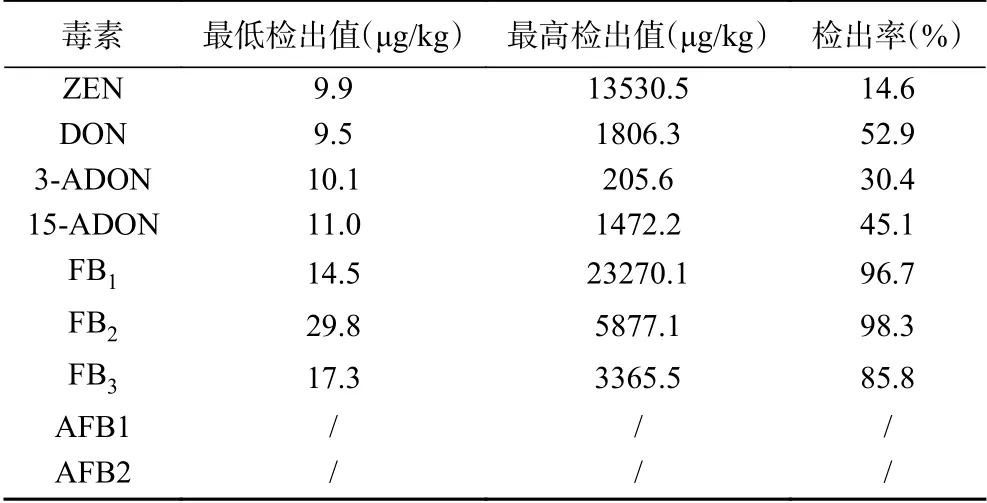
表6 240份玉米樣品中各毒素含量的最大值、最小值及檢出率Table 6 Maximum and minimum values and detection rates of each toxin content in 240 maize samples
3 結論
采用QuEChERS技術建立UPLC-MS/MS同時測定玉米中9種真菌毒素的方法,優化了質譜色譜條件,并通過優化提取步驟及凈化方法等條件有效減少玉米樣品的基質干擾。在0.25~250 μg/L濃度范圍內9種真菌毒素相關系數均在0.9999以上,檢出限在0.079~1.8 μg/kg之間,定量限在0.26~6.0 μg/kg之間,回收率在80.2%~113.8%之間,相對標準偏差≤7.7%,駐留時間10 min內,9種真菌毒素得到很好分離,該方法操作簡單、精密度好、靈敏度高、分析速度快,適用于玉米中9種真菌毒素同時檢測,可為農產品中多組分真菌毒素污染風險評估提供參考依據。將優化后方法對240份玉米樣品進行檢測,結果表明,該批樣品中AFTB1和AFTB2未有檢出,但不同程度檢出ZEN、DON、3-ADON、15-ADON、FB1、FB2。其中FB2檢出率最高,達到98.3%。表明吉林省玉米存在真菌毒素混合污染問題。

表7 同時檢測出5種毒素的玉米樣品Table 7 Maize samples with 5 toxins detected simultaneously

