腹腔鏡直腸癌根治術對患者炎癥反應、免疫功能及并發癥的影響
蔡楚東,周俊懌,柯斌杰
(1.汕頭市中心醫院普外二科,廣東 汕頭 515031;2.南澳縣人民醫院普外科,廣東 汕頭 515900)
直腸癌屬于全球范圍內常見的惡性消化道腫瘤,隨著社會發展、人們生活水平及飲食結構的改變,直腸癌發病率逐年上升,嚴重危及生命安全[1-2]。現階段直腸癌根治術是臨床治療直腸癌的主要手段,如傳統開腹術、腹腔鏡手術,其中傳統開腹術清灶徹底,且術式簡易方便,但由于手術創傷大、術后并發癥多,易引發術后炎癥反應和免疫機制損傷,不利于患者術后恢復[3]。近年來,腹腔鏡直腸癌根治術已廣泛應用于臨床實踐中[4],具有創傷小、術后并發癥較少等優勢。然而,關于其減輕炎癥、調節免疫及胃腸道功能的影響尚未見相關報道。本研究擬分析腹腔鏡直腸癌根治術對患者炎癥反應、免疫功能及并發癥的影響,旨在為臨床深入開展并推廣腹腔鏡直腸癌根治術提供一定的參考。
1 資料與方法
1.1 一般資料
回顧性分析2017年7月1日至2019年12月30日在汕頭市中心醫院實施直腸癌根治術的110例患者臨床資料。55例采用腹腔鏡直腸癌根治術 (腹腔鏡組),55例接受開腹直腸癌根治術(開腹組)。開腹組中,男性33例,女性22例;年齡39~73歲,平均(45.62±7.20)歲;腫瘤淋巴結轉移(tumor lymph node metastasis,TNM)分期:Ⅰ期17例,Ⅱ期27例,Ⅲ期11例;腫瘤直徑1.6~7.2 cm,平均腫瘤直徑(4.15±1.20)cm;病理分化程度:低中分化46例,高分化9例。腹腔鏡組中,男性35例,女性20例;年齡43~76歲,平均(45.83±9.15)歲;腫瘤TNM分期:Ⅰ期19例,Ⅱ期24例,Ⅲ期12例;腫瘤直徑1.6~7.2 cm,平均腫瘤直徑(4.15±1.20)cm;病理分化程度:低中分化48例,高分化7例。兩組患者的性別、年齡、腫瘤臨床分期、腫瘤直徑及腫瘤分化程度比較,差異無統計學意義(P>0.05)。研究通過醫院倫理委員會審批。納入標準:術前經電子腸鏡及病理檢查確診為直腸癌,并符合直腸癌診斷標準[5];符合試驗手術治療指征[5]:(1)全身狀態及臟器功能能夠耐受手術;(2)腫瘤局限于腸壁,能夠整塊切除,且區域淋巴結可徹底清掃;(3)存在遠處轉移,可徹底切除;(4)臨床資料完整;(5)全部患者于術前1個月內未接受過影響機體炎癥及免疫功能的相關治療手段;(6)術前無放療、化療或內分泌治療;(7)知情同意。排除標準:(1)出現遠處轉移及侵犯周圍器官;(2)存在嚴重腸粘連;(3)合并其他惡性疾病;(4)自身免疫疾病;(5)依從性較低者;(6)凝血功能異常或急性腸梗阻。
1.2 治療方法
兩組患者術前均予以常規胃腸道準備,手術過程嚴格遵循腫瘤根治的原則實施,行氣管插管全麻。開腹組實施開腹術:取截石位,于腹部正中繞臍位置做切口,逐層開腹,對腹腔進行常規探查,觀察腫瘤情況,將直腸游離出,切除病變腸段,端端吻合或端側吻合。沖洗腹盆腔手術區,將引流管放置后逐層關腹。腹腔鏡組行腹腔鏡直腸癌根治術:取截石位,在患者臍下緣1 cm位置做手術切口,之后插入Trocar管作觀察孔,建人工氣腹(壓力13 mmHg),在兩髂前上棘連線和右鎖骨中線交叉位置插入Trocar管作主操作孔,在兩鎖骨中線和肚臍水平位置插入Trocar 管作輔助操作孔。在腹腔鏡的引導下,探查腫瘤情況,對患者腸段及腸系膜下血管進行游離,徹底清除周圍淋巴結,實施端端吻合或端側吻合,沖洗腹盆腔手術區,將引流管放置后逐層關腹。
1.3 觀察指標
(1)兩組患者手術時間、術中出血量、術后排氣時間、住院天數、腸鳴音恢復時間、肛門排氣時間等手術情況;(2)兩組患者手術前后腫瘤壞死因子-α( tumor necrosis factor-α,TNF-α)、白介素6(interleukin-6,IL-6)、T淋巴細胞亞群(CD4+、CD8+、CD4+/CD8+)的水平;(3)統計患者術后腹痛腹脹、腸梗阻、吻合口瘺、感染等并發癥。
1.4 實驗方法
采集患者術前、術后靜脈血6 mL,以3 000 rpm轉速離心,收集上清液,通過酶標儀(賽默飛世爾科技有限公司,型號Varioskan LUX)參照酶聯免疫吸附法(試劑盒購自上海谷研生物科技有限公司,貨號48T/96T)檢測TNF-α、IL-6的水平;免疫比濁法(試劑盒購自南京建成生物工程研究所有限公司,貨號E023-1-1)檢測C反應蛋白(C-reactive protein,CRP)水平;通過流式細胞儀(儀器購自賽雷納醫療科技有限公司,型號Celula)檢測血清中T淋巴細胞亞群(CD4+、CD8+、CD4+/CD8+)水平。
1.5 統計學分析
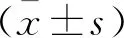
2 結果
2.1 兩組手術情況的比較
腹腔鏡組手術時間長于開腹組,其術中出血量、住院天數、腸鳴音恢復時間及肛門排氣時間也較開腹組顯著縮短(P<0.05)。見表1。
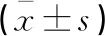
表1 兩組手術情況的比較
2.2 兩組炎癥因子的比較
術前,兩組TNF-α、IL-6、CRP水平比較,差異無統計學意義(t=0.241、0.075、0.158,P>0.05);術后,兩組TNF-α、IL-6、CRP水平均高于術前(t開腹組=12.777、16.959、12.561,P<0.05;t腹腔鏡組=7.673、9.661、4.876,P<0.05),且腹腔鏡組TNF-α、IL-6、CRP水平低于開腹組(P<0.05)。見表2。
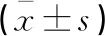
表2 兩組炎癥因子的比較
2.3 兩組T淋巴細胞亞群的比較
術前,兩組CD4+、CD8+、CD4+/CD8+比較,差異無統計學意義(t=0.267、0.613、0.105,P>0.05);術后,兩組CD4+、CD4+/CD8+均低于術前,CD8+高于術前(t開腹組=4.336、4.127、5.527,P<0.05;t腹腔鏡組=2.036、2.344、2.763,P<0.05);且腹腔鏡組CD4+、CD4+/CD8+高于開腹組,CD8+低于開腹組(P<0.05)。見表3。
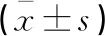
表3 兩組T淋巴細胞亞群的比較
2.4 兩組并發癥的比較
術后,腹腔鏡組吻合口瘺2例,并發癥總發生率為3.64%;開腹組術后腹痛腹脹3例、腸梗阻3例、吻合口瘺5例、感染2例,并發癥總發生率為23.64%,差異有統計學意義(P<0.05)。見表4。

表4 兩組術后并發癥發生情況[n(%)]
3 討論
直腸癌在臨床腫瘤科較為常見,發病率及致死率均較高,且早期癥狀易被忽略,若耽誤其最佳治療時間,隨著腫瘤的發生發展,患者可表現為腹痛、腹瀉、便血等癥狀,晚期可累及全身,嚴重威脅生命健康[6]。傳統開腹術的創傷、術后引起的炎癥反應及免疫損傷均可影響預后[7-8]。隨著微創術的不斷發展,腹腔鏡直腸癌根治術的微創性、療效已被證實,并于臨床廣泛應用[9]。腹腔鏡直腸癌根治術能否較開腹手術減輕炎癥反應、減少對機體免疫損傷及胃腸道功能的影響,促進病情好轉,改善預后,仍待進一步研究。
本研究發現腹腔鏡組患者手術時間長于開腹組(P<0.05),術中出血量、住院天數、腸鳴音恢復時間及肛門排氣時間較開腹組縮短(P<0.05),提示腹腔鏡直腸癌根治術雖然手術時間長于開腹術,但其對患者機體創傷影響較小,更利于患者術后腸道功能恢復,術后恢復較快。并且其手術時間較長可能與醫師手術操作經驗及對人體解剖結構的了解程度有關,隨著醫師操作技術的不斷純熟、醫療器械的改進,手術時間有望于進一步縮短至接近或短于開腹手術時間。此外,腹腔鏡組術中出血量、腸道功能恢復時間及住院時間較開腹術短,分析原因可能是腹腔鏡手術切口小,出血量少,進而減輕手術對機體產生的創傷應激反應,促進患者恢復。這與蘇德望等[10]報道結果較為一致。
外科手術一般會對機體產生一定創傷,誘發機體炎癥應激反應,且隨著炎性應激反應的加劇,體內相關炎性因子TNF-α、IL-6、CRP水平也隨之升高,會進一步增加術后并發癥風險,對患者術后康復極為不利[11]。本研究發現,術后兩組TNF-α、IL-6、CRP水平均高于術前(P<0.05),且腹腔鏡組TNF-α、IL-6、CRP水平低于開腹組(P<0.05),提示腹腔鏡胃癌根治術對機體炎癥應激反應的影響較小,這可能是由于腹腔鏡手術對機體產生的創傷較小,引起炎性應激反應不如開腹手術劇烈,與Liu等[12]報道較為一致。
免疫抑制常引發外科感染,其機制主要為免疫抑制后,機體難以清除切口處外源致病菌,以及難以抑制因腸粘膜屏障功能異常造成的腸道細菌轉移等[13-14]。細胞免疫在機體中發揮抗腫瘤、抗感染的作用,其中T淋巴細胞亞群是反應機體細胞免疫功能的重要指標,主要分為CD4+T細胞及CD8+T細胞[15]。術后感染風險增加、腫瘤惡化主要在于機體手術創傷后出現不同程度的免疫抑制現象,表現為CD4+T細胞降低、CD8+T細胞增加及CD4+/CD8+細胞比例失調,與創傷程度及預后密切相關[16]。本研究發現,術后兩組CD4+、CD4+/CD8+均低于術前(P<0.05),CD8+高于術前,且腹腔鏡組CD4+、CD4+/CD8+高于開腹組,CD8+低于開腹組(P<0.05),提示腹腔鏡手術對直腸癌患者的免疫抑制作用較小,有助于患者術后的恢復。分析原因可能與腹腔鏡手術創傷小,對機體產生的應激反應影響小有關,與趙曉智等[17]研究報道一致。
直腸癌術后出現的暫時性腸麻痹會引發類似急性腸梗阻的病理反應,使消化道的分泌物于胃腸腔內大量堆積,進一步刺激胃腸黏膜,造成胃腸腔內壓升高,吻合口張力升高,影響胃腸道功能的恢復,甚至可能提高吻合口瘺的發生風險[18]。同時由于根治術的創傷應激,激活機體炎癥反應,釋放大量炎癥因子而損傷腸屏障功能,加之削弱患者的免疫功能,進一步增加機體感染風險[19]。本研究術后并發癥結果發現腹腔鏡組并發癥發生率顯著低于開腹組(P<0.05),提示腹腔鏡手術較開腹術可降低患者術后并發癥發生風險。這可能是由于:(1)腹腔鏡手術可在直視下進行手術操作,有效保護盆腔周圍神經,減輕對盆腔臟器的干擾,避免對腸管機械牽拉,進而降低術后腸梗阻、腹痛的發生;(2)腹腔鏡下視野更加清晰,有助于醫師識別異常血管,手術創傷小,減輕炎癥應激及免疫抑制,降低患者感染風險,與王征新[20]報道結果一致。
綜上所述,腹腔鏡直腸癌根治術對患者機體炎癥反應及免疫功能影響較小,具有微創、促進患者腸道功能恢復及降低并發癥風險的優勢。然而本研究仍存一定不足之處,如受試者數量較少,后續試驗研究可進一步增加受試樣本量,明確腹腔鏡直腸癌根治術對患者機體的影響。

