環(huán)境脅迫調(diào)控植物乳桿菌細菌素合成的研究進展
趙 樂,趙鵬昊,孟祥晨
(東北農(nóng)業(yè)大學,乳品科學教育部重點實驗室,黑龍江哈爾濱 150030)
植物乳桿菌(Lactobacillus plantarum)是食品發(fā)酵技術中使用最為廣泛的乳桿菌之一,已被證實有能力在人類和其他哺乳動物的腸道中定植[1],并具有良好的代謝和耐酸能力[2]。植物乳桿菌具有調(diào)節(jié)人體免疫[3]、抵制胃腸道致病菌感染的功效[4],同時其對腸上皮細胞具有較好的黏附能力,在強酸和高濃度膽鹽下仍具有較高存活率[5],且其代謝過程中會產(chǎn)生細菌素等無毒副作用和耐藥性的次級代謝產(chǎn)物[6]。細菌素是由核糖體合成并分泌至胞外介質(zhì)的具備生物活性的多肽,當其達到一定濃度時可抑制親緣關系相近的致病菌或腐敗菌的生長[7],它們對熱穩(wěn)定且易被蛋白酶水解,因此細菌素作為生物防腐劑廣泛應用于各種發(fā)酵食品[8]。
植物乳桿菌可以在食品基質(zhì)中的熱、冷、酸、鹽等應激條件下存活,這表明它對于復雜惡劣環(huán)境已經(jīng)形成了耐受性和抗性機制。國內(nèi)外學者對植物乳桿菌在環(huán)境脅迫下的應激機制主要從分子機制和蛋白質(zhì)組學角度進行研究,盡管一些應激基因已經(jīng)在這個物種中被鑒定出來[9],但是對其轉(zhuǎn)錄調(diào)控機制仍然知之甚少。有研究表明環(huán)境脅迫可以正向調(diào)控細菌素的合成,Leroy 等[10]研究了不同環(huán)境脅迫對Enterococcus faeciumRZSC5 產(chǎn)生細菌素的調(diào)控作用,研究發(fā)現(xiàn)中等鹽濃度能夠促進細菌素的分泌。Hurtado 等[11]研究了Lactobacillus pentosusB96 在鹽脅迫下細菌素編碼基因表達的變化,研究表明4%和6%濃度的鹽脅迫可以促進細菌素的生物合成,plnE和plnN基因的表達受脅迫影響顯著上調(diào),但其并未深入研究鹽脅迫如何調(diào)控細菌素的合成。乳酸菌細菌素雖然具備無毒、高效抑菌等優(yōu)點,但產(chǎn)量較低,在工業(yè)化批量生產(chǎn)中大大受限。
目前利用基因工程技術提高細菌素產(chǎn)量雖理論上可行,但普遍存在細菌素活性較低及安全問題。而環(huán)境脅迫對細菌素的調(diào)控是基于轉(zhuǎn)錄水平上的調(diào)節(jié),并不涉及安全性問題。由于環(huán)境脅迫調(diào)控細菌素合成的機制較為復雜,調(diào)控因子及調(diào)控通路尚不明確,通過施加環(huán)境壓力提升菌體細菌素合成量的方法依然難以投入到實際應用中。因此完善關于環(huán)境脅迫對細菌素合成的分子調(diào)控機制的研究,對促進生物保護發(fā)酵劑的發(fā)展有著重要意義。
1 植物乳桿菌細菌素合成的分子調(diào)控機制
1.1 Al-2 介導的群體感應系統(tǒng)
群體感應(quorum sensing,QS)是指細菌感應外界環(huán)境刺激,分泌自誘導物或自誘導多肽作為信號分子,當其濃度達到一定閾值時會啟動菌體某些功能性基因的表達進而影響菌體生命活動,如調(diào)控細菌素的合成及分泌[12]。Saucier 等[13]在Carnobacterium piscicolaLV17 中首次發(fā)現(xiàn)乳酸菌存在群體感應現(xiàn)象。少數(shù)Ⅰ類和多數(shù)Ⅱ類細菌素的生物合成受QS 系統(tǒng)調(diào)控。調(diào)節(jié)Ⅱ類細菌素產(chǎn)生的QS 系統(tǒng)由自誘導肽(auto-inducing peptide,AIP)、監(jiān)測環(huán)境的膜定位組氨酸蛋白激酶(histidine protein kinase,HPK)以及細胞質(zhì)感應調(diào)節(jié)蛋白(response regulator,RR)等3 種調(diào)控蛋白組成,被稱為三組分系統(tǒng),其中HPK和RR 也被稱為雙組份系統(tǒng)(two component system,TCS)[14]。Al-2 以具備生物活性的信號分子身份參與QS 信息交流進程,從分子結構層面來看,Al-2 是一種呋喃酰硼酸二酯類化合物[15]。它由luxS基因編碼的關鍵酶催化S-核糖高半胱氨酸(SRH)生成,其中SRH 是通過pfs基因編碼合成酶催化S-腺苷高半胱氨酸(SAH)而形成的。植物乳桿菌與其他誘導菌共培養(yǎng)時細菌素也會被誘導進而殺死或抑制其它微生物。Di 等[16]研究發(fā)現(xiàn)共培養(yǎng)后L.plantarumDC400 細菌素的合成量顯著上升,luxS基因表達量也較純培養(yǎng)顯著提升,由此推斷l(xiāng)uxS介導的群體感應系統(tǒng)間接調(diào)控植物乳桿菌細菌素的合成。Man等[17]研究發(fā)現(xiàn)L.plantarumKLDS1.0391 與瑞士乳桿菌KLDS1.9207 共培養(yǎng)時,編碼細菌素的pln基因簇相關基因的表達顯著上調(diào)。與此同時,Ruiz-Barba等[18]研究發(fā)現(xiàn),L.plantarumNC8 與戊糖片球菌FBB63 等革蘭氏陽性菌共培養(yǎng)時,L.plantarumNC8 細菌素調(diào)節(jié)基因轉(zhuǎn)錄效率有所上升。綜上表明,細菌素產(chǎn)量的提高可能是微生物的存在刺激生產(chǎn)者生長的結果,也可能是自誘導物Al-2 產(chǎn)量增加的結果。
1.2 植物乳桿菌pln 基因簇
植物乳桿菌細菌素調(diào)控系統(tǒng)除上述提到的Al-2 介導的群體感應系統(tǒng)以外,還受基因組中pln基因簇的調(diào)控。Saenz 等[19]證實了L.plantarumC11、WCFS1、J51、YM-4-3 中均含有5 個誘導操縱子:分別是plnABCD、plnJKLR、plnEFI、plnGHSTUVW、plnMNOP。各誘導操縱子的具體功能如下:負責編碼群體感應系統(tǒng)并可啟動其他操縱子轉(zhuǎn)錄起始的調(diào)節(jié)操縱子plnABCD,其中plnA編碼自誘導肽(AIP),plnB編碼可跨膜的組氨酸激酶(HPK),plnC和plnD編碼兩種功能相反的反應調(diào)節(jié)因子[20],plnC編碼的蛋白激活基因簇轉(zhuǎn)錄,plnD編碼的蛋白則起抑制作用;編碼細菌素結構基因的plnJKLR和plnEFI,其中PlnI 及PlnL 為abi基因編碼免疫蛋白;編碼ABC 轉(zhuǎn)運系統(tǒng)并參與細菌素分泌運輸?shù)倪\輸操縱子plnGHSTUVW;plnMNOP等功能還未可知。Diep等[21]認為plnEFI和plnJKLR操縱子編碼雙肽細菌素、PlnEF 和PlnJK 及其相應的免疫蛋白。plnGHSTUVWXY操縱子編碼ABC 轉(zhuǎn)運系統(tǒng)的蛋白質(zhì),該系統(tǒng)負責分泌并處理細菌素前體。2003 年,Diep 等[22]進一步驗證了PlnA 肽誘導上述五個操縱子的轉(zhuǎn)錄的同時,自身也是一種抑菌物質(zhì)。Maldonado-Barragan 等[23]通過基因敲除實驗驗證了L.plantarumWCFS1 中的plnABCD以及L.plantarumNC8 中的plnNC8IF-HK-D對細菌素的合成至關重要。Tai 等[24]對L.plantarumWCFS1、C11、V90、J23、J51、NC8、JDM1、UL4 的pln基因簇進行了總結(圖1)。
2 植物乳桿菌抵御脅迫的反應機制
2.1 植物乳桿菌面臨的環(huán)境脅迫
利用植物乳桿菌產(chǎn)細菌素的特性提高食品安全性是食品防腐保鮮的一種手段,但無論是在加工運輸中還是攝入體內(nèi)發(fā)揮其益生效應均會面臨諸多脅迫(圖2)。在菌體生長、存儲保藏、經(jīng)過人體腸胃道等過程中,菌體自身會受酸、冷凍、高溫、鹽、饑餓等脅迫作用而損傷甚至死亡。例如人體胃腸道的低pH 環(huán)境或食品加工基質(zhì)中遇到的酸脅迫,會導致胞內(nèi)質(zhì)子積累同時降低跨膜推動力,進而降低對酸敏感的酶活性,也會損害蛋白質(zhì)和DNA 等生物大分子;作為發(fā)酵劑在加工貯存中遇到的低溫環(huán)境不僅會減弱細胞膜流動性,還會影響基因表達使菌體產(chǎn)生冷休克反應,相反,環(huán)境溫度過高又會致使蛋白降解;細菌代謝過程產(chǎn)生的活性氧(ROS)、超氧陰離子(O2-)、過氧化氫(H2O2)以及過氧化自由基(O·)等物質(zhì)會使菌體細胞受損[25];細菌繁殖過程中,若營養(yǎng)物質(zhì)得不到及時補充,便會引發(fā)營養(yǎng)脅迫現(xiàn)象,導致代謝能力大大降低,如細菌素等代謝產(chǎn)物合成量降低。
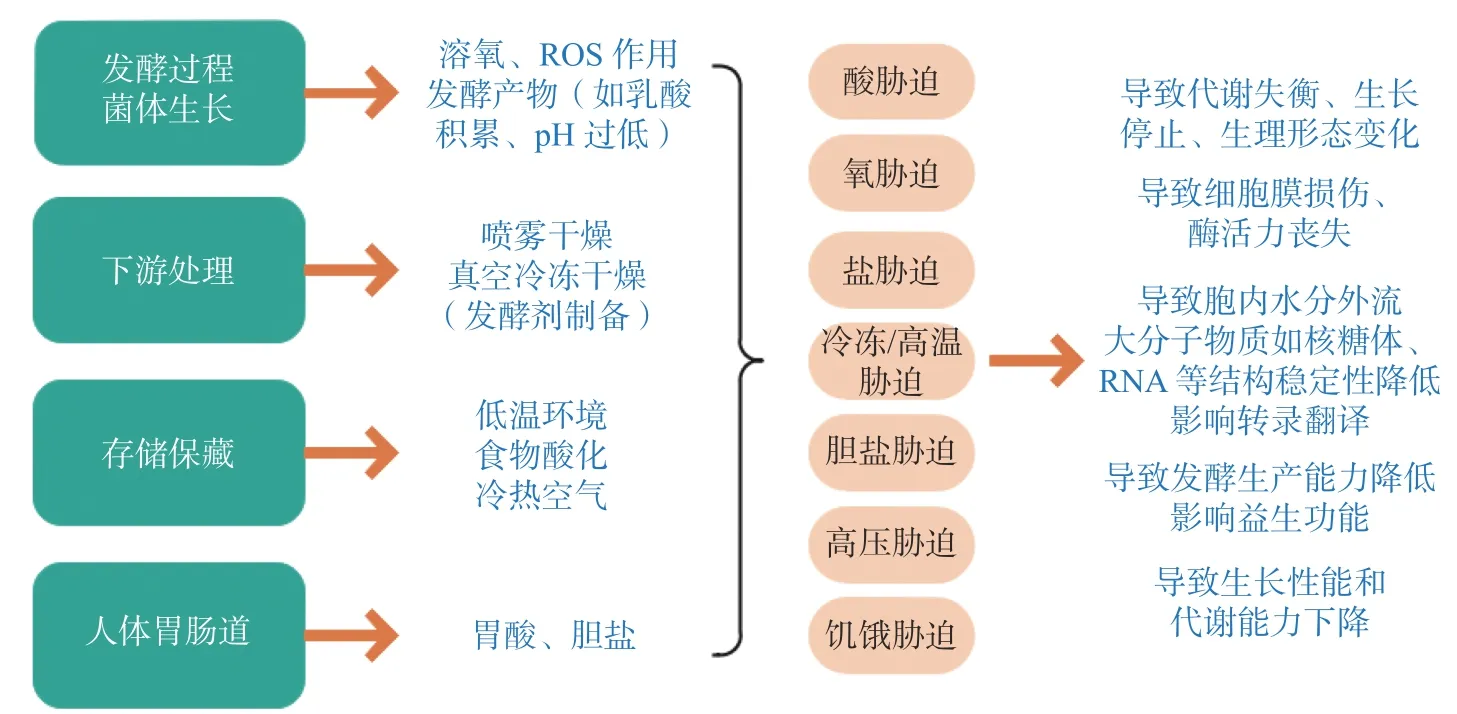
圖2 植物乳桿菌面臨的環(huán)境脅迫Fig.2 Environmental stress encountered by Lactobacillus Plantarum
2.2 植物乳桿菌抵御鹽脅迫的調(diào)控機制
植物乳桿菌抵御鹽脅迫通常依靠相容性溶質(zhì)調(diào)控系統(tǒng)、胞內(nèi)離子平衡、熱休克蛋白調(diào)控系統(tǒng)及其他途徑關鍵酶調(diào)控系統(tǒng)。在高滲透壓條件下,植物乳桿菌主要通過從細胞外部吸收甘氨酸甜菜堿(glycine betaine,GB)等相容性溶質(zhì)來抵御鹽脅迫[26]。其中L.plantarum主要采取QacT 系統(tǒng)轉(zhuǎn)運相似相容類物質(zhì)[27],有研究指出L.plantarumATCC14917 依靠QacT 系統(tǒng)轉(zhuǎn)運甜菜堿、肉堿和脯氨酸[28],而L.plantarumWCFS1 擁有兩個相容性溶質(zhì)轉(zhuǎn)運系統(tǒng),即ChoQS、OpuABCD[29]。植物乳桿菌還可以利用質(zhì)膜上的Na+/H+逆向轉(zhuǎn)運蛋白將胞內(nèi)Na+外排,進而維持胞內(nèi)離子平衡[30]。此外,有研究報道指出L.plantarumST-III 中存在編碼Na+/H+逆向轉(zhuǎn)運蛋白的基因[31]。近期還有學者發(fā)現(xiàn),L.plantarumSTIII 的質(zhì)粒上包含一個由kdpABCDE操縱子編碼的K+轉(zhuǎn)運基因簇[32]。另一方面,當菌體外部滲透壓升高時,編碼普遍應激蛋白(GSPs)、熱激蛋白(HSPs)和鹽脅迫蛋白(SSPs)的基因表達量會顯著上升。HSPs 作為分子伴侶蛋白通常包括DnaK、GroEL、DnaJ 和GroES,在蛋白折疊修復和降解中起到關鍵作用[33]。也有研究發(fā)現(xiàn),胞內(nèi)蛋白FtsH 和細胞看家蛋白HtrA 在鹽脅迫下表達上調(diào)。糖酵解途徑是植物乳桿菌生成乳酸的重要途徑,有學者指出糖酵解關鍵酶基因pfk、fba、pgk、ldh的表達也會隨 著NaCl 濃度的升高而上調(diào)。鹽脅迫也可以誘導腺苷酸琥珀酸合酶PurA 的合成,有研究發(fā)現(xiàn)參與嘌呤代謝的PurH 蛋白在5 mol/L NaCl 脅迫下表達上調(diào)。這些關鍵酶數(shù)量的增加可以使核苷酸積累用于DNA、RNA 和ATP 的合成,維持菌體正常生長代謝。
2.3 植物乳桿菌抵御酸脅迫的調(diào)控機制
植物乳桿菌可以通過調(diào)控胞內(nèi)pH 動態(tài)平衡、改變細胞膜生理功能以及分泌抗脅迫應激蛋白等方式來應對發(fā)酵過程中所產(chǎn)有機酸帶來的酸脅迫。胞內(nèi)pH 的動態(tài)平衡對于L.plantarum抵御酸脅迫至關重要,乳酸菌能夠通過H+-ATPase、谷氨酸脫氫酶體系,精氨酸脫羧酶途徑等機制維持胞內(nèi)pH 的動態(tài)平衡(圖3)[34]。當胞內(nèi)pH 處于菌體能耐受的范圍外時,F(xiàn)0F1-ATPase 聚合體會消耗胞內(nèi)ATP,將胞內(nèi)水解產(chǎn)物H+泵出至胞外,以維持胞內(nèi)pH 的穩(wěn)定。此外,菌體的精氨酸脫氨酶體系可以通過催化精氨酸產(chǎn)生NH3,隨后胞內(nèi)H+與產(chǎn)物NH3結合,從而使pH 升高至正常范圍,此過程產(chǎn)生的ATP 有助于F0F1-ATPase泵出質(zhì)子。細胞膜的結構成分在抵御酸脅迫的過程中也起到關鍵作用,如調(diào)整膜脂肪酸中的長鏈脂肪酸和單不飽和脂肪酸的比例。有研究嘗試闡明植物乳桿菌的耐酸機制,Liu 等[35]認為植物乳桿菌SA-680 包含一個耐酸基因mdt,其序列與多種植物乳桿菌膜轉(zhuǎn)運蛋白基因編碼區(qū)序列很接近,猜測基因mdt可能與質(zhì)子流動有關。
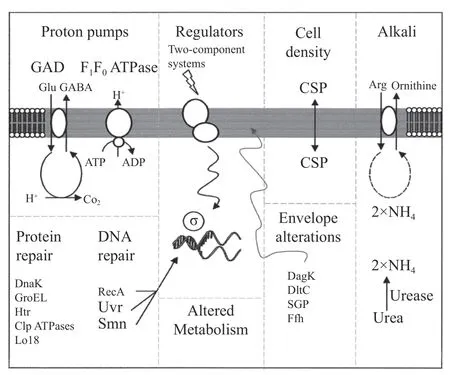
圖3 革蘭氏陽性細菌的耐酸機制[34]Fig.3 Acid resistance mechanism of gram-positive bacteria[34]
2.4 植物乳桿菌抵御冷熱脅迫的調(diào)控機制
植物乳桿菌作為冷凍發(fā)酵劑在儲存過程中、干酪成熟階段及冷藏產(chǎn)品的低溫發(fā)酵階段會引發(fā)大量的冷誘導蛋白(Cold Induced Proteins,CIP)表達。Derzelle 等[36]從受到冷脅迫的植物乳桿菌Lp80 和C3.8 中分別克隆出cspL和cspP兩種冷休克蛋白基因。此外,工業(yè)生產(chǎn)中噴霧干燥、巴斯德滅菌等高溫過程帶來的熱應激會導致DnaK、DnaJ、HrcA、GroES、GroEL、Hsp84、Hsp85、Hsp100、C1p、HtrA 和FtsH 等熱休克蛋白和蛋白酶表達上調(diào)。Castaldo 等[37]研究發(fā)現(xiàn),L.plantarumLM3-2 含有以cis 啟動的CIRCE 序列為特征的DnaK 和GroESL熱激操縱子。劉倩穎[38]通過KEGG 通路富集結果分析出L.plantarumLIP-1 在冷脅迫下嘌呤代謝通路最顯著,冷應激蛋白CspC 的表達顯著上調(diào)。
2.5 植物乳桿菌抵御氧脅迫的調(diào)控機制
植物乳桿菌的呼吸代謝產(chǎn)物活性氧(ROS),包括超氧陰離子自由基(O2-),過氧化氫(H2O2)和羥自由基(OH-)等,這類物質(zhì)會打破胞內(nèi)的氧化還原平衡進而促使ROS 濃度升高進而造成氧脅迫。乳酸菌抵御氧脅迫多依賴于SOD、CAT 和GSH-PX 等ROS解毒酶類。Eric 等[39]發(fā)現(xiàn)在L.plantarum中,兩個谷胱甘肽還原酶同源物可以有效降低由膽鹽脅迫引起的氧化損傷。與此同時,過氧化物響應調(diào)控因子PerR、氧氣響應轉(zhuǎn)錄調(diào)節(jié)子FNR 以及Rex 類轉(zhuǎn)錄因子在抵抗氧化脅迫和生物膜形成方面也有重要調(diào)控作用。另一方面,F(xiàn)lpA 和FlpB 通過上調(diào)Zn2+的攝取來增加菌體對胞內(nèi)巰基蛋白的保護從而提高菌體氧化脅迫抗性。此外,有研究為闡明L.plantarumCAUH2 的抗氧化脅迫機制,采用轉(zhuǎn)錄組學進行分析,結果表明轉(zhuǎn)錄因子GopR 具有抗氧化功能。
3 環(huán)境脅迫對植物乳桿菌細菌素合成量的影響
不同植物乳桿菌菌株由于自身的差異性,面對不同脅迫時其細菌素的合成能力存在較大差異。食品基質(zhì)中的低溫、低pH 和高NaCl 等脅迫因素會影響乳酸菌的生長和細菌素的合成。Engelhardt 等[40]研究結果指出L.plantarumESB202 與P.acidilacticiHA6111-2 在7.5% NaCl 濃度下分別培養(yǎng),二者細菌素抑菌活性均被顯著抑制。而Lim 等[41]研究發(fā)現(xiàn)適宜的NaCl 濃度(1%或3%)使L.plantarumKC21細菌素的合成量翻倍,抑菌活性升至12800 BU/mL,當NaCl 濃度大于5%時會抑制菌株的生長和細菌素的合成。Leal-Sanchez 等[42]同樣發(fā)現(xiàn)低濃度的NaCl 脅迫(2.3%~2.5%)也會促進L.plantarumLPCO10 細菌素的合成。此外,Vazquez 等[43]發(fā)現(xiàn)外源添加1.5 g/L 的半胱氨酸或色氨酸對Nisin 的合成有促進作用。Yi 等[44]以Glu、Gly、Cys、Tyr和Ala 為研究對象,其結果表明只有Cys 和Gly 對細菌素的合成有誘導作用,其余氨基酸作用不顯著。但上述氨基酸是通過影響菌體生長進而影響細菌素的產(chǎn)量,還是作為前體物質(zhì)直接參與細菌素的合成或是作為中間調(diào)控因子還有待深入研究。另一方面,Parlindungan 等[45]發(fā)現(xiàn)L.plantarumB21受到營養(yǎng)脅迫如葡萄糖脅迫時,生長速度明顯降低,且不產(chǎn)生酸,但細菌素的活性仍能被檢測。與此相反,受吐溫80 的脅迫時,盡管生長速度快、產(chǎn)酸量大,但細菌素活性不明顯。上述結果都僅為表觀研究,沒有針對內(nèi)在機制進行深入探討。
4 環(huán)境脅迫調(diào)控細菌素合成的分子機制
4.1 細胞分泌途徑中重要調(diào)控基因及蛋白
生物體面對壓力變化時通常會誘導大量基因表達并合成應激蛋白質(zhì),進而適應不良環(huán)境。也有報道指出,菌體面臨環(huán)境脅迫會激活多種代謝途徑[46]。細菌素作為一種分泌蛋白,在其運輸分泌過程中ABC 轉(zhuǎn)運蛋白作為一種載體起主要作用。同時,由于細菌素自身結構及底物信號序列的不同,其分泌轉(zhuǎn)運途徑可分為NisT 型、SunT 型、Sec 型、SRP 型途徑以及其他轉(zhuǎn)運蛋白途徑[47](圖4)。其中Sec 型分泌途徑是細菌蛋白分泌到胞外的常見方式之一,有研究報道指出,SecY、SecE 和SecG 三種調(diào)控蛋白共同構成細菌蛋白異位復合體,形成蛋白轉(zhuǎn)運通道,該分泌途徑中SecA 蛋白是分泌蛋白跨內(nèi)膜轉(zhuǎn)運的關鍵蛋白。此外,有研究表明,當菌體面臨氧化應激時,分泌調(diào)控蛋白SecA 的C 末端特異性結合一種胞質(zhì)蛋白MrgA,據(jù)報道該蛋白與氧化應激有關[48]。除此之外,SRP 型蛋白分泌途徑也較為常見,大多數(shù)膜蛋白和分泌蛋白在其靶向定位過程中都會受信號識別顆粒(signal recognition particle,SRP)的嚴格調(diào)控。目前針對乳酸菌SRP 途徑的研究主要集中在信號識別顆粒Ffh、受體FtsY 的結構與功能。Froderberg 等[49]研究發(fā)現(xiàn)蛋白轉(zhuǎn)運酶YidC 在細菌素分泌過程及Sec 易位過程中均起重要作用,信號識別顆粒Ffh 可與細菌素形成復合體,再與受體FtsY 結合并定位于細胞膜。另一方面,Neumann 等[50]認為信號識別顆粒SRP 和分泌調(diào)控蛋白SecA 在分泌蛋白跨內(nèi)膜轉(zhuǎn)運過程中起協(xié)同作用,二者可協(xié)助細菌蛋白的分泌。還有研究報道,當菌體面臨鹽脅迫時,busR基因編碼的調(diào)控子會刺激BusA 轉(zhuǎn)運蛋白的表達,進而影響細菌素的分泌[51]。綜上所述,脅迫下細菌分泌系統(tǒng)相關基因的表達上調(diào)使得蛋白共翻譯轉(zhuǎn)運速率提升,分泌蛋白的數(shù)量增加,由此推測脅迫通過影響細胞膜分泌系統(tǒng)進而影響細菌素的合成。
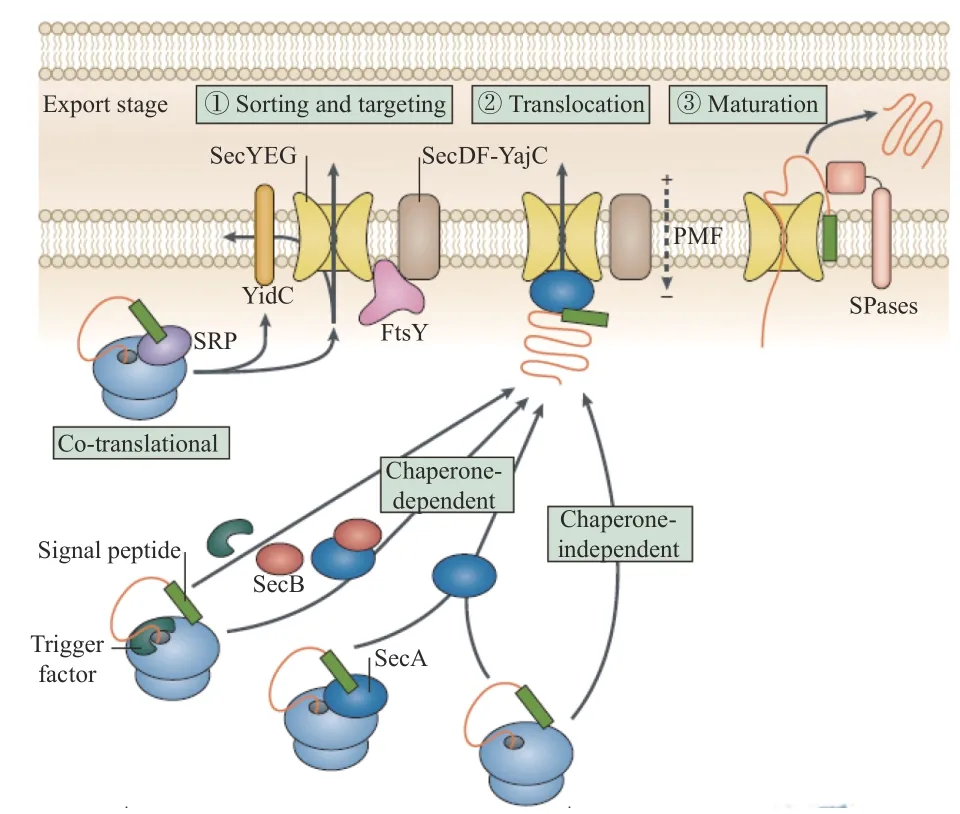
圖4 細菌蛋白質(zhì)分泌途徑[52]Fig.4 Secretion pathway of bacterial protein[52]
4.2 氨基酸代謝途徑中重要調(diào)控基因及蛋白
天冬氨酸及谷氨酸代謝途徑是合成纈氨酸、組氨酸、脯氨酸、賴氨酸以及色氨酸等多種氨基酸的有效途徑,這些氨基酸可以進一步被生物體利用合成細菌素等相關蛋白。宋雪飛等[53]的研究結果顯示基因asnA、hisA、hisC、metE在15 g/L 濃度的NaCl脅迫下表達均顯著下調(diào),其中asnA、hisA、metE分別是參與天冬氨酸代謝、組氨酸代謝和半胱氨酸代謝的關鍵基因。同時,有研究報道指出,鹽脅迫下L.plantarumWCFS1 中除了參與絲氨酸代謝途徑的基因表達下調(diào),編碼氨基酸轉(zhuǎn)運蛋白的基因表達也顯著下調(diào)。細菌素本質(zhì)也是一種多肽,其合成過程受上述氨基酸代謝的影響,這也在一定程度上解釋了脅迫下細菌素合成量發(fā)生變化的原因。
另一方面,由argG和argH基因編碼的ArgG和ArgH 蛋白在天冬氨酸轉(zhuǎn)化為精氨酸過程中起到關鍵的催化作用,張明陽[54]發(fā)現(xiàn)酸脅迫環(huán)境下過量表達上述兩種蛋白會提高氨基酸代謝基因如精氨酸代謝基因arcA、arcB和argR的轉(zhuǎn)錄效率。其中arcA、arcB、argR、argG和argH等基因編碼的蛋白能夠使精氨酸分解并產(chǎn)生氨和ATP,由此推測上述基因可間接為細菌素的合成提供原料及能量,利于菌體抵抗酸脅迫[55]。同時,有研究發(fā)現(xiàn)隨著外界滲透壓升高,編碼氨基肽酶PepX 的基因pepX表達顯著上調(diào),該基因是調(diào)節(jié)蛋白質(zhì)水解系統(tǒng)的關鍵基因,推斷其與細菌素的水解及轉(zhuǎn)運有關。
4.3 脂肪酸代謝途徑中重要調(diào)控基因及蛋白
乳酸菌面臨環(huán)境脅迫時,脂肪酸代謝途徑中的酰基載體蛋白聚合物FabZ2、FabG2、FabH 作為主導酶發(fā)揮優(yōu)勢作用,菌體生長速率加快,進而導致細菌素合成量顯著升高。相反,Heunis 等[56]發(fā)現(xiàn)酸脅迫條件下L.plantarum423 胞內(nèi)FabD 蛋白質(zhì)的表達呈下降趨勢,推斷由于脂肪酸生物合成量減少進而抑制菌體自身生長,最終細菌素合成量隨菌體生長能力減弱而降低。此外,還有研究表明基因accA、accB、accC、fabD及fabZ也參與脂肪酸生物合成途徑,其中基因accA、accB及accC負責編碼乙酰輔酶A 羧化酶,基因fabD負責編碼丙二酰輔酶A[57]。王茜茜等[58]基于iTRAQ 技術發(fā)現(xiàn)鹽脅迫會導致細胞膜合成相關基因fabG和fabZ表達上調(diào),促進支鏈脂肪酸的合成從而提高細胞膜的流動性,進而利于細菌素的翻譯和分泌。
4.4 核苷酸代謝途徑中重要調(diào)控基因及蛋白
嘌呤核苷酸不僅作為DNA 與RNA 分子合成的主要底物,同時也參與ATP 和GTP 等物質(zhì)的合成代謝,為細菌素合成及運輸供給能量。嘌呤代謝通路的上游基因purL調(diào)控肌苷一磷酸(IMP)與焦磷酸硫胺素(TPP)的生物合成,二者對于細菌素及毒力因子的合成有一定影響。此外,基因sat及編碼RNA 聚合酶的基因rpoB過表達均會導致胞內(nèi)ATP 產(chǎn)量增多,為機體的生長代謝提供了更多的能量,有助于細菌素的合成與分泌。有學者基于轉(zhuǎn)錄組測序技術發(fā)現(xiàn)鹽脅迫下L.plantarumWCFS1 中編碼嘌呤合成的基因purD、編碼腺嘌呤琥珀酸合酶的基因purA、編碼腺嘌呤脫氫酶的基因adeC、編碼單磷酸鳥苷還原酶的基因guaC的表達均顯著下調(diào),直接導致嘌呤代謝過程中關鍵酶的活性減弱,間接導致細菌素產(chǎn)量下降[59]。Sun 等[60]的研究結果與上述結果相似,差異蛋白結果顯示酸脅迫條件下菌體中基因adk與基因purA的表達也有所下調(diào)。此外,Pang 等[61]研究表明,胞內(nèi)次黃嘌呤的濃度會隨著基因purA轉(zhuǎn)錄水平的降低而增加,最終導致RNA 和DNA 合成量升高。由于細菌素作為一種分泌肽,RNA 和DNA 又作為其合成模板,因此推斷出當菌體受脅迫時GuaC、PurH、PurA 和PurB 等蛋白質(zhì)對細菌素有重要調(diào)控作用。綜上所述,脅迫可以通過影響核苷酸代謝途徑中能量的生成進而影響細菌素的合成。
4.5 其他重要調(diào)控基因及蛋白
核糖體蛋白、DNA 修復蛋白、分子伴侶以及熱休克蛋白作為全局調(diào)控蛋白,在乳酸菌脅迫響應中也發(fā)揮著重要作用。其中,分子伴侶蛋白如GroEL、GrpE、DnaK、DnaJ、Hsp、CspC 等的主要作用是協(xié)助蛋白進行組裝折疊、轉(zhuǎn)運和降解,脅迫條件下這類蛋白質(zhì)還能增加代謝相關蛋白如細菌素的穩(wěn)定性[62]。1990 年,Vanbogelen 等[63]發(fā)現(xiàn)核糖體蛋白不僅具有促進蛋白質(zhì)合成的功能,還能感受外界環(huán)境如熱、冷、酸、滲透壓等的變化并參與細菌素的翻譯。2013 年,陳衛(wèi)等[64]發(fā)現(xiàn)當乳酸菌受酸、膽鹽等環(huán)境脅迫時,熱休克蛋白、冷休克蛋白和通用應激蛋白等通常被誘導表達。還有研究顯示,大腸桿菌應對環(huán)境壓力所采用的修復系統(tǒng)由全局轉(zhuǎn)錄誘導因子RecA和轉(zhuǎn)錄抑制因子LexA 控制,自然狀態(tài)下LexA 蛋白結合在大腸桿菌素結構基因的啟動子處,因此顯著抑制細菌素合成[65]。然而當菌體受到紫外線等脅迫誘導后,RecA 受到激活,促進阻遏蛋白LexA 自身發(fā)生裂解,解除對細菌素結構基因的抑制作用,最終導致細菌素合成量增大。
5 總結與展望
由于調(diào)控細菌素合成基因的多樣性及其調(diào)控機制的復雜性,目前關于環(huán)境脅迫下植物乳桿菌細菌素合成機制的研究相對缺乏,仍有諸多問題有待解決,筆者認為主要集中在以下幾個方面:第一,環(huán)境脅迫介導哪些基因的轉(zhuǎn)錄以及蛋白質(zhì)的表達參與細菌素的合成;第二,是否存在相關調(diào)控蛋白與植物乳桿菌細菌素啟動子調(diào)控區(qū)域有結合作用;第三,目前還沒有找到通用的代謝通路用于解釋環(huán)境脅迫下植物乳桿菌的應激機制;第四,應對不同環(huán)境脅迫時,群體感應系統(tǒng)相關的基因如luxS基因的轉(zhuǎn)錄水平、信號分子AI-2 的活性及LuxS 蛋白的穩(wěn)定性如何變化還未可知。但隨著深入研究,利用轉(zhuǎn)錄組和蛋白質(zhì)組等多組學技術挖掘植物乳桿菌中重要功能基因,從轉(zhuǎn)錄水平、蛋白水平和代謝水平多層面研究不同脅迫下細菌素合成系統(tǒng)的表達差異是未來的研究方向。利用脅迫應答等外源壓力提高植物乳桿菌細菌素產(chǎn)量的方法必將成為食品領域的研究熱點,進而更好的發(fā)揮生物保護發(fā)酵劑的生防作用。

