注射用修飾透明質酸鈉凝膠熱原試驗探討
王嘉銘 曾裕 聶永勝 陸金健 楊立峰
(廣東省醫療器械質量監督檢驗所,廣州 510000)
隨著現代醫學科技的發展,注射用修飾透明質酸鈉凝膠的研究也獲得了較快的發展。透明質酸是一種天然直鏈多糖,由N-乙酰葡糖胺和葡萄糖酸雙糖單位構成的線性多糖,分子量大,具有一定粘彈性特質[1]。在GB/T16886.11-2011醫療器械生物學評價第11部分全身毒性試驗(附錄F材料介導熱原信息)中提到:對新型醫療器械沒有必要都進行體內致熱性試驗,但材料如含有引起過熱原反應的新化學成分或物質,則宜進行材料介導致熱性評價[2],透明質酸鈉類面部注射適用于中至深層真皮注射以糾正皺紋或重建軟組織,作為一種植入人體內的新型生物材料[3],為了盡可能降低產品對患者的不良反應,在熱原試驗中對其開展正確的制備方法和注射劑量的研究至關重要[4]。
1 材料與方法
1.1 一般材料
試驗樣品:注射用修飾透明質酸鈉凝膠;浸提介質:0.9%氯化鈉注射液;試驗動物:普通級新西蘭兔(廣州市白云區龍歸興科動物養殖場),未產并無孕,體重1.7kg以上。
1.2 試驗方法[5]
取適用新西蘭兔3只測定其體溫,在測定正常體溫符合要求后15min以內,自耳緣靜脈緩緩注入規定劑量并溫熱至約38℃的供試品。然后每隔30min測量1次體溫,共6次。以6次體溫中最高的一次減去正常體溫,即為該兔體溫的升高溫度(℃)。
1.3 結果評價
3只兔溫度升高均低于0.6℃(或3只兔體溫升高的總和低于1.3℃),判定該樣品浸提液的熱原檢查符合規定。
2 不同的制備方法[6]和注射劑量[7]
(1)參照GB16886.12-2017[8],不規則產品浸提比例0.2g/mL,加入0.9%氯化鈉注射液在37℃下浸提72h。取該制備條件下的浸提液,按10mL/kg的注射劑量進行試驗。
(2)對(1)中制備的樣品浸提液經3000rpm離心10min,用0.45μm 濾膜過濾作為試驗液,按照10mL/kg的注射劑量進行試驗。
(3)按照浸提比例0.1g/mL,加入0.9%氯化鈉注射液在37℃下浸提72h。取該制備條件下的浸提液按照1mL/kg的注射劑量進行試驗。
(4)對(3)中制備的浸提液用5μm過濾器過濾作為試驗液,按照0.2mL/kg的注射劑量進行試驗。
(5)對(3)中制備的浸提液用40μm過濾器過濾作為試驗液,按照0.2mL/kg的注射劑量進行熱原試驗。
(6)對(3)中制備的浸提液用40μm過濾器過濾作為試驗液,按照10mL/kg的注射劑量進行熱原試驗。
3 試驗結果
制樣方法和注射劑量按照(1)、(3)進行熱原試驗,兔在注射浸提液過程中反應異常,然后死亡。
制樣方法(2)進行離心后浸提液變成凝膠狀,無法注射導致無法進行熱原試驗。
制樣方法和注射劑量按照(4)進行熱原試驗,試驗過程中兔反應正常,但體溫升高超過0.6℃,見表1。
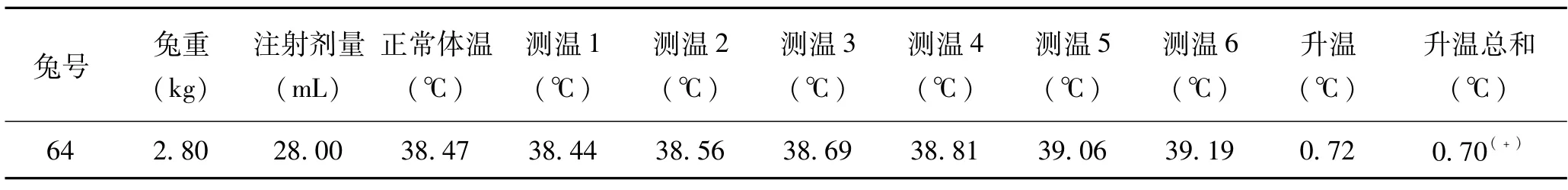
表1 熱原試驗結果(浸提比例:0.1g/ml,37℃72h,5μm過濾,注射劑量:0.2ml/kg)
制樣方法和注射劑量按照(5)使用40μm的濾膜過濾后,按0.2mL/kg的注射劑量進行熱原試驗,試驗過程兔反應正常,三只兔體溫升高均低于0.6℃,且體溫升高總和低于1.3℃,在該試驗條件下,試驗樣品浸提液熱原檢查合格,見表2。
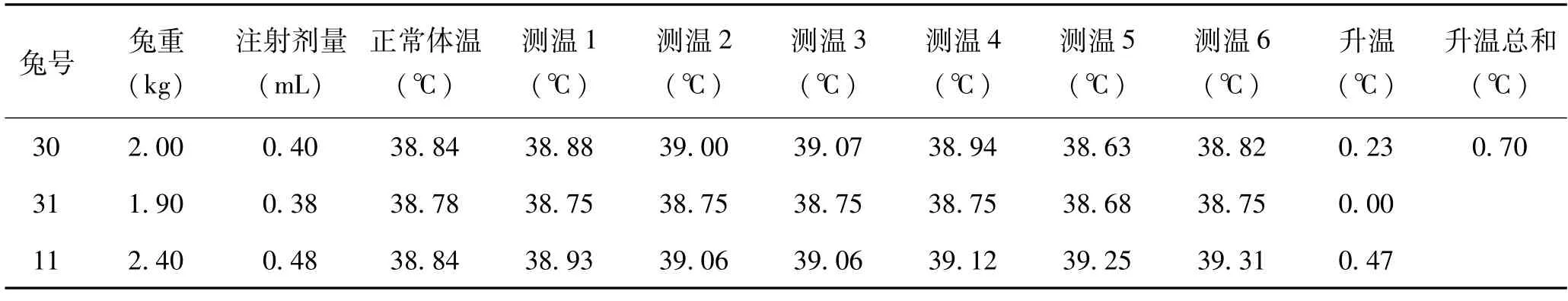
表2 熱原試驗結果(浸提比例:0.1g/ml,37℃72h,40μm過濾,注射劑:0.2ml/kg)
制樣方法和注射劑量按照(5)使用40μm的濾膜過濾后,按10mL/kg的注射劑量進行熱原試驗,試驗過程兔子反應正常,試驗樣品浸提液熱原檢查合格。見表3。
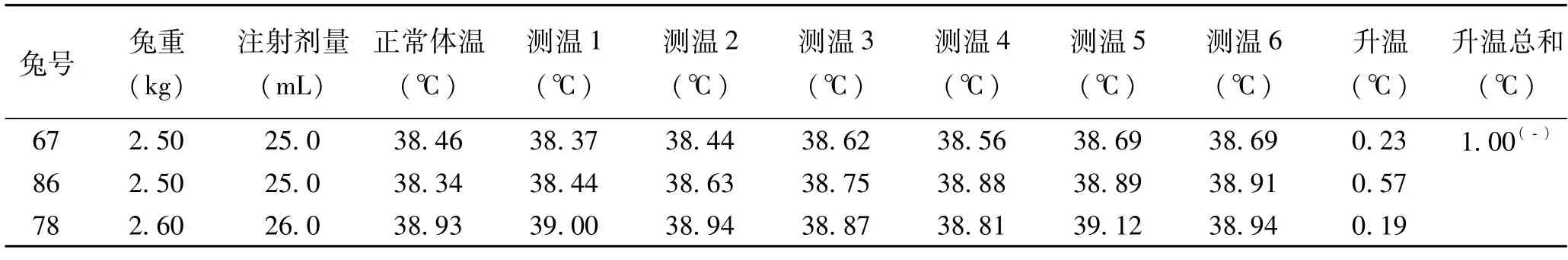
表3 熱原試驗結果(浸提比例:0.1g/ml,37℃72h,40μm過濾,注射劑量:10ml/kg)
4 討論
該次熱原試驗的探討,源于首次常規操作熱原試驗失敗。按照GB/T16886.12制樣原則,常規器械樣品制備及注射劑量:0.2g/mL,37℃、72h,10mL/kg,造成了試驗的異常,引起動物不必要死亡。經過整改后的制備方案使得試驗正常進行,討論如下。
觀察制備方法(1)后的浸提液,肉眼觀察無顆粒狀出現,但可發現溶液粘稠,故有制備方法(2)將樣品浸提液離心,經離心后,樣品浸提液出現了凝膠狀(樣品與0.9%氯化鈉注射液融合吸收)無法注射。這兩種制備的方法說明樣品按照0.2g/mL的浸提比例不適合熱原試驗操作的進行。粘稠的浸提液和凝膠狀的浸提液都可能存在大顆粒透明孔徑物質,通過兔耳緣靜脈入血,造成兔異常反應和死亡。
降低浸提比例的制備方法(3),同時注射劑量由10mL/kg降低為1mL/kg(《GB/T14233.2-2005醫用輸血、輸液、注射器具檢驗方法第二部分生物學試驗方法》的最大注射劑量是10mL/kg)[9],但實驗依然出現了兔異常反應和死亡。說明此浸提方法得出的浸提液依然存在肉眼觀察不到的大顆粒浸提物質。
對制備方法(3)用5μm過濾器過濾(出現了過濾器無法濾下,濾膜破壞),再次降低注射劑量。注射進兔體內后,兔表現正常,但體溫升高(見表1)。最終的整改制備方法是,加大過濾器的濾膜孔徑。也借助于生產商的協助,進行了樣品孔徑的測量(見表4),由圖中可以看出此種注射用修飾透明質酸鈉凝膠顆粒最小孔徑為66.897μm,再因為《中國人民共和國藥典》0102注射劑,注射用濃溶液的規定:混懸型注射液中原料藥物粒徑應控制在15μm以下,含15~20μm(間有個別20~50μm)者,不應超過10%[10]。最終選擇了40μm過濾器,取過濾液注射后,動物反應正常,體溫正常,3只家兔溫度升高均低于0.6℃,體溫升高總和低于1.3℃(見表2)。
(4)由于上述試驗方法采用過濾和降低注射劑量可以使得試驗樣品浸提液熱原檢查合格,但是降低劑量并沒有辦法充分評價產品的安全性[11],因而根據GB/T16886中規定的最大劑量再次進行熱原試驗,將浸提液通過40μm的過濾器后,按照10mL/kg的注射劑量進行試驗,注射后動物反應正常,熱原檢驗合格(見表3)。
注射用修飾透明質酸鈉凝膠的熱原試驗,因其自身的產品特性,導致試驗的特殊性,根據中華人民共和國藥典2020版四部(0102注射劑)的試驗方法中混懸型注射液中原液藥物粒徑的規定,借助激光粒度分析儀[12]對于樣品孔徑的測量(見表4)可以看出此類注射用修飾透明質酸鈉凝膠粒度最小孔徑為66.897μm,若不進行過濾處理,此粒徑大小超過了中華人民共和國藥典2020版四部(0102注射劑)中的注射用濃溶液的最大粒徑規定,因而經討論最初選擇5μm的過濾器處理樣品浸提液,結果出現很難濾過的現象,用注射器推動濾下浸提液,導致濾膜破裂。說明浸提液內依然有大分子顆粒通過破裂的濾膜進入注射液中導致體溫升高。之后采用40μm的過濾器對樣品浸提液進行過濾處理,按照GB/T16886中規定的注射劑量進行試驗,試驗動物反應正常,體溫正常。故只要試驗樣品注射液的粒徑大小符合注射標準,不需再降低注射劑量來進行試驗。雖然標準中浸提液一般不應采用過濾、離心或其他方法來去除懸浮的粒子[5],但由于樣品浸提液中的粒徑不符合《中國人民共和國藥典》0102注射劑的要求,也在實際的試驗中得到驗證,因此該產品的樣品浸提液需要經過合適的過濾器過濾后,進行熱原注射試驗。
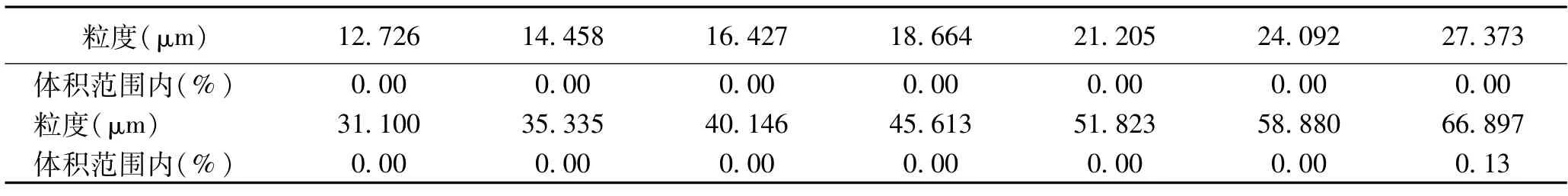
表4 激光粒度分布檢測圖
透明質酸鈉類面部注射產品在生物醫學的應用上要求有良好的生物安全性,因此通過正確處理樣品浸提液進行熱原試驗可以為此類產品的生物安全性提供一定的依據。

