運用n+0.7l規則進行多電子原子的核外電子排布推演分析
七林竹瑪,李曼彎,楊艷華,王寶玲,李艷妮,高樹林,黃素芳
(1.昆明學院 化學化工學院,云南 昆明 650214;2.紅河州蒙自第一高級中學,云南 蒙自 661100)
人教版普通高中教科書《物質結構與性質(選擇性必修2)》是研究物質的微觀結構與宏觀性能關系的化學模塊,本質是在原子和分子水平上,深入到電子層次的視角.教科書內容涉及使用量子力學研究化學問題,建立起物質結構理論[1].《普通高中化學課程標準》(2017年版)課程內容指出[2]:“知道原子核外電子的能級高低順序,了解原子核外電子排布的構造原理,認識基態原子中核外電子的排布遵循能量最低原理、泡利不相容原理和洪特規則等.知道1~36號元素基態原子核外電子的排布.”在實際教學中發現,對于大部分學生來講,認識核外電子的排布遵循能量最低原理、泡利不相容原理和洪特規則的難度不大,但是在掌握多電子的基態原子核外電子排布上,問題較多.
在教材中,以電子層次認識物質結構的觀念,被編排成的第一部分內容.其中,《第一章原子結構與性質》“第一節原子結構”課程教學內容中[3],在構造原理與電子排布式部分對構造原理的描述為:以光譜學事實為基礎,從氫開始,隨核電荷數遞增,新增電子填入能級的順序稱為構造原理.實際上,多電子原子的核外電子排布還受到軌道能級交錯的影響,以至于3d軌道的能量高于4s軌道.根據基態電子排布原則,即能量最低原理、泡利不相容原理和洪特規則,電子在3p軌道上排滿6個電子后,便進入4s軌道,占據完4s軌道之后才進入3d軌道.這對元素周期表中21~36號元素的基態原子核外電子排布都有影響,特別是對于第四周期的21~30號副族元素影響很大,不僅對大部分中學生造成學習困難,對于化學專業大學生來說,這部分內容的掌握都不太樂觀.
圖1是課本中展示的構造原理圖,圖中用小圓圈表示1個能級,每1行對應1個能層,箭頭引導的曲線顯示遞增電子填入能級的順序[3]。從圖中可以看出,原子軌道能級的增加是曲線上升的.多電子原子的原子軌道能級是1s→2s→2p→3s→3p→4s→3d→4p → 5s →4d……其中,從3d軌道和4s軌道開始出現能級交錯.核外電子先按照原子軌道能級從低到高的順序開始進行填充,完成后按照1s→2s→2p→3s→3p→3d→4s→4p→4d → 5s……的順序進行重新書寫,得到多電子原子的核外電子的排布式,這樣的講授方式學生應該更容易理解.
然而,能級交錯現象的產生,與屏蔽效應和鉆穿效應密不可分[4],這在大學的《無機化學》和《結構化學》課程中,都是難點,從中學教師的教學進度和學生的掌握能力方面來說,放到中學化學課程中講授,難度較大、耗時較長.而且,課程標準已經明確指出中學生在這部分教學內容中的認知水平和認識層次,屏蔽效應和鉆穿效應也不應該在此補充[5].因此,需要教師在科學的視角下,運用通俗易懂的教學方式,讓學生能夠快速掌握好基態原子中核外電子的排布,這樣不僅有利于學生掌握好中學階段的學習內容,也有利于在大學階段的學習發展.
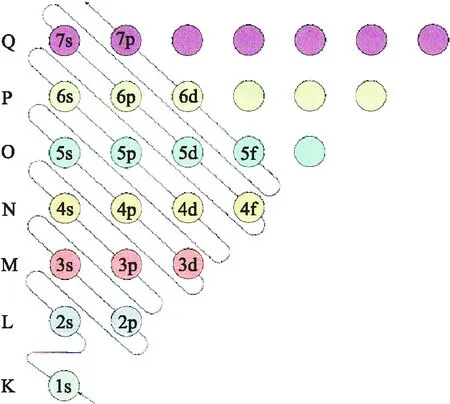
圖1 構造原理示意圖
那么,接下來的問題就是在不介紹屏蔽效應和能級分裂等理論知識的背景下,弄清楚原子軌道能級的排布.采用比較直觀的數學方式呈現給學生,即由北京大學徐光憲教授提出的電子能級分組法[6]:基態原子的原子軌道能級遵循(n+0.7l)規則排列,其中,n為主量子數,即選擇性必修2模塊中提及的能層;l為角量子數,即選擇性必修2模塊中提及的能級.能級對應的光譜學符號及占據軌道全滿時的電子數對應關系如表1所示.
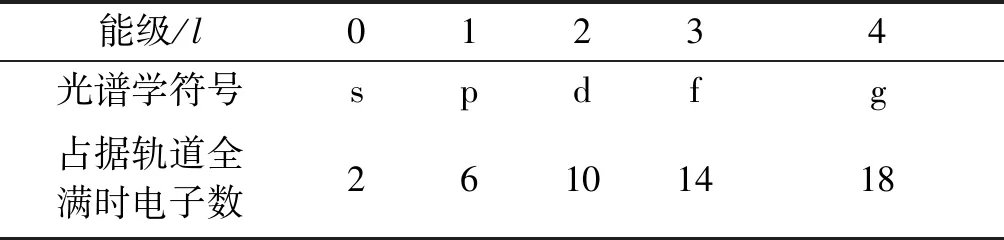
表1 能級對應的光譜學符號及占據軌道全滿時電子數對應表
“能層與能級”是中學化學選擇性必修2模塊中原子結構的第一課時內容,學生在掌握好能層與能級的知識后,依照表1的對應關系和(n+0.7l)規則,可以計算得出各原子軌道的能級數值.例如:圖2(a)的4d,4為周期數,即能層n,d代表能級l=2,所以n+0.7l=4+0.7×2=5.4,在圖2(b)對應位置用“5.4”代替“4d”.以此類推,將課本中構造原理示意圖按照(n+0.7l)規則計算出原子軌道能級數值,如圖2所示.
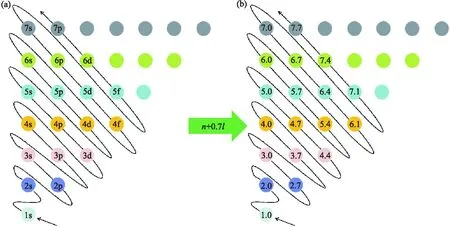
圖2 (a)中學教科書上的構造原理示意圖,(b) (n+0.7l)規則繪制的原子軌道能級示意圖
從(n+0.7l)規則繪制出原子軌道能級示意圖中,可以更加清晰的看出核外電子占據軌道的先后順序,方便教師教學和學生學習.在弄清原子軌道能級的排列順序后,核外電子按照能級高低進行填充,最后轉換成核外電子排布式.下面列舉一些例題,說明此方法的簡潔性.
1 高考實例和模擬題
例1Cu2+基態核外電子排布式為.(2019年高考,江蘇卷)
解析①推演法:Cu是29號元素,核外電子開始占據軌道,按照1s22s22p63s23p6排列后,還有11個電子需要占據軌道,根據(n+0.7l)規則,E(4s)=4.0 ②記憶法:Cu是29號元素,位于周期表中第四周期第IB族,價層電子為3d104s1,因此,Cu2+基態核外電子排布式為1s22s22p63s23p63d9. 例2基態Fe原子價層電子的電子排布圖(軌道表達式)為.(2018年高考,全國卷Ⅱ) 解析①推演法:Fe是26號元素,位于第四周期,核外電子開始占據軌道,按照1s22s22p63s23p6排列后,還有8個電子需要占據軌道,根據(n+0.7l)規則,E(4s)=4.0 圖3 Fe原子4s和3d軌道電子排列圖 ②記憶法:Fe是26號元素,位于周期表中第四周期第Ⅷ族,價層電子為3d64s2. 例3基態鎳原子的價電子排布式為.(湖北省黃岡中學2019屆高三5月2模) 解析①推演法:Ni是28號元素,位于第四周期,核外電子開始占據軌道,按照1s22s22p63s23p6排列后,還有10個電子需要占據軌道,根據(n+0.7l)規則,E(4s)=4.0 ②記憶法:Ni是28號元素,位于周期表中第四周期第Ⅷ族,價層電子為3d84s2. 例4鈦元素基態原子未成對電子數為個,能量最高的電子占據的能級符號為.(2018屆南昌市2模) 解析①推演法:Ti是22號元素,位于第四周期,核外電子開始占據軌道,按照1s22s22p63s23p6排列后,還有4個電子需要占據軌道,根據(n+0.7l)規則,E(4s)=4.0 ②記憶法:Ti是22號元素,位于周期表中第四周期第IVB族,價層電子為3d24s2. 以上例題可以看出,運用(n+0.7l)規則對多電子原子的核外電子排布進行作答,可讓學生快速書寫核外電子排布,即通過推理引導,降低學生對抽象知識的理解難度.而僅僅通過記憶21~36號元素的核外電子排布,增加了學生的學習負擔,讓大部分同學在剛開始學習物質結構與性能時就感覺吃力.缺乏推演的知識不僅會使學生思維固化,而且長時間不接觸便會記憶出錯,不利于學生長遠發展. 通過推演得出基態原子核外電子排布的方法,不僅增強了學生對基態電子排布原則的理解,而且(n+0.7l)規則的數學公式也有利于學生記憶和掌握,在大學的學習階段也能運用自如.下面就以部分高校的研究生入學考試題目為例,進行說明. 例5第27號元素的基態原子的電子排布式,它位于第周期、族、區.(華南理工大學,2009年) 解析27號元素的核外電子開始占據軌道,按照1s22s22p63s23p6排列后,還有9個電子需要占據軌道,根據(n+0.7l)規則,E(4s)=4.0 例6原子序數為53的原子,其電子分布式是.(南京航空航天大學,2004年) 解析對于第53號元素來說,核外電子開始占據軌道,按照1s22s22p63s23p6排列后,還有35個電子需要占據軌道,根據(n+0.7l)規則,E(4s)=4.0 以上例題看出,通過記憶掌握各元素核外電子排布是不切實際的,通過(n+0.7l)規則推演免去了記憶的繁瑣,在進一步學習了大學階段的原子結構和元素周期律后,在接觸不熟悉的元素時,也能推演得出結果. 基態原子核外電子排布的(n+0.7l)規則,雖然早在1956年就已經提出,但是除少數教材外,如:北京師范大學編寫的《無機化學》[7]和徐光憲編寫的《物質結構》[8]等,目前中學和部分大學的教學過程中,(n+0.7l)規則推演核外電子排布都很少被提及,主要原因包括: 1) 由于元素周期表中的元素還處在不斷被發現和認識的過程中,對于新出現的元素,核外電子的排布方式還沒有最終確定. 2) (n+0.7l)規則并不能用于已知前六周期的所有元素的核外電子排布中,例如,第五周期的鈮(Nb)、釕(Ru)、銠(Rh)、鈀(Pd),第六周期的鑭系元素(La-Lu)和鉑(Pt)等,這些元素的核外電子排布較為特殊,需要單獨記憶. 雖然(n+0.7l)規則并不十分完善,但對于學生來說,這是可以快速掌握多電子原子核外電子排布的方法,而且對于課程標準中要求的知道1~36號元素基態原子核外電子的排布完全適用.對于大學生來說,前六周期的元素,除特殊的幾個元素單獨記憶外,也可適用于其他元素.總的來說,(n+0.7l)規則的實用性較強,可以滿足學生在核外電子排布內容中的學習要求.
2 拓展延伸——研究生入學考試試題實例
3 需要說明的問題

