四種香草蘭根際土壤微生物群落功能多樣性解析
尚方劍 王潔 邢詒彰 王輝 莊輝發 趙青云
(1 海南大學園藝學院 海南海口 570228;2 中國熱帶農業科學院香料飲料研究所 海南萬寧 571533;3 海南省熱帶香辛飲料遺傳與改良品質調控重點實驗室 海南萬寧 571533)
香草蘭又名香莢蘭,享有“食品香料之王”譽稱,其豆莢經發酵生香加工后可產生200多種香氣成分,被廣泛應用于制作各種高檔食品和化妝品,附加值高,用途廣泛[1]。墨西哥香草蘭(Vanilla planifoliaAndrews)是主栽種,占世界香草蘭總種植面積的90%以上,品質佳,但抗病能力弱,易感染土傳病害;大花香草蘭(Vanilla pomponaSchiede)是香草蘭的3 大栽培種之一,品質僅次于墨西哥香草蘭;大香草蘭(Vanilla siamensisRolfe ex Downie)和帝皇香草蘭(Vanilla imperialisKraenzl)是栽培香草蘭野生近緣種,植株生長旺盛,莖蔓粗壯,具有耐寒、抗病害等優良性狀,是開展香草蘭目標性狀育種的重要資源[2]。
土壤微生物是土壤生態環境的重要組成部分[3],參與多種生物化學反應,是土壤有機物質轉化的執行者,為植物生長發育提供礦質營養,對土壤生態系統中植物健康生長有直接或間接的影響[4]。土壤微生物多樣性會隨著環境條件的變化而發生改變,是生態環境健康穩定的基礎[5]。土壤微生物群落功能多樣性是反映土壤微生物群落特征的重要指標之一[6]。植物種類、品種是影響根際微生物組成和功能作用的關鍵因素[3]。同一作物不同品種間植株根系招募的微生物類群有差異,微生物群落結構不同[7]。Yao 等[8]研究表明,不同黃瓜品種根際土壤細菌結構和組成存在明顯差異。Mendes 等[7]研究指出,不同大豆品種根際細菌群落結構不同,抗病品種根際可富集類芽孢桿菌關鍵菌群。然而,不同種香草蘭根際土壤微生物群落是否存在差異,其根際土壤微生物群落功能多樣性有何不同,目前國內外尚未見研究報道。
本研究以主栽種及野生近緣種香草蘭種植園土壤為研究對象,通過Biolog-ECO 微平板法[9-10]研究其根際土壤微生物對31 種碳源的利用情況,明確不同種香草蘭根際土壤微生物群落功能多樣性差異,以期為調控主栽種墨西哥香草蘭土壤微生物群落,從根際微生態角度改善土壤微生物功能,從而提升其抗逆能力提供依據。
1 材料與方法
1.1 材料
選取2~3 年園齡的墨西哥香草蘭(V. planifolia)、大花香草蘭(V. pompona)、帝皇香草蘭(V. imperialis)和大香草蘭(V. siamensis)種植園,分別隨機采取3 株,采用抖土法收集根際土壤[11-12],將樣品裝入封口袋中,帶回實驗室。部分土壤樣品自然風干,通過1 mm 篩孔,用于測定土壤pH、堿解氮、速效磷、速效鉀;通過0.15 mm 篩孔,用于測定土壤有機質、全氮。部分土壤樣品分置于4℃冰箱保存,用于測定土壤微生物群落功能多樣性。
1.2 方法
1.2.1 指標測定
稱取新鮮土,采用烘干稱重法測定土壤含水量。稱取通過1 mm 篩孔的風干土,采用水浸提電位法,土∶水=1∶2.5(m/V)測定土壤pH,采用堿解擴散法測定堿解氮,采用NaHCO3浸提—鉬銻抗比色法測定有效磷,采用NH4OAc 浸提—火焰光度法測定速效鉀[13]。稱取通過0.15 mm篩孔風干土,采用有機元素分析儀(Euro Vector EA 3000)測定全氮;采用總有機碳測定儀(Multi N/C 3100/1,German) 測定土壤有機碳,換算成土壤有機質(土壤有機質含量=土壤有機碳含量×1.724)。土壤樣品理化性質見表1。
利用Biolog-ECO 微平板法研究不同種香草蘭根際土壤微生物功能多樣性[14]。每樣品稱取2 g土壤,倒入18 mL 0.85%無菌生理鹽水中,之后置于200 r/min 搖床振蕩30 min,靜止15 min;吸取上清液,用生理鹽水稀釋至10-3倍;將制備好的土壤菌懸液接種于Biolog-ECO 微孔板中,每孔接種125 μL,置于28℃恒溫培養箱中培養;分別于培養的 24、48、72、96、120、148、168 h 用酶標儀測定波長為590 nm處的吸光值。

表1 土壤理化性質
1.2.2 數據計算
Biolog-ECO 微孔板中有31 種不同碳源,微生物利用碳源過程中與四唑鹽染料反應發生顏色變化,顏色深淺表明微生物對碳源的利用程度[15]。AWCD值(平均顏色變化率,Average Well Color Development),用于評價土壤微生物群落利用31種碳源的能力[16-17]。采用培養 72 h 的吸光度[14,18]值 計 算 Shannon-Wiener (H′) 多 樣 性 指 數 、Simpson(D)優勢度指數、McIntosh(U)多樣性指數、豐富度指數(S),評估微生物群落的豐富度、均勻度和多樣性等[18]。


式中:Ci表示第i孔在590 nm 處的吸光值,R表示對照孔的吸光值,n表示Biolog-ECO微孔板上碳源數量;Pi表示第i孔的相對吸光值(C-R)除以整個微孔板相對吸光值的總和;ni表示第i孔的相對吸光值;S表示吸光值>0.15的碳源。
1.2.3 數據分析
數據采用SPSS 20.0 軟件進行ANOVA 方差分析和多重比較(LSD,p<0.05);采用Biolog-ECO 微平板培養72 h 的吸光值數據進行碳源分類及主成分分析,利用Microsoft Excel 2019 做柱狀圖和主成分分析圖(PCA)。
2 結果與分析
2.1 四種香草蘭根際土壤微生物利用總碳源的能力
如圖1所示,不同種香草蘭根際土壤微生物群落平均顏色變化率(AWCD 值)隨培養時間延長呈上升趨勢,利用碳源能力不斷增強。在培養24 h內,大香草蘭和大花香草蘭根際土壤微生物AWCD值無顯著差異,增長幅度顯著低于墨西哥香草蘭和帝皇香草蘭;培養24~144 h,不同種香草蘭根際土壤微生物AWCD 值均大幅增加,碳源的利用率快速增大,144 h 后碳源的利用率趨于平緩。在72 h時,帝皇香草蘭AWCD值與墨西哥香草蘭、大香草蘭、大花香草蘭相比,分別增加了9.1%、48.4%、76.1%;在整個培養周期,帝皇香草蘭和墨西哥香草蘭AWCD 值增長速率顯著大于大香草蘭和大花香草蘭,且帝皇香草蘭對碳源利用能力在96 h 內顯著高于墨西哥香草蘭,96~168 h 與墨西哥香草蘭無顯著差異。由此可見,不同種香草蘭根際土壤微生物利用碳源能力不同,帝皇香草蘭根際土壤微生物利用碳源能力最強,土壤微生物群落代謝活性最高。

圖1 四種香草蘭根際土壤微生物利用總碳源情況
2.2 四種香草蘭根際土壤微生物利用各類碳源能力
Biolog-ECO 微平板中的31 種碳源分為6 類,碳水化合物、氨基酸、羧酸、多聚物、酚酸、胺類。由圖2 可知,4 種香草蘭根際土壤微生物群落利用各類碳源的能力不同。在培養168 h 期間,帝皇香草蘭土壤微生物群落對碳水化合物類碳源利用能力顯著高于其他3種香草蘭,大花香草蘭土壤微生物群落利用碳水化合物的能力最弱(圖2-A)。墨西哥香草蘭和帝皇香草蘭土壤微生物群落利用氨基酸類碳源的能力無顯著差異,但均顯著高于大香草蘭和大花香草蘭(圖2-B)。培養72 h 后帝皇香草蘭土壤微生物群落利用羧酸類碳源能力低于墨西哥香草蘭,但高于大香草蘭(圖2-C)。在培養72 h 之前,帝皇香草蘭土壤微生物群落利用多聚物類碳源能力增幅最大,顯著高于其他種香草蘭,但72 h 后增長速率趨于平緩,與墨西哥香草蘭無顯著差異(圖2-D)。在168 h 時,帝皇香草蘭土壤微生物群落對酚酸類碳源利用能力最弱,墨西哥香草蘭、大香草蘭、大花香草蘭分別是帝皇香草蘭的2.0、1.8 和1.7 倍(圖2-E)。在168 h時,不同種間對胺類碳源的利用能力差異顯著,墨西哥香草蘭利用率較高,與帝皇香草蘭、大花香草蘭、大香草蘭相比,分別增加了16%、26%和50%(圖2-F)。由此可見,4 種香草蘭根際土壤微生物群落對各類碳源有不同偏好,帝皇香草蘭根際土壤微生物群落利用碳水化合物、氨基酸、多聚物類碳源能力較強,對酚酸類碳源利用能力最弱;墨西哥香草蘭根際土壤微生物群落對酚酸、胺類和羧酸類碳源利用能力較強。
2.3 四種香草蘭根際土壤微生物群落多樣性指數分析
利用Biolog-ECO 微平板培養72 h 的吸光值計算Shannon-Wiener多樣性指數、Simpson優勢度指數、McIntosh 多樣性指數和豐富度指數,分析土壤微生物群落功能多樣性。由表2可知,Shannon-Wiener 多樣性指數在3.071~3.162,墨西哥香草蘭和帝皇香草蘭無顯著差異,但均顯著高于大香草蘭和大花香草蘭。Simpson 優勢度指數在0.946~0.952,墨西哥香草蘭和帝皇香草蘭無顯著差異,但均顯著高于大香草蘭和大花香草蘭。帝皇香草蘭McIntosh 多樣性指數與墨西哥香草蘭、大香草蘭、大花香草蘭相比,分別增加了6.8%、39.5%和65.4%。墨西哥香草蘭豐富度指數為28,顯著高于其他3種香草蘭,大香草蘭和大花香草蘭無顯著差異。綜上表明,帝皇香草蘭和墨西哥香草蘭土壤微生物物種多樣性和優勢度高,帝皇香草蘭土壤微生物均勻度高,墨西哥香草蘭土壤微生物對碳源的利用種類多。

圖2 四種香草蘭根際土壤微生物群落利用各類碳源能力
2.4 四種香草蘭根際土壤微生物利用碳源主成分分析
對4 種香草蘭根際土壤微生物群落利用31 種碳源的數據進行PCA分析,根據主成分分析提取原則(特征值>1),提取了3 個主成分,其中PC1(主成分1)和PC2(主成分2)的方差貢獻率分別為47.06%、26.95%,累積方差貢獻率為95.45%。大香草蘭處于PC1 軸負方向和PC2 軸的正方向,與大花香草蘭距離較近,土壤微生物群落結構相似,對碳源的利用能力相似(圖3)。帝皇香草蘭在PC1上明顯區分于大花香草蘭和大香草蘭,在PC2上明顯區別于墨西哥香草蘭,且墨西哥香草蘭與大香草蘭及大花香草蘭距離較遠,說明4種香草蘭根際土壤微生物群落結構差異顯著,對碳源利用能力有較大差異;帝皇香草蘭根際土壤微生物群落結構與墨西哥香草蘭、大香草蘭和大花香草蘭明顯不同;大香草蘭和大花香草蘭根際土壤微生物群落結構相似。

表2 四種香草蘭根際土壤微生物群落功能多樣性指數分析
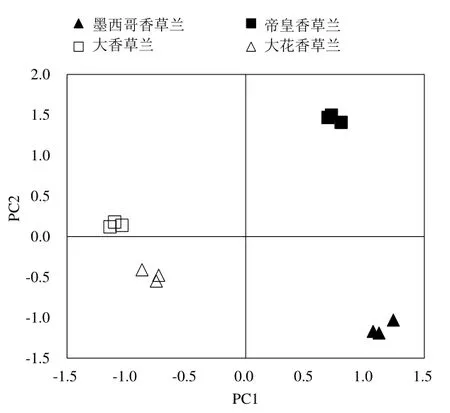
圖3 四種香草蘭根際土壤微生物群落利用碳源能力主成分分析
由主成分分析相關矩陣可知,對PC1貢獻最大的有17 種碳源(表3),主要包括:6 種碳水化合物(D-木糖、β-甲基D-葡萄糖苷、D-纖維二糖、葡萄糖-1-磷酸鹽、I-赤藻糖醇、D,L-α-甘油);3種羧酸(丙酮酸甲酯、衣康酸、D-蘋果酸);3種氨基酸(L-天冬酰氨酸、L-絲氨酸、甘氨酰-L-谷氨酸);2 種多聚物(肝糖、α-環式糊精);2 種胺類(苯乙基胺、N-乙酰基-D-葡萄糖胺);1 種酚酸,即2-羥基苯甲酸。對PC2 貢獻最大的有5 種碳源,主要包括2種碳水化合物(α-D-乳糖、D-半乳糖醛酸),1 種羧酸(γ-羥基丁酸),1 種酚酸(4-羥基苯甲酸)和1 種胺類(腐胺)。對PC1 影響最大的碳源是碳水化合物、羧酸、氨基酸;對PC2影響最大的碳源是碳水化合物。碳水化合物、羧酸、氨基酸是不同種香草蘭土壤微生物群落利用的主要碳源。
3 討論
不同品種、不同植物基因型影響土壤微生物群落多樣性和代謝活性[8]。楊煒迪等[19]研究了5種牧草根際土壤微生物功能多樣性,發現不同牧草品種根際土壤微生物在代謝活性、微生物多樣性指數和不同種類碳源利用能力方面均存在差異。張明莉等[20]研究發現,外來種意大利蒼耳與本地種蒼耳根際土壤微生物功能多樣性和對各類碳源的利用效率差異顯著。本研究通過分析4種香草蘭根際土壤微生物群落對總碳源的利用能力發現,不同種香草蘭根際土壤微生物對總碳源的利用能力均隨培養時間增加呈上升趨勢,土壤微生物活性增強,144 h 后逐漸趨于平緩,土壤微生物活性趨于穩定。趙蘭鳳等[21]對廣東省不同區域菜園土壤微生物群落進行了研究,結果顯示土壤微生物群落AWCD 值隨培養時間延長呈先升高后趨于平穩的趨勢,與本研究結果相似。抗病種帝皇香草蘭根際土壤微生物總體碳代謝活力高于其他3種香草蘭(圖1)。Yao 等[8]研究了不同抗性黃瓜品種根際土壤微生物利用碳源能力,發現易感病黃瓜品種根際土壤微生物利用碳源能力低于抗病品種,這可能是抗病種土壤微生物群落功能多樣性較高的原因[8]。
土壤微生物群落功能多樣性指數被廣泛應用于評價土壤微生物群落多樣性變化和土壤微生物群落組成。Shannon-Wiener 多樣性指數反映土壤微生物物種的多樣性[22];Simpson優勢度指數反映土壤微生物群落物種優勢度[22];McIntosh 多樣性指數反映土壤微生物群落的均勻度[21];豐富度指數反映物種可利用的碳源數量[18,23]。張旭龍等[24]研究表明,不同品種油葵根際土壤微生物群落功能多樣性指數差異明顯。由表2可得出,不同種香草蘭根際土壤微生物群落功能多樣性指數不同,帝皇香草蘭根際土壤微生物群落多樣性、優勢度和均勻度高,微生物種類高度協調,而墨西哥香草蘭根際土壤微生物利用的碳源數量多,微生物種群豐富。

表3 PC1和PC2相關的碳源種類
由圖2可知,帝皇香草蘭根際土壤富集較多的可利用碳水化合物、氨基酸、多聚物的微生物,墨西哥香草蘭根際土壤富集較多的可利用酚酸和胺類物質的微生物,這可能與其根系分泌物組成不同有關。植物根系分泌物為土壤微生物提供豐富的營養,影響根際土壤微生物群落結構[4]。Kwak 等[25]研究發現,2 個不同抗性番茄品種根際微生物菌群結構明顯不同。農澤梅等[26]研究發現,不同品種甘蔗根際微生物優勢菌群存在明顯差異。張旭龍[24]等研究表明,不同品種油葵鹽堿地土壤微生物對碳源利用能力存在差異,影響了鹽堿地土壤微生態環境。基于主成分分析(PCA)結果,不同種香草蘭根際土壤微生物對碳水化合物、羧酸類和氨基酸類碳源利用能力較強(表3),說明不同種香草蘭根際土壤均富集了可利用碳水化合物、羧酸和氨基酸的微生物,引起不同種香草蘭土壤微生物群落變化的碳源為碳水化合物、羧酸類和氨基酸類物質。楊煒迪[19]等研究發現,不同牧草品種根際土壤微生物利用的主要碳源為碳水化合物類、氨基酸類和羧酸類。李慧等[27]研究也指出,碳水化合物和氨基酸類碳源是5種草原植物根際土壤微生物利用的主要碳源。因此,不同種香草蘭根際土壤微生物群落多樣性不同,可能與其根系分泌物不同有關。
綜上,4 種香草蘭根際土壤微生物群落功能多樣性和對各類碳源的偏好均不同,其中,野生抗病種帝皇香草蘭根際土壤微生物代謝活性、群落多樣性、物種優勢度和均勻度較高,利用碳源能力強。本研究為從根際微生態角度改善主栽種香草蘭土壤菌群結構,從而提升其抗性提供理論基礎。

