透骨消痛膠囊調(diào)節(jié)Ras-Raf-MEK1/2-ERK1/2信號(hào)通路抑制骨關(guān)節(jié)炎炎癥反應(yīng)的機(jī)制研究
林木南,邵 翔,許麗梅,張 欣,朱在師,韓一旦,段辛威,陳建梅,高 松,李西海*
1中國(guó)人民解放軍聯(lián)勤保障部隊(duì)第九〇〇醫(yī)院,福建 福州350025;
2福建中醫(yī)藥大學(xué)中西醫(yī)結(jié)合學(xué)院,福建 福州350122
骨關(guān)節(jié)炎(Osteoarthritis,OA)是一種常見(jiàn)的慢性退行性骨關(guān)節(jié)疾病,是生物力學(xué)、生物學(xué)、基因遺傳等多種復(fù)雜因素共同作用的結(jié)果,其臨床表現(xiàn)為關(guān)節(jié)疼痛、功能障礙,甚至關(guān)節(jié)畸形等,主要病理變化為軟骨退變、骨贅形成、軟骨下骨重塑異常等[1-2]。炎癥反應(yīng)是導(dǎo)致軟骨退變的關(guān)鍵因素[3],而Ras-Raf-絲裂原激活蛋白激酶的激酶(mitogenactivated proteinkinase kinase,MEK)-細(xì)胞外信號(hào)調(diào)節(jié)激酶(extracellular-signal-regulated kinase,ERK)信號(hào)通路在軟骨基質(zhì)降解的過(guò)程中發(fā)揮關(guān)鍵的調(diào)控作用[4-5],也是防治OA的潛在有效靶點(diǎn)。微小核糖核酸(micro ribonucleic acids,miRNAs)是一類非編碼的小RNA分子,通過(guò)與信使RNA的直接結(jié)合,從而起到調(diào)控基因表達(dá)的作用,參與炎癥反應(yīng)的調(diào)控[6]。其中,miR-27b、miR-34a、miR-146a與OA發(fā)生發(fā)展密切相關(guān),miR-27b可以靶向基質(zhì)金屬蛋白酶(matrix metallopeptidase,MMP)-13,影響軟骨基質(zhì)的降解[7],miR-34a則與炎癥因子介導(dǎo)的軟骨細(xì)胞凋亡相關(guān)[8],miR-146a可作為炎癥信號(hào)通路的負(fù)反饋調(diào)節(jié)器,參與OA炎癥反應(yīng)中[9],均已成為OA的生物標(biāo)志物和治療靶點(diǎn)研究的熱點(diǎn)問(wèn)題。
透骨消痛膠囊是福建中醫(yī)藥大學(xué)附屬第二人民醫(yī)院院內(nèi)制劑(批準(zhǔn)文號(hào):閩制字Z20100006),具有補(bǔ)肝腎、強(qiáng)筋骨、止痹痛之功,長(zhǎng)期應(yīng)用于臨床,療效可靠。本課題組前期研究顯示,透骨消痛膠囊能夠抑制OA的炎癥反應(yīng),但具體作用機(jī)制有待深入研究[10]。因此,本研究以脂多糖(Lipopolysaccharide,LPS)誘導(dǎo)軟骨細(xì)胞炎癥反應(yīng)為OA細(xì)胞模型,采用透骨消痛膠囊干預(yù),觀察Ras-Raf-MEK1/2-ERK1/2信號(hào)通路中關(guān)鍵調(diào)控因子表達(dá)及miR-27b、miR-34a、miR-146a的變化,旨在揭示透骨消痛膠囊抑制OA炎癥反應(yīng)的作用機(jī)制,為臨床的應(yīng)用推廣提供實(shí)驗(yàn)依據(jù)。
1 材料與儀器
1.1 實(shí)驗(yàn)動(dòng)物
4周齡SPF級(jí)SD雄性大鼠20只,購(gòu)于上海斯萊克實(shí)驗(yàn)動(dòng)物公司[生產(chǎn)許可證號(hào):SYXK(滬)2017-0005],由福建中醫(yī)藥大學(xué)實(shí)驗(yàn)動(dòng)物中心提供飼養(yǎng)環(huán)境及設(shè)施[許可證號(hào):SYXK(閩)2019-0007]。本研究中處理實(shí)驗(yàn)動(dòng)物方法符合《關(guān)于善待實(shí)驗(yàn)動(dòng)物的指導(dǎo)性意見(jiàn)》。
1.2 實(shí)驗(yàn)藥物與試劑
透骨消痛膠囊組方:巴戟天12 g,白芍12 g,川芎6 g,腫節(jié)風(fēng)6 g。參照前期透骨消痛膠囊提取方法[11]:14倍量超純水回流提取藥物2次,每次微沸后計(jì)時(shí)2 h,合并濾液后過(guò)濾,旋轉(zhuǎn)蒸發(fā)濃縮,完全干燥后稱取浸膏使用無(wú)菌PBS配制藥物母液100 mg/mL,超聲溶解后,無(wú)菌濾頭過(guò)濾,4℃保存,備用,實(shí)驗(yàn)時(shí)根據(jù)需要進(jìn)行稀釋。
LPS(美國(guó)Sigma公司);顯影液、RIPA裂解液、BCA蛋白濃度測(cè)定試劑盒(上海碧云天公司);胎牛血清(美國(guó)Gibco公司);MMP-3、MMP-13、p-ERK1/2、ERK1/2、MEK1/2、Raf、Ras抗體(美國(guó)Abcam公司);羊抗兔、羊抗小鼠(武漢博士德生物公司)。
2 實(shí)驗(yàn)方法
2.1 軟骨細(xì)胞提取與鑒定
采用機(jī)械-Ⅱ型膠原酶消化法獲得大鼠原代軟骨細(xì)胞,即麻醉處死大鼠后,取雙側(cè)膝關(guān)節(jié),手術(shù)刀片削取透明軟骨層,Ⅱ型膠原酶消化處理,每隔2 h收集消化液,離心后即獲得原代軟骨細(xì)胞,進(jìn)行培養(yǎng)。待細(xì)胞長(zhǎng)至培養(yǎng)瓶85%時(shí),進(jìn)行傳代。取第2代軟骨細(xì)胞,爬片培養(yǎng)后,多聚甲醛固定、0.5%Txiton處理,根據(jù)免疫組化試劑盒(武漢博士德公司)試劑說(shuō)明進(jìn)行操作,DAB顯色液(北京中杉公司)顯色,顯微鏡觀察下記錄結(jié)果。
2.2 軟骨細(xì)胞分組和干預(yù)
取對(duì)數(shù)期生長(zhǎng)的第2代軟骨細(xì)胞分為4組,參照本課題組前期實(shí)驗(yàn)結(jié)果[11-12],10 ng/mL LPS誘導(dǎo)建立軟骨細(xì)胞炎癥模型,透骨消痛膠囊最佳干預(yù)濃度為300μg/mL。具體干預(yù)方法如下:空白組用含10%胎牛血清(fetal bovine serum,F(xiàn)BS)的培養(yǎng)基(dulbecco modified eagle medium,DMEM)培養(yǎng)8 h;模型組用含10 ng/mL LPS的10%FBS DMEM培養(yǎng)8 h;抑制劑組先用含10 ng/mL U0126的10%FBS DMEM干預(yù)30 min,再加入LPS培養(yǎng)8 h;透骨消痛膠囊組用含10 ng/mL LPS及300μg/mL透骨消痛膠囊的10%FBS DMEM同時(shí)培養(yǎng)8 h。
2.3 蛋白表達(dá)檢測(cè)
各組干預(yù)結(jié)束后,收集蛋白樣本,依據(jù)碧云天BCA蛋白定量試劑盒說(shuō)明進(jìn)行定量,獲取蛋白濃度,變性后,采用蛋白免疫印跡(Western blot)法對(duì)蛋白進(jìn)行處理,顯影曝光后獲得條帶,并選擇β-actin作為內(nèi)參,進(jìn)行計(jì)算分析。每個(gè)指標(biāo)獲得3次有效數(shù)據(jù)后,進(jìn)行統(tǒng)計(jì)分析。
2.4 基因表達(dá)檢測(cè)
各組干預(yù)結(jié)束后,采用Trizol法提取總RNA,檢測(cè)RNA濃度。再依據(jù)PrimeScriptTMRT reagent Kit試劑盒進(jìn)行逆轉(zhuǎn)錄,取2μL逆轉(zhuǎn)錄產(chǎn)物,根據(jù)ChamQ?SYBR?qPCR Master Mix說(shuō)明,上機(jī)進(jìn)行檢測(cè),選擇GAPDH作為參照指標(biāo)進(jìn)行計(jì)算,其中引物序列見(jiàn)表1。
2.5 miRNAs表達(dá)檢測(cè)
各組干預(yù)結(jié)束后,美國(guó)Taqman公司mirco-RNA提取試劑盒提取總miRNA,檢測(cè)miRNA濃度后,依據(jù)RevertAid First Strand cDNA Synthesis Kit試劑盒說(shuō)明進(jìn)行反轉(zhuǎn)錄,取反轉(zhuǎn)錄后產(chǎn)物,qPCR法進(jìn)行檢測(cè),分析計(jì)算所得數(shù)據(jù)。

表1 qPCR引物序列Table 1 Primer sequence of qPCR
2.6 統(tǒng)計(jì)學(xué)方法
3 結(jié) 果
3.1 軟骨細(xì)胞鑒定結(jié)果
Ⅱ型膠原組化陽(yáng)性組細(xì)胞胞漿被染為棕黃色,細(xì)胞核呈藍(lán)色,陰性對(duì)照組細(xì)胞胞漿未見(jiàn)明顯棕黃色染色,僅有細(xì)胞核被染為藍(lán)色,表明所獲得的細(xì)胞為軟骨細(xì)胞。見(jiàn)圖1。
3.2 軟骨細(xì)胞蛋白檢測(cè)結(jié)果
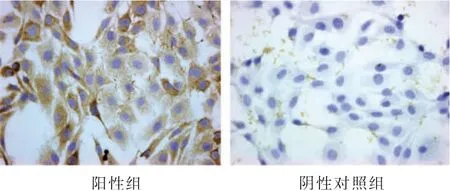
圖1 免疫組化鑒定(×400)Figure 1 Identification by using immunocytochemistry(×400)
軟骨細(xì)胞中Ras、Raf、MEK1/2、MMP-3、MMP-13蛋白表達(dá)比較,模型組比空白組明顯升高(P<0.01,P<0.05),p-ERK1/2模型組比空白組表達(dá)升高,但差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05);與模型組相比,抑制劑組與透骨消痛膠囊組Ras、Raf、p-ERK1/2、MEK1/2、MMP-3、MMP-13蛋白表達(dá)均明顯下降(P<0.01,P<0.05),其中MEK1/2蛋白表達(dá)透骨消痛膠囊組比模型組降低,但差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。見(jiàn)圖2和表2。
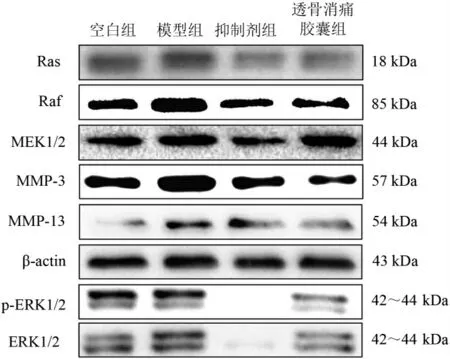
圖2 Ras-Raf-MEK1/2-ERK1/2信號(hào)通路關(guān)鍵調(diào)控因子及MMPs蛋白表達(dá)比較Figure 2 Comparison of key factors of Ras-Raf-MEK1/2-ERK1/2 signaling pathway and expression of MMPs protein
表2 Ras-Raf-MEK1/2-ERK1/2信號(hào)通路關(guān)鍵調(diào)控因子及MMPs蛋白表達(dá)比較(±s)Table 2 Comparison of key factors of Ras-Raf-MEK1/2-ERK1/2 signaling pathway and expression of MMPs protein(±s)
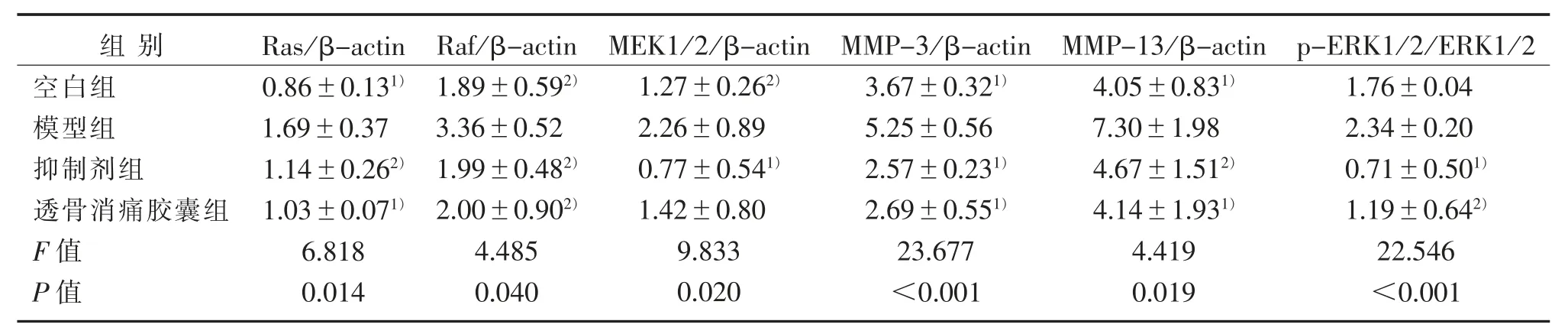
表2 Ras-Raf-MEK1/2-ERK1/2信號(hào)通路關(guān)鍵調(diào)控因子及MMPs蛋白表達(dá)比較(±s)Table 2 Comparison of key factors of Ras-Raf-MEK1/2-ERK1/2 signaling pathway and expression of MMPs protein(±s)
注:與模型組比較,1)P<0.01,2)P<0.05。Note:Compared with the model group,1)P<0.01,2)P<0.05.
?
3.3 軟骨細(xì)胞基因檢測(cè)結(jié)果
軟骨細(xì)胞中MEK1/2、ERK1/2、MMP-3、MMP-13基因表達(dá)比較,模型組比空白組均明顯升高(P<0.01);抑制劑組、透骨消痛膠囊組比模型組表達(dá)均降低(P<0.01,P<0.05)。見(jiàn)表3。
表3 MEK1/2、ERK1/2、MMP-3和MMP-13 mRNA表達(dá)比較(2-△△CT)(±s)Table 3 Comparison of MEK1/2,ERK1/2,MMP-3 and MMP-13 mRNA expression(2-△△CT)(±s)

表3 MEK1/2、ERK1/2、MMP-3和MMP-13 mRNA表達(dá)比較(2-△△CT)(±s)Table 3 Comparison of MEK1/2,ERK1/2,MMP-3 and MMP-13 mRNA expression(2-△△CT)(±s)
注:與模型組比較,1)P<0.01,2)P<0.05。Note:Compared with the model group,1)P<0.01,2)P<0.05.
?
3.4 軟骨細(xì)胞mi RNAs檢測(cè)結(jié)果
軟骨細(xì)胞中miR-27b的表達(dá),模型組低于空白組(P<0.01),抑制劑組、透骨消痛膠囊組均高于模型組(P<0.01);miR-34a、miR-146a的表達(dá),模型組均高于空白組(P<0.01,P<0.05),抑制劑組、透骨消痛膠囊組均低于模型組(P<0.01,P<0.05)。見(jiàn)表4。
表4 miRNAs表達(dá)比較(2-△△CT)(±s)Table 4 Comparison of miRNAs expression(2-△△CT)(±s)

表4 miRNAs表達(dá)比較(2-△△CT)(±s)Table 4 Comparison of miRNAs expression(2-△△CT)(±s)
注:與模型組比較,1)P<0.01,2)P<0.05。Note:Compared with the model group,1)P<0.01,2)P<0.05.
?
4 討 論
OA屬于中醫(yī)學(xué)“痹證”“痿證”范疇,病位在肝腎,病在筋骨,以肝腎虧虛、筋骨失養(yǎng)致痿為本,以腠理空虛復(fù)感風(fēng)寒濕邪致痹為標(biāo)[13]。透骨消痛膠囊由巴戟天、白芍、川芎、腫節(jié)風(fēng)組成,方中巴戟天辛溫,補(bǔ)腎強(qiáng)筋,祛風(fēng)除濕以治本為君藥;白芍苦酸,養(yǎng)血柔肝止痛為臣藥;川芎辛溫,活血行氣,祛風(fēng)止痛,腫節(jié)風(fēng)祛風(fēng)通絡(luò),活血止痛,二者均為佐使藥。四藥共奏補(bǔ)肝腎、強(qiáng)筋骨、止痹痛之功效,長(zhǎng)期應(yīng)用于臨床療效可靠。
Ras-Raf-MEK1/2-ERK1/2信號(hào)通路屬于絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號(hào)通路的一部分[14]。當(dāng)炎癥因素刺激細(xì)胞后,炎癥因子與細(xì)胞膜上的受體特異性結(jié)合,從而激活MAPK信號(hào)下游的Ras-Raf-MEK1/2-ERK1/2信號(hào)通路,即經(jīng)信號(hào)傳遞后,Ras由失活狀態(tài)轉(zhuǎn)為活化,并進(jìn)一步活化在胞膜上的Raf,Raf被激活后與信號(hào)通路中的“樞紐”MEK結(jié)合,從而激活MEK,活化的MEK則與ERK直接聯(lián)接,激活ERK,使其由胞漿進(jìn)入胞核,激活轉(zhuǎn)錄因子,以此參與調(diào)控軟骨細(xì)胞增殖、凋亡及炎癥等生物過(guò)程,引起OA軟骨退變等病理改變[15-16]。故Ras-Raf-MEK1/2-ERK1/2信號(hào)通路是治療OA的一個(gè)潛在途徑。LPS則可以通過(guò)一系列的級(jí)聯(lián)反應(yīng)激活相關(guān)炎癥信號(hào)通路,刺激多個(gè)炎癥因子如腫瘤壞死因子(tumor necrosis factor,TNF)-α、白細(xì)胞介素(interleukin,IL)-1等表達(dá),多用于炎癥反應(yīng)的體外研究。本課題組前期實(shí)驗(yàn)結(jié)果亦表明,10 ng/mL LPS干預(yù)8 h可明顯刺激TNFα、IL-1β的表達(dá),誘導(dǎo)軟骨細(xì)胞炎癥反應(yīng)[12]。故本研究中選擇LPS作為誘導(dǎo)劑,建立大鼠軟骨細(xì)胞體外炎癥模型進(jìn)行研究。
MMPs是參與細(xì)胞外基質(zhì)變性降解和OA發(fā)病的主要蛋白酶。MMPs家族成員眾多,不同的MMPs可作用于不同的軟骨基質(zhì)導(dǎo)致其降解[17]。MMP-13是引起OA軟骨退變的眾多MMPs中最為關(guān)鍵的酶,在軟骨基質(zhì)的降解中起主導(dǎo)作用,在優(yōu)先消化Ⅱ型膠原的同時(shí),還能夠降解蛋白多糖,加速破壞軟骨基質(zhì)。MMP-3在降解多種膠原和蛋白多糖的同時(shí),激活其他的MMPs,介導(dǎo)結(jié)締組織的重塑。一般情況下MMPs的正常作用可以維持軟骨基質(zhì)的合成與降解平衡,而炎癥因子會(huì)導(dǎo)致MMPs過(guò)度表達(dá),軟骨基質(zhì)降解過(guò)度,最終導(dǎo)致軟骨病變。
本研究結(jié)果顯示,經(jīng)LPS刺激后模型組中Ras-Raf-MEK1/2-ERK1/2信號(hào)通路的關(guān)鍵調(diào)控因子及MMP-3、MMP-13表達(dá)均明顯增多,表明LPS誘導(dǎo)軟骨細(xì)胞炎癥反應(yīng)模型成功建立。透骨消痛膠囊干預(yù) 后 則 明 顯 降 低Ras、Raf、MEK1/2、ERK1/2的 表達(dá),其趨勢(shì)同抑制劑組一致,表明透骨消痛膠囊可調(diào)控Ras-Raf-MEK1/2-ERK1/2信號(hào)通路中關(guān)鍵因子的表達(dá);同時(shí)透骨消痛膠囊干預(yù)后MMP-3、MMP-13的表達(dá)亦減少,表明透骨消痛膠囊可抑制炎癥反應(yīng)介導(dǎo)的軟骨基質(zhì)降解。
在OA中,miRNAs參與調(diào)控炎癥因子及MMPs的表達(dá),對(duì)軟骨基質(zhì)的合成、降解有關(guān)鍵的調(diào)控作用[18]。在使用IL-1β誘導(dǎo)軟骨細(xì)胞后,miR-27b的表達(dá)明顯降低,并促進(jìn)Col2a1、抑制MMP-13的表達(dá),從而影響軟骨基質(zhì)的降解,且MMP-13是miR-27b的靶基因之一[7]。miR-34a則與炎癥因子介導(dǎo)的軟骨細(xì)胞凋亡相關(guān),在OA患者軟骨中的表達(dá)增多[8]。IL-1β作為誘導(dǎo)劑刺激軟骨細(xì)胞后,miR-34a表達(dá)明顯增高,并引起細(xì)胞死亡和衰老。miR-34a還可以降低Col2a1基因的表達(dá),影響Ⅱ型膠原表達(dá),破壞軟骨的合成[19]。miR-146a則刺激多種炎癥因子的表達(dá),并受炎癥因子的影響。軟骨細(xì)胞系A(chǔ)TDC5經(jīng)LPS刺激后,炎癥因子IL-1β、IL-6、IL-8和TNF-α的表達(dá)和產(chǎn)物增加,miR-146a表達(dá)亦明顯上升,并且過(guò)表達(dá)miR-146a后加重了LPS誘導(dǎo)的炎癥損傷[9]。另有研究表明[20],miR-146a通過(guò)靶向TNF受體相關(guān)因子6(Tumor necrosis factor receptor associated factor 6,TRAF6)和IL-1受體相關(guān)激酶1(interleukin receptor-1 associated kinase-1,IRAK1)作為促炎信號(hào)通路的負(fù)反饋調(diào)節(jié)器,參與到OA炎癥反應(yīng)中。
本研究結(jié)果顯示,與空白組相比,模型組中miR-27b表達(dá)明顯降低,miR-146a、miR-34a表達(dá)明顯升高,而透骨消痛膠囊干預(yù)后,miR-27b表達(dá)上升,miR-146a、miR-34a的表達(dá)下降,說(shuō)明透骨消痛膠囊可以調(diào)控上述miRNAs的表達(dá),通過(guò)調(diào)控mRNA的起始調(diào)控因子,抑制OA炎癥反應(yīng)及軟骨基質(zhì)的降解。
綜上,透骨消痛膠囊通過(guò)調(diào)控Ras-Raf-MEK1/2-ERK1/2信號(hào)通路中關(guān)鍵調(diào)控因子及miR-27b、miR-146a、miR-34a的表達(dá),調(diào)節(jié)軟骨細(xì)胞炎癥反應(yīng),從而抑制骨關(guān)節(jié)炎炎癥及軟骨基質(zhì)的降解,保護(hù)關(guān)節(jié)軟骨。但由于OA的發(fā)病機(jī)制尚未完全明確,且中藥成分復(fù)雜具有多靶點(diǎn)的特性,其機(jī)制仍需進(jìn)一步深入研究證實(shí)。

