兒童異基因造血干細胞移植后可逆性后部白質腦綜合征MRI表現
楊 洋,袁新宇,王 瑤,胡夢澤,劉 嶸,石玉鑄
(1.首都兒科研究所附屬兒童醫院放射科,3.血液科,北京 100020;2.北京京都兒童醫院放射科,北京 102208;4.北京陸道培醫院放射科,北京 100176)
異基因造血干細胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)是目前治療兒童惡性及部分非惡性疾病的重要方法之一,而移植后神經系統并發癥發病率較高[1],其中可逆性后部白質腦綜合征(posterior reversible encephalopathy syndrome, PRES)逐漸受到臨床關注;如能得到及時診斷及治療,多數allo-HSCT后PRES患兒的神經系統癥狀可迅速好轉甚至完全恢復,預后良好;而診治延誤則可能導致不可逆性損傷甚至死亡[2]。PRES臨床表現缺乏特異性,可為癇性發作、意識障礙、頭痛或視覺異常等。隨著神經影像學技術的發展,MR成為檢查腦內病變最敏感的方法之一。本研究觀察allo-HSCT后PRES的MRI表現,以期提高影像科醫生對本病的認識。
1 資料與方法
1.1 研究對象 2015年1月—2020年12月1 207例患兒接受allo-HSCT,其中23例經臨床綜合診斷為PRES,男9例,女14例;年齡1~15歲,中位年齡4歲;發病時間為移植后18~134天;原發病變包括8例急性淋巴細胞白血病、6例再生障礙性貧血、5例急性髓細胞性白血病及4例噬血細胞綜合征。23例中,19例于移植后90天內發病;23例均出現突發抽搐和不同程度精神狀態異常(神志淡漠、反應弱),其中9例急性血壓升高,4例頭痛,4例出現視物模糊;均于出現臨床癥狀48 h內接受MR檢查。排除合并其他神經功能障礙疾病如感染、代謝異常、血栓性微血管病變、出血和腫瘤浸潤者。檢查前患兒監護人均簽署知情同意書。
1.2 儀器與方法 采用GE Signal 1.5T/GE Signa HD 3.0T/Siemens Avanto 1.5T MR儀,配備頭部線圈。囑患兒仰臥,對無法配合檢查者予口服水合氯醛(0.5 ml/kg體質量)鎮靜,行頭顱MR掃描。參數:軸位T1WI,采用自旋回波(spin echo, SE)序列,TR 750~2 000 ms,TE 7~17 ms;軸位T2WI,采用快速自旋回波(fast spin echo, FSE)序列,TR 4 100~4 800 ms,TE 114~126 ms;軸位液體衰減反轉恢復(fluid attenuated inversion recovery, FLAIR)序列,TR 6 000~7 800 ms,TE 145~174 ms;軸位彌散加權成像(diffusion weighted imaging, DWI),TR 5 000~6 000 ms,TE 81~90 ms,b=1 000 s/mm2;矢狀位T1WI,采用SE序列,TR 340~540 ms,TE 8~17 ms;冠狀位FLAIR序列,TR 7 800 ms,TE 174 ms;掃描層厚均為4~5 mm,層間隔1 mm。對9例間隔10~75天(中位時間26天)復查頭顱MR。
1.3 圖像分析 由2名具有10年以上工作經驗的兒科神經系統影像學醫師分別觀察MRI,包括病灶累及范圍和信號特點,意見不一時經討論達成共識。
2 結果
23例allo-HSCT 后PRES中,21例雙側、2例僅單側受累;23例均累及頂枕葉皮質及皮質下白質,7例額顳葉皮質及皮質下白質受累,3例深部白質受累,單側丘腦累及見于2例,胼胝體、單側基底節及單側小腦受累各1例。
病灶于T1WI呈邊緣模糊的等或低信號,T2WI和FLAIR序列圖像呈高信號(圖1A、1B、2A及3A),FLAIR圖像顯示病灶較T2WI更為清晰;14例DWI見條片狀高信號(圖1C),以皮質區為著;ADC圖中皮質、皮質下及深部白質區病灶呈稍高或等信號(圖1D),丘腦、基底節及小腦病灶呈稍低信號。
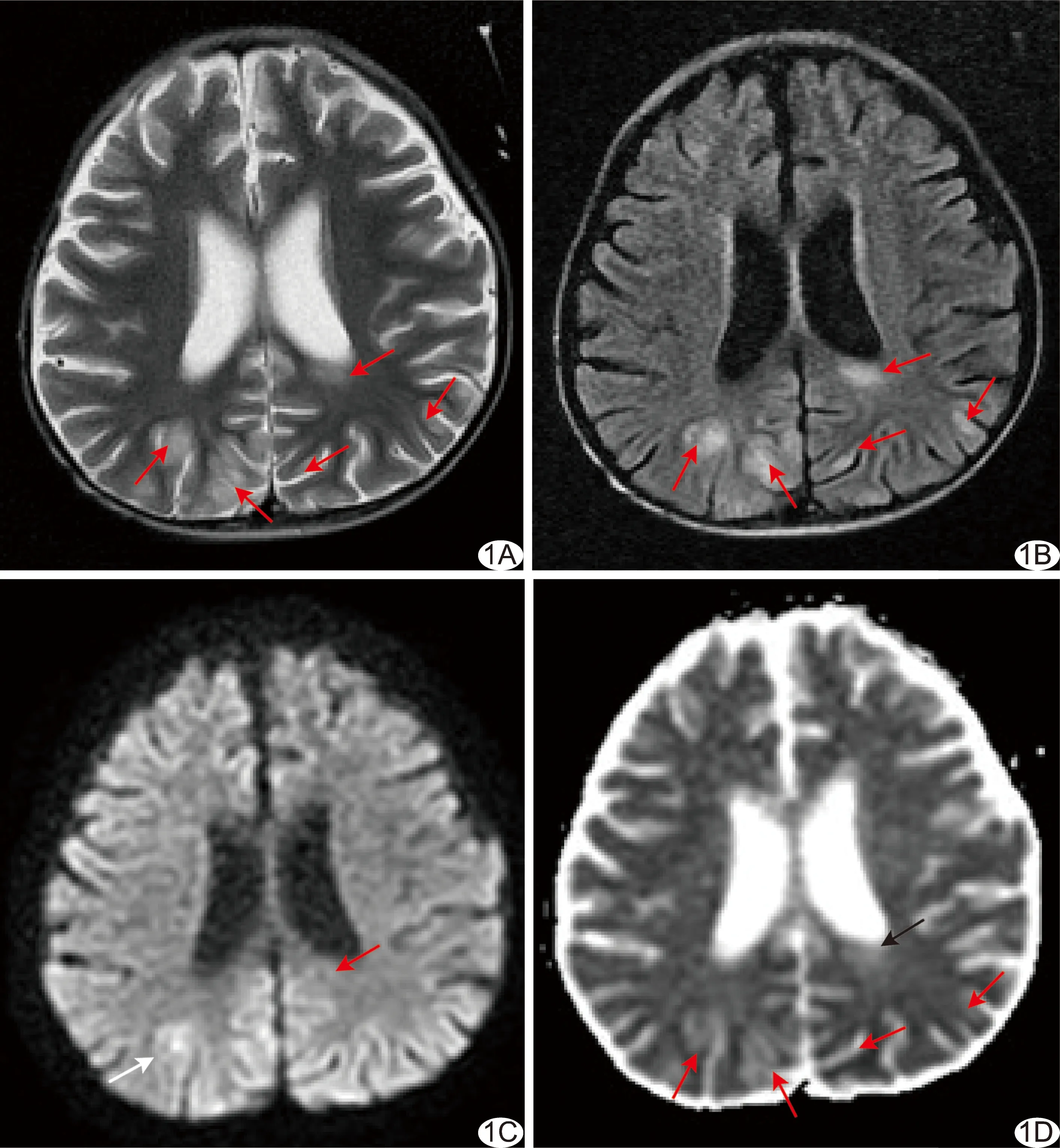
圖1 患兒男,4歲,急性髓細胞性白血病,HSCT后40天,突發抽搐伴血壓升高 A、B.軸位MR T2WI(A)及T2 FLAIR(B)圖像示雙側頂枕葉皮質、皮質下白質及左側腦室旁深部白質內高信號(紅箭); C.軸位DWI圖示右側皮質下病灶局部呈稍高信號(白箭)、深部白質病灶呈等信號(紅箭); D.軸位ADC圖示全部病灶呈高信號(箭)
經降壓藥物和/或減量、甚至停用環孢素A(cyclosporin A, CsA)/他克莫司后,23例癥狀均明顯緩解。間隔10~75天(中位時間26天)對9例行MR復查,其中5例病變完全消失(圖2B);4例好轉(圖3B),原皮質、皮質下白質及深部白質異常信號均已消失,僅丘腦及基底節仍殘存部分異常信號。
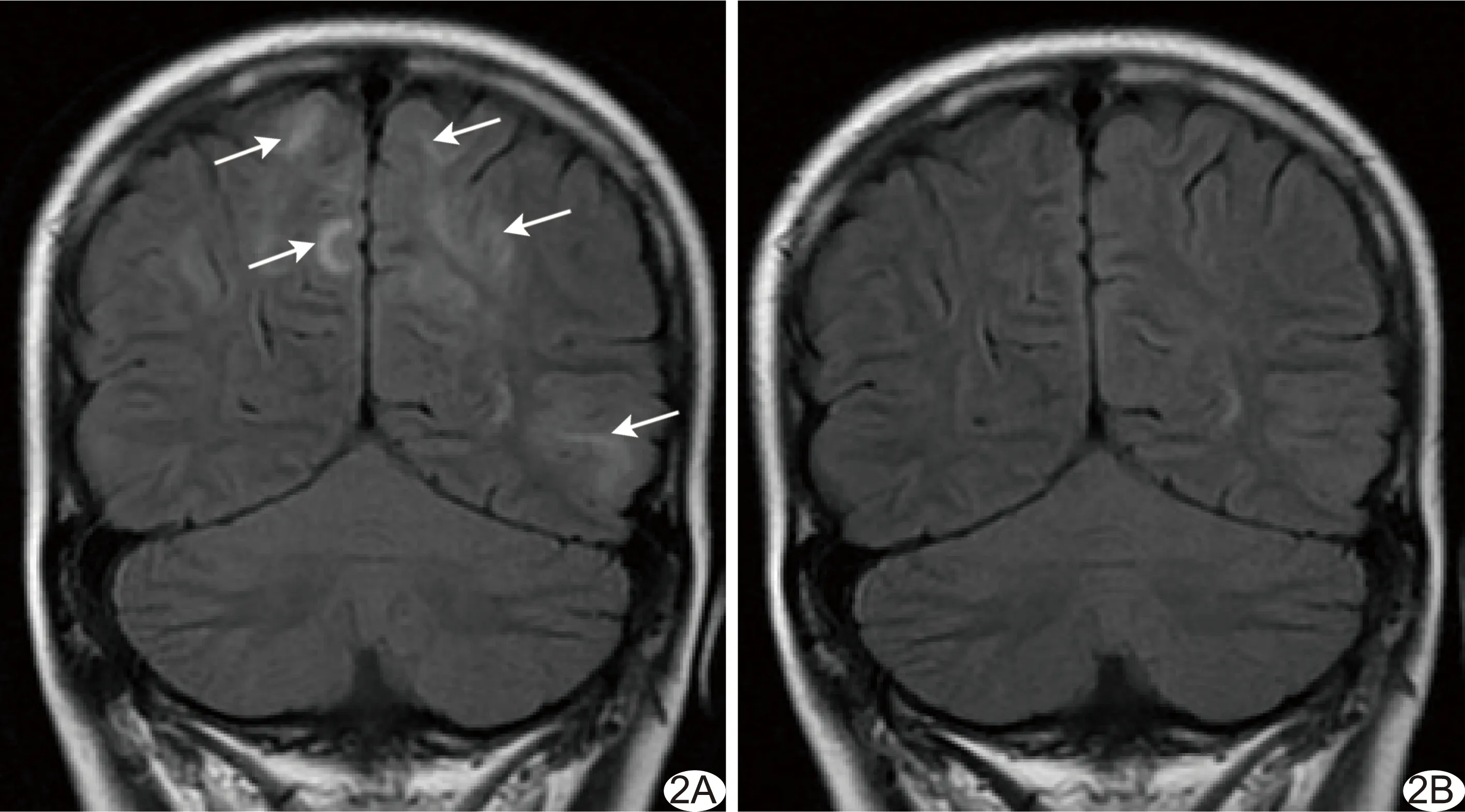
圖2 患兒男,12歲,急性淋巴細胞白血病,HSCT后60天,出現頭暈、頭痛,突發抽搐 A.冠狀位T2 FLAIR圖示雙側頂枕葉皮質、皮質下白質高信號(箭); B.10天后復查,前述病灶消失
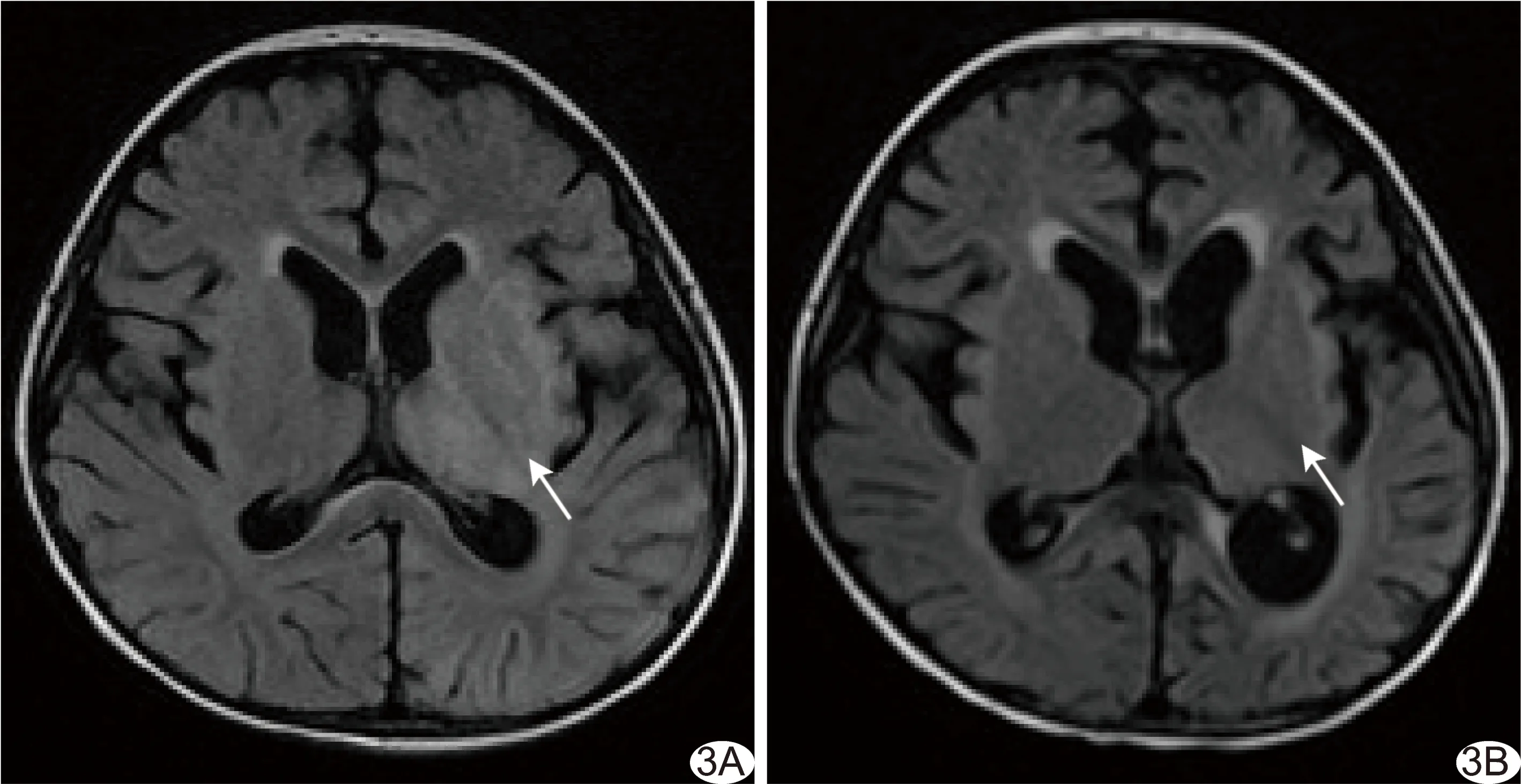
圖3 女性患兒,3歲,再生障礙性貧血,HSCT后22天,出現神志淡漠伴抽搐 A.T2 FLAIR圖示左側基底節及背側丘腦片狀高信號(箭); B.15天后復查,病灶信號強度較前減低(箭),但仍高于對側
3 討論
PRES又稱可逆性后部白質腦病綜合征(reversible posterior leukoencephalopathy syndrome, RPLS),是HSCT術后少見并發癥,其發病率約為1.1%~22%,在既往不同研究[3-5]中差異較大。CHEN等[6]研究結果顯示,造血干細胞移植術后,兒童PRES發病率略高于成人(2.18% vs 0.81%)。本研究自1 027例接受allo-HSCT患兒中檢出23例PRES,均未合并其他神經功能障礙疾病,且多數(19/23,82.61%)于HSCT術后90天內發病,PRES發病率為1.91%(23/1 207)。PRES臨床癥狀缺乏特異性,抽搐為其最常見中樞神經系統癥狀,可見于90%以上患兒[7]。本組23例均出現不同程度抽搐,其他癥狀包括精神狀態的改變、頭痛及視物模糊等。
HSCT術后發生PRES可能與高血壓相關,血壓持續升高超過腦血管自動調節限度,使血腦屏障受到破壞,進而出現血管源性水腫[8]。SANDOO等[9]認為細胞毒性藥物及免疫抑制劑損傷血管內皮,導致血管舒張力降低和全身血管收縮,繼而出現血流灌注減低,引發細胞毒性水腫;這可進一步解釋PRES好發于供血分水嶺區的原因。CsA及他克莫司均為鈣調神經磷酸酶抑制劑(calcineurin inhibitor, CNI),是allo-HSCT術后預防急性移植物抗宿主病(graft-versus-host disease, GVHD)最常用的免疫抑制劑,具有較強神經毒性;而高血壓是CNI常見的不良反應。CsA神經毒性發生率約4.6%~11%,引起高血壓的發生率約37%[10]。此外,交感神經在椎基底動脈分布較少,后循環區域對突發高血壓的調節能力較弱,可能是高血壓所致PRES好發于腦后部的原因。本組病例均有服用CsA或他克莫司藥物史,且9例出現急性高血壓,提示神經毒性損傷與高血壓共同成為PRES的發病基礎。HAMMERSTROM等[5]認為并發PRES與CNI血清水平無明顯相關,治療濃度內亦可發生。對于移植后出現神經系統癥狀患兒,即便CNI在治療濃度內,也應警惕PRES,及時進行MR檢查,以便早期明確診斷。
MRI是診斷PRES的主要手段。PRES多累及大腦半球后部白質區,尤其是雙側頂枕葉[11]。近年關于PRES病例的報道逐漸增多,現已發現病變范圍并不局限于腦“后部”,還可發生于額葉、顳葉、基底節、丘腦、小腦或腦干等非典型部位,甚至可呈彌漫性累及大腦[11],故而稱其為“可逆性腦病”或更恰當,影像科醫生需注意勿被其名稱所誤導。目前PRES累及非典型部位的病因尚不明確,可能與應用細胞毒性藥物有關。兒童PRES影像學表現與成人相似,但不典型部位受累在兒童較成人更為常見,彌散受限和病灶強化亦屬其不典型表現[12]。本組23例PRES均表現為頂枕葉皮質下白質不同程度受累,伴或不伴鄰近皮質受累,符合PRES典型表現,同時累及的非典型部位包括額顳葉、丘腦、胼胝體、基底節和小腦,未見腦干受累征象;頂枕葉以雙側對稱性受累為主(21/23,91.30%),非典型部位則以單側受累為主,或雙側受累、單側為著。
PRES典型病理改變為血管源性水腫,MR T1WI呈等或低信號,T2WI和FLAIR圖像呈高信號,DWI呈等或稍高信號,ADC圖呈高信號。伴隨病情進展,PRES可并發細胞毒性水腫,表現為DWI高信號、ADC圖呈低信號。受T2效應影響,DWI圖像中可能出現假陽性表現,導致PRES的DWI信號較為復雜。本組14例DWI序列可見不同程度高信號,但ADC圖中病變信號存在差異:皮質、皮質下及深部白質區病變在ADC圖中呈稍高或等信號,提示其病理改變為血管源性水腫,隨訪顯示預后良好;而丘腦、基底節及小腦病變在ADC圖中呈稍低信號,提示存在細胞毒性水腫,隨訪顯示上述區域恢復延遲,符合細胞毒性水腫轉歸。以上結果提示,DWI與ADC相結合,對診斷PRES、鑒別水腫性質及判斷預后具有重要意義。此外,在彌漫血管源性水腫背景下,局部并發細胞毒性水腫區域可在ADC圖中表現為等信號,需注意鑒別[13]。
顱內出血是PRES常見并發癥,在兒童患者中的發病率約為8%~28%[2,6,14],多為點狀出血,蛛網膜下腔出血及腦實質出血少見。本組23例未見明確出血表現,可能與MR檢查與臨床出現癥狀間隔時間較短、病情相對較輕有關。FUGATE等[7]報道,PRES患兒CT血管造影或MR血管成像可見血管形態不規則、管徑不均勻,與血管收縮有關。
目前針對治療PRES尚無規范指南,基本方法包括嚴格控制血壓、減少或停止使用CNI以及控制或預防癲癇。本病整體預后良好,在及時給予干預治療的前提下,通常數日或數周內臨床癥狀即可完全恢復,平均4.8天臨床癥狀消失[15]。本組9例隨訪MRI顯示5例病灶全部消失,4例僅丘腦及基底節仍殘存部分異常信號。文獻報道約在治療干預后15天(中位時間),MRI可見PRES病變完全消失[16]。由于本組僅9例接受MR隨訪,且時間間隔差別較大(10~75天,中位時間26天),未能準確評估影像學恢復所需時間,亦未能知曉其最終結局。
本病應與移植后其他并發癥相鑒別。①顱內感染:可見于移植后各期,以真菌感染為主,多累及灰白質交界區,呈結節狀異常信號伴周圍水腫,增強掃描可見環狀強化;②GVHD:中位發病時間為移植后10個月,以累及白質為主,呈大片狀或團片狀異常信號,部分可見“核心-暈環”征象;③淋巴細胞增殖性疾病:與感染EB病毒有關,多累及皮質下白質和側腦室周圍白質,常見出血、壞死,信號多不均勻,增強掃描呈環形強化[1,4,17]。
總之,對于HSCT術后患兒,在CNI治療期間,無論伴或不伴高血壓,如突發神經系統癥狀、尤其是抽搐時,需警惕PRES可能,盡早行頭顱MR檢查。PRES累及范圍及MRI表現具有特征性,綜合分析DWI與ADC信號特點,可輔助臨床及時診斷、積極干預,對改善患兒預后具有重要意義。

