多模態影像組學預測腫塊型乳腺癌術前淋巴結轉移的價值
王祥芝,張書海,徐 敏,湯曉敏,劉 浩,謝宗玉
乳腺癌現已成為女性最常見的惡性腫瘤,且發病率在逐年上升,嚴重威脅到女性生命健康[1]。淋巴結轉移是乳腺癌常見的轉移途徑,腋窩淋巴結是最常見的轉移位置[2],術前準確評估腋窩淋巴結狀態對于乳腺癌的分期、術式的選擇、預后的判斷及放化療的制定均具有重要的意義。鉬靶和MRI是術前乳腺癌分期及淋巴結轉移與否的主要影像學評估手段,然而僅根據淋巴結的大小及形態肉眼很難準確評估。影像組學可以深度挖掘影像信息,高通量地提取大量影像特征,實現病灶的分割、特征提取與模型建立,對疾病做出分析和預測,從而輔助醫生做出最準確的診斷[3-4]。本研究探討基于鉬靶、MRI的多模態影像組學在腫塊型乳腺癌術前淋巴結轉移預測方面的價值。
1 資料與方法
1.1 一般資料 收集2018年11月至2020年5月就診于我院同時行鉬靶和MRI 2種檢查的病人,入組標準:(1)所有病人檢查前均未經放化療或手術;(2)所有病人有病理結果(明確分期和淋巴結轉移情況);(3)所有病人2種影像資料完整且圖像質量符合要求。排除標準:(1)非腫塊型乳腺癌(n=5);(2)圖像質量欠佳(n=3);(3)病灶過小,無法勾畫感興趣區(n=2)。最終納入111例符合要求的病人(共114個病灶);均為女性,年齡27~68歲;48例淋巴結陽性(LN+),63例淋巴結陰性(LN-)。
1.2 儀器與方法
1.2.1 鉬靶檢查 鉬靶采用德國Siemens Mammomat Inspiration乳腺X線機,行雙體位自動曝光裝置投照:頭尾位(craniocaudal,CC)和內外斜位(mediolateral oblique,MLO)。
1.2.2 MRI檢查 采用荷蘭Philips Achieva 3.0T雙梯度超導磁共振儀,線圈為SENSE7通道矩陣線圈,常規行橫斷位T1WI(TR 400 ms,TE 10 ms)和抑脂T2WI(TR 5 000 ms,TE 60 ms),MRI動態增強掃描(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI),造影劑為釓噴酸葡胺,劑量0.2 mmol/kg,速率2.0 mL/s,注射對比劑后連續掃描6期,每期60 s。
1.3 圖像分割與特征提取 將所有病人的圖像(CC、MLO、T2WI、DCE-MRI)導入醫準-達爾文科研平臺(http://www.yizhun-ai.com),CC、MLO及T2WI選取病灶最大徑進行勾畫,DCE-MRI選取第二期進行勾畫(見圖1~2)。每一個序列均提取出939個特征,包括一階統計特征、形態特征、紋理特征及小波特征,共3 756個組學特征。

1.4 特征選擇、模型建構與評估 提取出的組學特征采取最小最大值歸一化法把每一維度特征線性拉伸到(0,1)之間。為了去除大量冗余特征,保留穩定性及可重復性高的特征,我們選擇Select K Best篩選特征。該方法是利用方差分析首先篩選出前50個特征,然后利用最小絕對收縮與選擇算子(LASSO)回歸進一步篩選特征,保留相關度最高的特征。對篩選出的特征分別采用logistic回歸、隨機森林及支持向量機(support-vector machine,SVM)3種模型建立鉬靶、MRI、鉬靶聯合MRI多模態影像組學模型,采用受試者工作特征曲線下面積(AUC)評價訓練組與驗證組模型的預測效能。

1.5 統計學方法 采用t檢驗和χ2檢驗。
2 結果
2.1 各組臨床資料比較 LN+組的病灶長徑明顯大于LN-組(P<0.01),2組在年齡、絕經狀態、病理分級方面差異均無統計學意義(P>0.05)(見表1);訓練組與驗證組所有臨床資料間差異均無統計學意義(P>0.05)(見表2)。
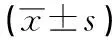
表1 LN+組與LN-組臨床資料比較
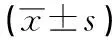
表2 訓練組與驗證組臨床資料比較
2.2 預測模型特征篩選與模型評價 應用最小最大值歸一化、Select K Best及LASSO回歸篩選后,最終保留8個組學特征(見圖3)。運用logistic回歸、隨機森林及SVM建立鉬靶、MRI、鉬靶聯合MRI的多模態影像組學模型后,發現SVM性能最佳、最穩定。SVM建立的訓練組鉬靶、MRI、鉬靶聯合MRI的多模態影像組學模型預測淋巴結轉移的AUC值分別為:0.76、0.82、0.89;驗證組相應的AUC值為:0.74、0.81、0.88(見圖4)。鉬靶聯合MRI的多模態影像組學模型表現出最佳診斷效能。

3 討論
術前準確預測乳腺癌病人的淋巴結狀態對病人手術計劃的實施、輔助治療和預后至關重要。最初通過腋窩淋巴結清掃判斷乳腺癌病人是否存在淋巴結轉移,這容易造成病人上肢腫脹、疼痛及無力,給淋巴結轉移陰性的病人增加不必要的負擔[5]。前哨淋巴結活檢可以較準確地判斷淋巴結狀態,但是也存在一定假陰性[6-7],有時活檢的前哨淋巴結是唯一的轉移淋巴結。因此,在乳腺癌病人術前找到一種可以準確評估淋巴結狀態的方法是至關重要的。相關文獻單純基于原發腫瘤的臨床病理特征建立預測淋巴結轉移的模型[8-9],例如:年齡、病灶大小、病灶組織學類型、激素受體等,效能欠佳。本研究發現LN+組病灶大小大于LN-組,表明原發腫瘤的大小與腋窩淋巴結存在一定相關性,與前者[10]研究一致。影像組學是一個相對較新的技術,它能夠捕獲腫瘤微環境的異質性和復雜性,挖掘出視覺無法識別的潛在數據[11]。例如本研究保留的8個最優組學特征中,一階特征(firstorder)代表圖像體素強度的分布情況,其中能量、總能量特征在鑒別淋巴結轉移方面代表性強;灰度共生矩陣(glcm)、灰度相關矩陣(gldm)和灰度區域大小矩陣(glszm)均屬于紋理特征,而紋理特征主要描述圖像灰度的相關空間特性或體素強度的空間分布,從而提供圖像中不同灰度級的相對位置信息;目前glcm應用最為廣泛,主要描述圖像灰度值的空間依賴性[12-13]。以上組學特征都是人類無法感知的,但很容易被影像組學識別,并且能夠反映腫瘤的生物學行為。
影像組學在直腸癌、胃癌、乳腺癌等疾病的診斷及判斷淋巴結轉移方面具有可行性[14-16]。譚紅娜等[17]采用LASSO回歸建立基于鉬靶雙體位的組學預測淋巴結轉移模型,在訓練組及驗證組下的AUC分別為0.757、0.740,效能中等。然而YANG等[18]采用SVM建立的鉬靶影像組學預測淋巴結轉移模型,在訓練組和驗證組中AUC分別為0.895、0.875,效能較好,原因可能是分類器的差異或該模型結合臨床病理和超聲淋巴結狀態的特征。相關文章基于DCE-MRI預測乳腺癌前哨淋巴結轉移的訓練組AUC介于0.81~0.87,驗證組AUC介于0.76~0.83[19-21]。單嫣娜等[22]基于DCE-MRI分割可疑淋巴結的影像組學預測模型獲得優異的效能,在訓練組及驗證組中AUC分別為0.953、0.944,但是此方法需要超聲引導下穿刺相應可疑淋巴結,過程較繁瑣,而且本研究納入的部分鉬靶圖像無法顯示淋巴結,因此沒采用此方法。本研究與此前僅基于單一影像學方法建立的預測模型不同,是基于鉬靶聯合MRI的多模態影像組學方法。MRI可以提供高時間、高空間分辨率和高信噪比的圖像,其中DCE-MRI又可以反映病灶血流動力學;雖然鉬靶為二維重疊圖像,提取的腫瘤組學特征中可能包括正常腺體組織,但是鉬靶對診斷乳腺癌特異性的微鈣化[23]卻能夠清晰顯示其分布、密度、形態,在這一方面是其他檢查無法代替的。所以本研究聯合鉬靶和MRI,綜合腫瘤細胞結構、內部密度、血供情況等各個方面,全面提取每種影像方法的組學特征,以期準確預測淋巴結狀態。最終采用SVM建立的聯合模型在訓練組與驗證組的AUC值分別為0.89、0.88,效能優異,這表明聯合影像組學模型可以較準確地預測腋窩淋巴結狀態,給予臨床提供一種潛在的非侵入性預測方法,并且指導乳腺癌的治療。
本研究尚存在些許的不足:(1)因為非腫塊樣強化的病變難以準確勾畫,所以本研究僅納入腫塊型病變,可能存在數據偏倚。(2)為使數據具有可比性,MRI提取的是類似鉬靶的二維圖像,可能會造成MRI三維圖像空間信息的缺失。(3)所納入總樣本量較小,且數據局限,缺少對結果的可重復性和泛化性的評價,需要多中心大數據的支持與研究。
綜上所述,基于鉬靶聯合MRI的多模態影像組學模型是一種無創的可以預測腫塊型乳腺癌病人腋窩淋巴結狀態的新方法,指導臨床制定針對腫塊型乳腺癌病人的最佳治療方案,向精準醫療邁進。

