腹膜后腺泡狀軟組織肉瘤肺轉移1例
劉國雄,徐曉峰,吳開杰,張 杰,董衛兵,3,喬西民,賀大林,李 楠
(1.咸陽市中心醫院泌尿外科,陜西咸陽 712000;2.西安交通大學第一附屬醫院泌尿外科,陜西西安 710061;3.咸陽市中心醫院病理科,陜西咸陽 712000)
腺泡狀軟組織肉瘤(alveolar soft part sarcoma,ASPS)發病率占所有軟組織肉瘤的0.5%~1%[1],多發于四肢尤其是右側下肢[2]。對于嬰幼兒和兒童來說,頭頸部區域最易受累,以往報道中41%發生在眼眶部,25%在口腔[3]。陜西省咸陽市中心醫院泌尿外科收治了1例發生在后腹腔的ASPS,發生部位罕見,現報告如下。
1 病例報告
患者女性,30歲,因“左側腰部疼痛7 h”入院,疼痛呈陣發性,臥床休息緩解,行走則加劇,伴有惡心、嘔吐。查體左側腹部可捫及1個約15 cm×10 cm×8 cm的包塊,質地硬、表面光滑、活動度差。入院后查全腹部計算機斷層掃描(computed tomography,CT)提示:左側腹腔巨大混雜密度軟組織腫塊,考慮惡性腫瘤;增強CT掃描及三維重建提示(圖1A~B):腹膜后神經源性腫瘤:①神經鞘瘤;②異位副節瘤待排;③節神經細胞瘤待排。查胸部CT平掃提示(圖1C):肺窗示左肺及右肺中下葉多處可見大小不等類圓形小結節狀高密度影,較大者徑線0.4 cm。顱腦CT平掃未見特殊異常。行腫瘤擴大范圍切除術,術后大體標本剖開(圖2A),可見腫瘤內部出血壞死,有脂肪組織浸潤生長,符合肉瘤樣病變。術后行HE染色及免疫組化抗體染色(圖2B、D~F),低倍鏡下提示組織呈特征性腺泡狀改變,腫瘤細胞被纖維間隔分成多結節狀;高倍鏡下腫瘤細胞形態大小較均一,呈多邊形或圓形,細胞嗜酸性,核仁明顯但核分裂不明顯。免疫組化結果提示:TFE-3(+)、Ki-67(約10%+)、CD99(灶+)、INI1(+)、PanCK(-)、Vimentin(-)、Pax-8(-)、CD56(-)、Syn(-)、CgA(-)、EMA(-)、S-100(-)、SMA(-)、MyoD1(-)、HMB45(-)、SOX-10(-)。FISH檢測(TFE3分離探針)顯示腫瘤細胞染色體TFE3存在易位(圖2C)。患者術后病情平穩,診斷為腹膜后ASPS,出院后按照醫囑接受診治。
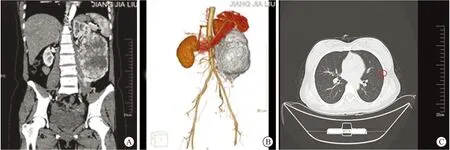
A:腹部CT增強掃描;B:腹部腫瘤染色三維重建圖;C:肺部CT平掃圖(紅色圓圈內為病灶,直徑大小約4 mm)。圖1 患者的術前影像學資料
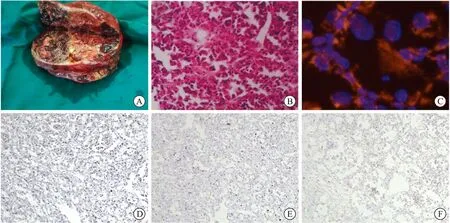
A:腫瘤切除術后大體標本剖面圖;B:腫瘤術后HE染色圖(×400);C:FISH檢測提示腫瘤細胞染色體TFE-3存在易位(×400);D~F:免疫組化染色TFE3、Ki-67、CD99呈陽性(×100)。圖2 腹膜后ASPS患者腫瘤的大體標本、組織染色及免疫組化圖
2 討 論
CHRISTOPHERSON等[4]在1952年進行了ASPS的系列報道,ASPS好發于青少年和青年,發病高峰年齡為15~30或15~35歲,發病率與性別無關,亦有報道顯示女性多發[5-7]。ASPS組織來源尚不明了,有上皮源性、神經源性以及肌源性學說,其中前兩種觀點基本被否定,支持肌源性來源之觀點更多一些,但仍然沒有最終定論。其診斷主要依靠術后活組織病理結果,免疫組化及TFE3基因檢測。本例采用熒光原位雜交法對ASPL-TFE3基因融合探針檢測提示陽性,可進一步輔助明確診斷。
目前來看,ASPS主要的治療方法是手術治療,包括原發病灶、復發病灶及轉移病灶的切除及擴大切除。大部分文獻報道顯示輔助放療和化療效果不理想[8]。然而隨著靶向作用于血管內皮生長因子的酪氨酸激酶抑制劑藥物的研發,如舒尼替尼、西地尼布、帕唑帕尼以及克唑替尼等藥物的使用[9],患者總體生存期可有明顯的延長,但目前這些藥物大都處于臨床試驗初期招募階段。
ASPS屬于罕見病例,發生在后腹腔部位更為少見,其腫瘤惰性及生長隱匿性使得大部分患者在就診時就已經有遠處轉移,其診斷主要依靠術后病理、免疫組化染色及TFE-3分離探針檢測。大部分患者預后較差,需要積極進行術后進一步干預治療及長期隨訪,有條件的患者可以選用對腫瘤敏感的血管靶向藥物治療,如西地尼布等。如有術后局部復發或遠處轉移患者,視情況而定,可行局部擴大切除術及轉移灶切除手術。

