曲唑酮治療阿爾茨海默病伴睡眠障礙患者的療效及對患者認知功能的影響*
何衛亮,徐哲,潘新根,楊守開,那萬秋,陳浙麗
(湖州市第三人民醫院精神科,浙江湖州313000)
流行病學調查顯示,約60%老年人存在不同程度的睡眠障礙[1]。睡眠障礙同時是阿爾茨海默病(Alzheimer's disease,AD)重要的臨床表現,頑固的失眠可以導致神經內分泌水平改變,從而加速AD患者中樞神經退行性改變[2]。對于AD 伴睡眠障礙患者,臨床多采用非典型抗精神病藥聯合苯二氮卓類方案治療,其能夠在減輕精神行為病理損傷的同時發揮抗焦慮、鎮靜及催眠作用,但療效個體差異較大,且易復發[3]。曲唑酮目前已被用于抑郁癥等多種精神系統疾病合并睡眠障礙的治療,對改善其睡眠具有良好效果,但曲唑酮與其他藥物聯合用于AD 伴睡眠障礙治療的系統性評價較少。本研究旨在探討曲唑酮聯合多奈哌齊治療AD伴睡眠障礙患者的睡眠改善效果、對患者認知水平、日常生活能力及海馬體積的影響及安全性,現報道如下。
1 資料與方法
1.1 臨床資料
選取2018年10月—2019年10月在湖州市第三人民醫院就診的AD 伴隨睡眠障礙患者70 例作為研究對象。將70 例患者隨機分為觀察組(口服多奈哌齊+曲唑酮) 和對照組(口服多奈哌齊+唑吡坦),每組35 例。患者及家屬同意加入本研究并簽署知情同意書。
1.2 納入與排除標準
1.2.1 納入標準①符合《精神疾病診斷與統計手冊》第4 版及美國國立神經病、語言功能障礙和國立卒中研究所老年性癡呆及相關疾病學會對“可能AD”的標準[4];②符合中國精神障礙分類與診斷標準第3 版失眠癥診斷標準[5];③年齡≥65 歲。
1.2.2 排除標準①重度認知功能損害的AD 患者[ 簡易精神狀態檢查(mini-mental state examination,MMSE)量表評分<9 分或臨床癡呆評定量表評分為3 分];②經顱腦CT 或MRI 證實合并腦卒中等各種原因引起的繼發性癡呆及顱內占位者;③阿爾茨海默病行為病理評定量表評定存在重度抑郁、焦慮、幻覺等晝夜節律紊亂以外的其他精神行為異常者;④對研究藥物過敏者;⑤合并心、肺、肝、腎等重要臟器嚴重功能損害者;⑥臨床資料不齊者;⑦依從性差而未參加所有治療及評估者。
1.3 方法
對照組采用口服多奈哌齊+唑吡坦進行治療。多奈哌齊(貴州圣濟堂制藥有限公司,商品名:諾沖,國藥準字H20040751,規格:5 mg/片)5~10 mg/次,1 次/d,每晚睡前口服。唑吡坦(酒石酸唑吡坦片,商品名:思諾思,國藥準字H20044989,杭州賽諾菲制藥有限公司,規格:10 mg/片)10 mg/次,1 次/d,每晚睡前口服。觀察組采用口服多奈哌齊+曲唑酮進行治療。多奈哌齊劑量及用法同對照組,曲唑酮(商品名:美時玉,注冊證號HC20160001,美時化學制藥股份有限公司南投廠,規格:50 mg/片)50 mg/次,1 次/d,每晚睡前口服。合并有高血壓、糖尿病等基礎疾病的AD 患者常規給予降壓、降糖等對癥治療。兩組連續治療4 周。
1.4 觀察指標
1.4.1MRI 數據處理及海馬體積計算治療前及治療4 周后采用MRI 掃描患者腦部。檢查前患者靜坐30 min,囑咐患者檢查過程中保持平靜,用泡沫墊固定頭部、避免頭部移動影響檢查質量。采用GE 1.5 T 高場強磁共振進行常規頭顱MRI 及垂直于海馬長軸的斜冠狀位掃描,以白質前聯合為前界,以白質后聯合為后界,海馬以鉤隱窩作為第一個層面,以穹窿作為最后一個層面。將MRI 原始圖像數據(DICOM 圖像)轉化為.mgz 文件格式后,采用美國MIT Health Sciences&Technology 和Massachusetts General Hospital 共同開發的MRI 數據處理軟件FreeSurfer 7.0.0 (http://surfer.nmr.mgh.harvard.edu)對海馬進行立體定位,通過將體素與海馬解剖結構進行非線性配準后計算體積[3-4]。
1.4.2 多導睡眠圖(Polysomnogram,PSG)采用PSG 評估患者睡眠情況。在治療開始前1 天及治療結束后第2 天的22∶00 至次日07∶00,于醫院睡眠監測室中接受PSG 監測。監測儀器采用采用多導睡眠記錄儀(澳大利亞Compumedics 公司,型號:ESeries)。通過監測系統觀察并記錄以下參數:總睡眠時間、睡眠潛伏期、覺醒次數、睡眠效率(總睡眠時間占總臥床時間的百分比)。
1.4.3 認知水平采用MMSE、MoCa 量表評估患者認知水平。
1.4.4 生活能力采用日常生活活動(activities of daily living,ADL)量表評估患者生活能力。
1.4.5 不良反應治療前及治療后1 周、2 周、4 周測定血壓、脈搏及血常規、尿常規、肝功能,行心電圖檢查。采用治療伴發癥狀量表評定治療不良反應。
1.4.6 療效評價采用匹茲堡睡眠質量指數(pittsburgh sleep quality index,PSQI)量表評估睡眠質量。量表內容主要包括:入睡時間、睡眠時間、睡眠障礙、睡眠效率、睡眠質量等19 個自評及5 個他評項目組成,總分0~21 分,分數越高代表睡眠質量越差。參考以下標準對患者睡眠障礙的療效進行評價:PSQI 評分較基線水平降低≥50%為顯效;PSQI 評分較基線水平降低25%~<50%為有效;PSQI 評分較基線水平降低<25%為無效。所有量表評估及MRI 測量均由2 位培訓合格、經驗豐富的精神科或影像科醫生進行,不同醫生之間進行一致性評價,通過標準為κ =0.81。臨床評價醫生對AD患者分組情況均不了解。
1.5 統計學方法
數據分析采用SPSS 22.0 統計軟件。計量資料以均數±標準差(±s)表示,比較用t檢驗;計數資料以率(%)表示,比較用χ2檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 兩組患者基線資料比較
兩組患者性別構成、年齡、受教育時間、基礎疾病(高血壓、血脂異常、糖尿病、冠狀動脈疾病)、吸煙史、飲酒史及認知水平[MMSE、蒙特利爾認知評估(Montreal cognitive assessment,MoCA)量表評分]比較,差異無統計學意義(P>0.05),具有可比性。見表1。
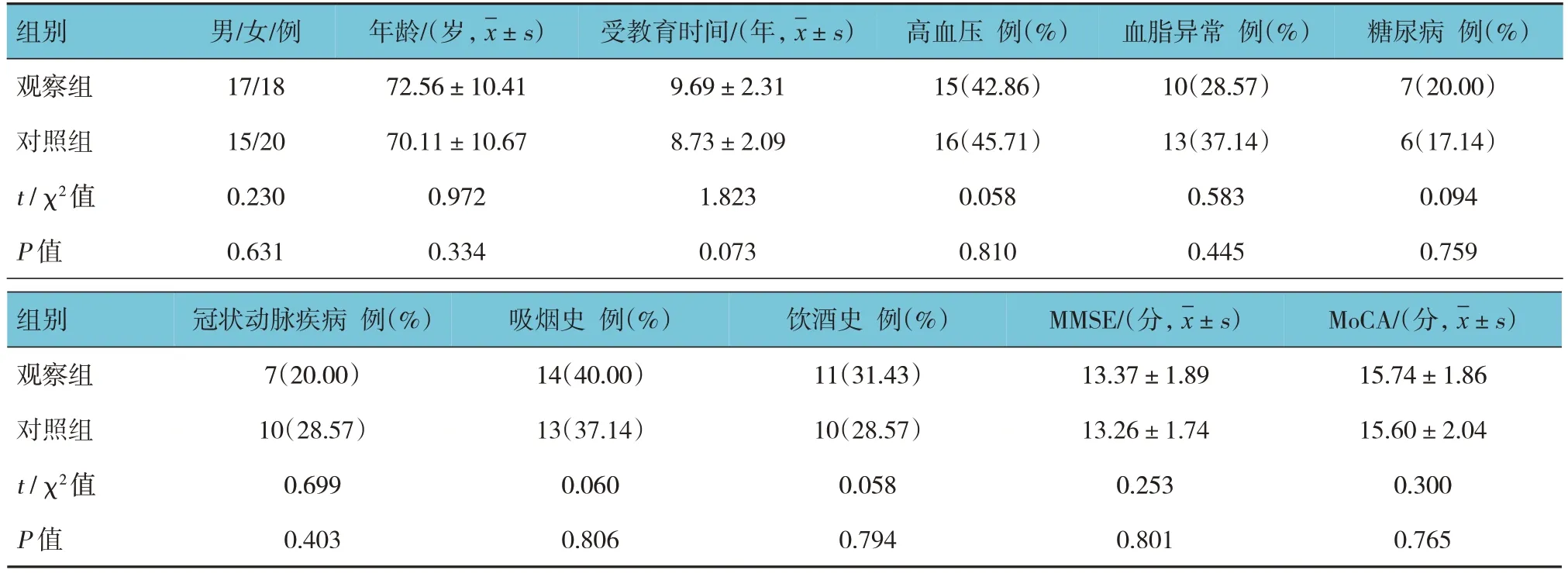
表1 兩組患者基線資料比較 (n=35)
2.2 兩組患者治療前后PSG結果的變化
觀察組與對照組患者治療前后總睡眠時間、睡眠潛伏期、覺醒次數、睡眠效率的差值比較,經t檢驗,差異有統計學意義(P<0.05),觀察組總睡眠時間及睡眠效率提高的水平高于對照組,睡眠潛伏期、覺醒次數降低的水平高于對照組。見表2。
表2 兩組患者治療前后PSG的差值比較 (n=35,±s)

表2 兩組患者治療前后PSG的差值比較 (n=35,±s)
組別觀察組對照組t 值P 值總睡眠時間/min 66.12±21.40 31.20±19.44 7.146 0.000睡眠潛伏期/min-20.09±5.72-8.31±4.13 9.878 0.000覺醒次數-1.59±0.35-0.86±0.36 8.601 0.000睡眠效率/%13.72±4.40 6.08±3.87 7.713 0.000
2.3 兩組患者治療前后海馬體積的變化
觀察組與對照組患者治療前后左海馬頭部體積的差值比較,經t檢驗,差異有統計學意義(P<0.05),觀察組大于對照組。兩組患者治療前后左側海馬體部、尾部及右側海馬頭部、體部、尾部體積的差值比較,差異無統計學意義(P>0.05)。見表3。
表3 兩組患者治療前后海馬各區體積的差值比較 (n=35,mm3,±s)

表3 兩組患者治療前后海馬各區體積的差值比較 (n=35,mm3,±s)
組別觀察組對照組t 值P 值左海馬頭部-115.00±95.21-234.90±102.25 5.077 0.000左海馬體部-172.62±93.24-205.75±90.49 1.508 0.136左海馬尾部-41.09±49.66-52.05±50.70 0.914 0.364右海馬頭部-36.00±101.84-47.90±110.34 0.469 0.641右海馬體部-27.79±90.25-34.57±94.59 0.307 0.760右海馬尾部-28.99±56.70-38.59±51.47 0.742 0.461
2.4 兩組患者治療前后認知水平及生活能力的變化
觀察組與對照組患者治療前后認知水平(MMSE、MoCA)及生活能力(ADL)的差值比較,經t檢驗,差異有統計學意義(P<0.05),觀察組治療前后MMSE、MoCA 及ADL 評分的差值大于對照組。見表4。
表4 兩組患者治療前后MMSE、MoCA及ADL評分的差值比較 (n=35,±s)
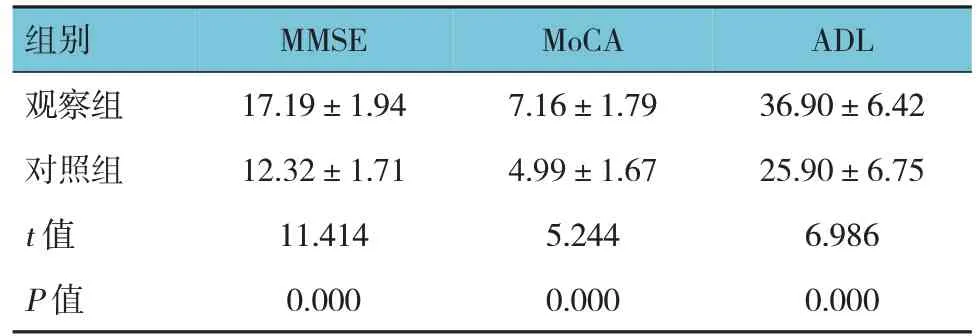
表4 兩組患者治療前后MMSE、MoCA及ADL評分的差值比較 (n=35,±s)
組別觀察組對照組t 值P 值MMSE 17.19±1.94 12.32±1.71 11.414 0.000 MoCA 7.16±1.79 4.99±1.67 5.244 0.000 ADL 36.90±6.42 25.90±6.75 6.986 0.000
2.5 兩組患者睡眠障礙臨床療效比較
兩組患者睡眠障礙臨床療效比較,經秩和檢驗,差異有統計學意義(P<0.05),觀察組優于對照組。但兩組總有效率比較,經χ2檢驗,差異無統計學意義(P>0.05)。見表5。
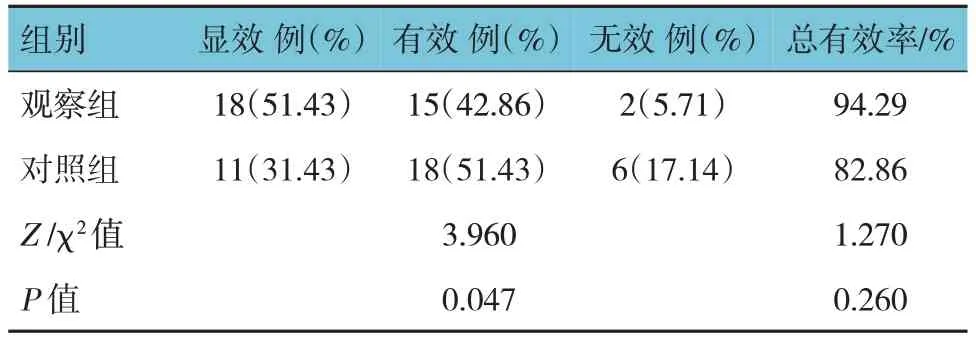
表5 兩組患者睡眠障礙臨床療效比較 (n=35)
2.6 兩組患者不良反應發生率比較
觀察組4 例患者出現疲乏、嗜睡、頭暈、食欲不振等不良反應,對照組8 例患者出現疲乏、嗜睡、頭暈、惡心嘔吐等不良反應。兩組患者不良反應均持續時間短,程度輕,未影響治療。兩組患者不良反應總發生率比較,經χ2檢驗,差異無統計學意義(χ2=1.610,P=0.210)。見表6。

表6 兩組患者不良反應比較[n=35,例(%)]
3 討論
隨著生活水平的改善及生命科學的發展,老年人口不斷增加。睡眠障礙的發生率呈不斷上升的趨勢[6]。老年睡眠障礙的發病與社會角色改變、生活習慣改變等社會因素及衰老、內分泌改變等生理等多種因素相關。有研究表明,睡眠障礙是AD 患者的重要臨床表現之一,睡眠障礙與AD 的發生、發展高度相關[7-8],對患者的社會、認知功能造成進一步損害。因此對AD 患者睡眠障礙進行合理有效的干預具有重要的臨床意義。AD 患者彌散性退行性變可以累及下丘腦前部、視交叉核團、網狀激活系統及松果體等睡眠相關功能區,造成褪黑素分泌降低,引起睡眠障礙。認知能力訓練治療起效慢,且療效尚不確切,臨床治療AD 患者睡眠障礙的藥物如褪黑素受體激動劑、艾司唑侖等苯二氮類藥物及氯硝西泮等鎮靜催眠劑等,需警惕過度鎮靜、影響認知功能等副作用。多奈哌齊是第二代特異的可逆性中樞乙酰膽堿酯酶(acetylcholinest erase,AChE) 抑制劑,通過抑制AChE 活性,使突觸間隙乙酰膽堿(Acetylcholinest,ACh)的分解減慢,從而提高ACh 的含量,臨床廣泛用于AD 的治療。曲唑酮可同時阻斷5-羥色胺2A(5 hydroxytryptamine 2A,5-HT2A)受體、H1 組胺及α1 腎上腺素能受體,是臨床常用的劑量依賴性抗抑郁藥,此外還廣泛用于抗焦慮、鎮靜、改善睡眠及性功能等[9]。
本研究發現,與對照組比較,多奈哌齊聯合曲唑酮可顯著提高AD 伴睡眠障礙患者睡眠時間及睡眠效率,降低睡眠潛伏期及睡眠覺醒次數,同時提高睡眠障礙療效,該結果與既往研究結果一致[10-11]。本研究中,觀察組MMSE、MMCo、ADL 評分顯著高于對照組,提示曲唑酮可輔助改善AD 患者認知功能并提高其日常生活能力。MARNER 等[12]研究表明,皮質的5-HT2A 受體明顯減少是輕度認知損害的一個早期特征,曲唑酮5-HT 受體拮抗劑可增強5-HT 的活性,從而改善正常老齡人群和AD患者的記憶及學習能力。已有研究表明,睡眠對大腦認知功能具有重要影響,睡眠障礙可通過減少大腦休息時間,降低睡眠質量,從而加速AD 患者的神經功能缺損[13]。故曲唑酮可通過改善AD 患者睡眠質量而提高認知功能。部分研究表明,輕度癡呆階段AD 患者海馬體積較健康人群減少[14];但另有部分研究表明,海馬整體體積改變在AD 病變早期的敏感性及特異性欠佳。AD 的病理改變首先發生在CA1、CA3 等含有較多與功能損害相關神經突觸的區域,將海馬分亞區測量可提高體積改變的敏感性[15]。鹽酸多奈哌齊可降低突觸間隙神經遞質ACh 的水解程度,減少β-淀粉樣肽含量及神經纖維纏結,增加海馬區ACh 的含量,減輕海馬炎癥水腫狀態,從而改善雙側海馬頭部MRI T2 信號強度、增加海馬左側CA4-DG 亞區體積[16-17]。本研究結果顯示,治療后兩組患者左側海馬頭部體積較治療前顯著改善,其余亞區體積僅有改善趨勢,該結果與既往研究結果一致[15]。其中觀察組患者治療前后左側海馬頭部亞區體積的差值大于對照組,分析其原因可能與鹽酸曲唑酮逆轉eIF2α-P 介導的體外和體內翻譯衰減,同時上調腦卒后抑郁大鼠海馬腦源性神經營養因子及其受體酪氨酸激酶B 的表達[18],抑制海馬的萎縮有關[19]。本研究中,觀察組4 例患者出現疲乏、嗜睡、頭暈、食欲不振等不良反應,持續時間短,程度輕,未影響治療,提示曲唑酮治療AD 伴睡眠障礙具有較好的安全性。睡前口服50 mg 曲唑酮可增加AD 伴睡眠障礙患者總體夜間睡眠42.5 min,且未發現明顯的不良反應[20]。
本研究尚存在一些不足之處,首先研究納入樣本量不足,致統計學效力較弱,無法避免較大統計學偏倚。其次海馬區體積改變或滯后于物質及能量代謝改變,對體積改變無統計學差異的區域仍需進一步研究其N-乙酰天門冬氨酸、膽堿復合物、肌醇及肌酸等物質代謝波普,以進一步明確藥物對海馬各區代謝影響及其與認知改變的相關性。
綜上所述,曲唑酮聯合多奈哌齊治療AD 伴睡眠障礙可顯著改善患者睡眠質量,提高睡眠障礙療效、認知功能,改善患者左側海馬頭部萎縮,并具有良好的耐受性,值得進一步臨床推廣應用。

