叔胺-CO2對水中氯離子萃取過程研究*
高美娟,趙曉玲,李 艷
(1.榆林職業技術學院,陜西 榆林 719000;2.榆林市計量技術研究院 陜西 榆林 719000)
燃煤電站煙氣脫硫工藝產生含氯廢水超出國家排放標準,循環水中Cl-含量過高會降低煙氣脫硫效率、加速設備腐蝕、對環境負荷較大,通過環保、經濟的工藝分離廢水中的Cl-,使其濃度達到安全排放標準的意義重大。
溶液萃取是一種物理或伴有化學反應的傳質過程,溶劑中常量濃度離子可進行單級(或多級)分離[2]。萃取所需設備簡單、能耗較低,萃取劑通過返萃工藝可循環使用。萃取過程中伴有的化學反應與萃取相互促進,稱為萃取和反應耦合過程。
萃取水中Cl-的常規方式:H2SO4將含氯水相調至酸性,有機胺類萃取劑與水相的H+和Cl-發生絡合反應,Cl-以HCl的形式被萃入有機相,萃取和反應耦合如下[1]:
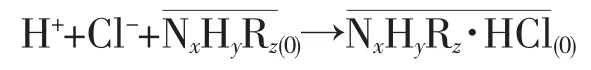
由于H2SO4管控嚴格,水相調酸脫除Cl-的應用受到限制。相關研究發現,CO2的溶解-電離可調節萃取過程水相酸性,經萃取和反應耦合將CO2固定轉化為碳酸鹽,Cl-以HCl形式與有機胺絡合從水相分離,該過程可在一定程度上替代H2SO4的使用,也為CO2的固定減排提供了新的途徑和思路。CO2在有機胺-水相中的固定及Cl-萃取過程較為復雜,涉及到氣相-含Cl-水相-有機相的非均相反應(CO2的溶解速率和電離程度;碳酸鹽在水相中的溶解程度;有機胺萃取飽和程度),故該體系很難用一般的動力學模型進行分析和闡述[3]。
本研究以CO2在萃取體系中的分步吸收及連續穩態傳質為基礎,選用常規非水溶性叔胺萃取體系,利用恒定容積法測定了CO2在萃取體系變壓吸收情況;在CO2最佳吸收狀態下,對叔胺-CO2協同萃取水中Cl-進行實驗,驗證以CO2的溶解調節混合萃取體系酸性的Cl-脫除效果,進而為工業擴大應用提供理論和基礎數據指導。
1 實驗部分
1.1 實驗試劑
三辛胺(LR,≥98%武漢江民華泰醫藥化學有限公司);雙十二胺甲基叔胺、十六烷基二甲基叔胺(LR,≥95%湖北信康醫藥化工有限公司);NaCl、H2SO4,均為分析純,國藥試劑;正己醇、正丁醇、異戊醇,均為分析純,阿拉丁試劑;CO2-N2混合氣體(VCO2=50%,黎明氣體有限公司)。
1.2 實驗裝置與方法
由于CO2吸收過程中,反應釜體積不變,可采用恒定容積法測定CO2在有機相-水相的溶解情況,裝置示意見圖1。
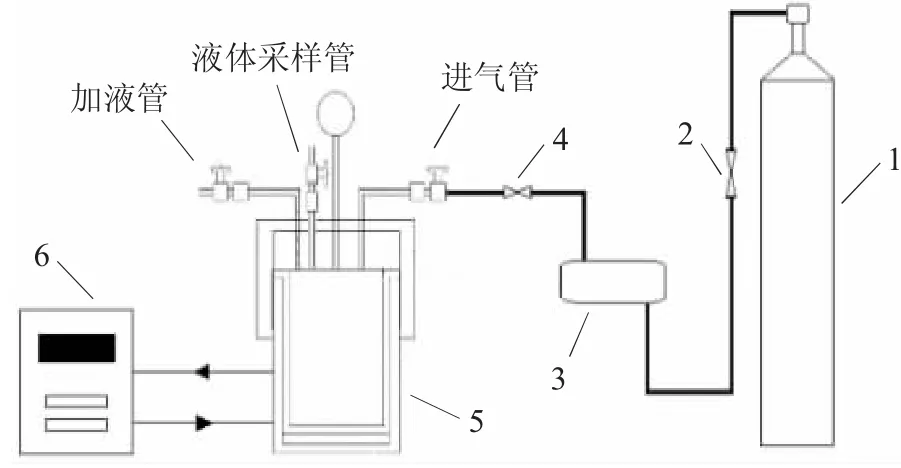
圖1 CO2吸收測試裝置示意圖Fig.1 Schematic diagram of CO2 absorption test device
可精確控溫(精度±0.2℃)的夾套式高壓反應釜是CO2吸收平衡的核心設備,有效體積為(454±0.4)mL,反應釜裝有壓力表(精度1.6級)和壓力傳感器用于監控混合萃取體系吸收CO2過程中壓力實時變化。液體采樣管尾端接近反應釜底部,避免液體采樣檢測時氣體滲漏造成試驗偏差。
裝置安裝連接完畢,逐步通入CO2至1.5MPa,保壓30min,期間對裝置各閥門螺紋接口、反應釜螺栓等處進行檢漏,以無滲漏、壓力不變為裝置強度試驗合格;將壓力降至實驗最高壓力(2.0MPa),保壓24h,壓力下降5%以內為裝置嚴密性合格。
將適量萃取劑-水通過加液管加入反應釜中,攪拌裝置開啟,打開循環控溫裝置,對體系抽真空(包括氣體管路),降低其他氣體雜質對實驗的干擾,關閉加液管針型閥;當反應釜內溫度達到實驗溫度后,向反應釜內通入一定壓力(P1)的CO2-N2混合氣體,關閉進氣管的針型閥,在溫度保持不變的前提下,記錄壓力變化和吸收時間,以壓力(P2)15min內壓力傳感器波動小于0.05kPa為吸收終點,實驗結束后,0.1mol·L-1NaOH溶液吸收剩余的CO2。
1.3 相關數據分析與測定
1.3.1 CO2吸收計算 在氣液吸收平衡中,N2不參與吸收過程,CO2氣相參數計算選擇準確性較高的Peng-Robinson狀態方程[4,9]:
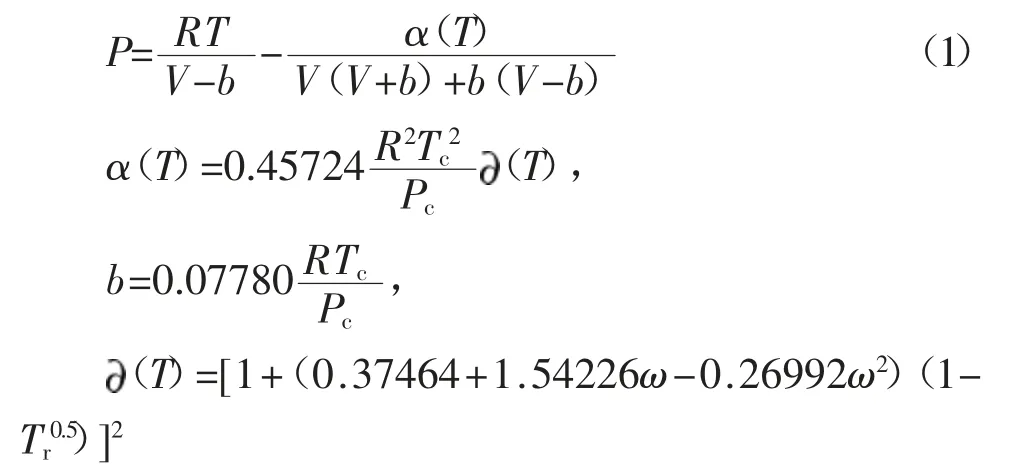
式中 V,P,T:CO2吸附過程體積、壓力和溫度;Tc,Pc:CO2的臨界溫度和臨界壓力;ω:CO2偏心因子;b:PR狀態方程常量;Tr:CO2相對溫度,Tr=T/Tc;R:理性氣體常數,8.314J·(mol·K)-1;α(T):分子間力的修正參數,是溫度的函數;(T):修正項,是Tr和ω的函數。
測定CO2吸附過程的初始壓力P1、吸收結束壓力P2和T,Tc,Pc和ω通過物性手冊查得,采用牛頓迭代計算得到CO2的總體積Vm,1,吸收之后的CO2分壓剩余體積Vm,2。迭代公式:

由體系的溫度、壓力,根據PR狀態方程,通過NTST Chemistry Webbook查詢、計算CO2的密度[5,8]:

由m=ρV得到反應釜內CO2吸附前質量m1和吸收后剩余質量m2;則CO2在萃取體系中的吸收質量為:
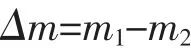
萃取體系吸收CO2的物質的量:
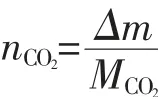
CO2在萃取體系中的溶解度可表示為:

式中 mCO2:CO2在溶劑中的質量摩爾濃度(mol/100g);m:萃取-萃取體系的質量,g。
1.3.2 Cl-含量檢測 取15.0g NaCl溶于1L去離子水中,模擬電廠廢水中Cl-含量,Cl-濃度14980mg·L-1。非水溶性有機叔胺-CO2-水相(含Cl-)反應-萃取耦合后,水相中Cl-含量測定標準為GB/T 15453-2008《工業循環冷卻水和鍋爐用水中氯離子的測定》。
Cl-脫除率(η):

2 結果與討論
2.1 Cl-萃取體系篩選
2.1.1 Cl-萃取劑 理想Cl-萃取劑特點:至少應含有一個萃取功能基團,可與Cl-快速絡合;碳鏈長度適中,萃取后既難溶于水,又要保證其油溶性能良好,分子量宜控制在250~500之間;萃取選擇性好、分離系數及萃取容量較高、易于反萃、可循環利用;萃取過程安全可靠,萃取劑毒副作用低[10]。
通過篩選實驗,選定8~16碳鏈的叔胺:三辛胺(TNOA)、雙十二烷基甲基叔胺(D12MA)、十六烷基二甲基叔胺(DMA16)為萃取劑;萃取功能基團為具有親核性的“N”,可與親電子基團形成絡合物;3種叔胺的碳鏈長度可使該類叔胺具有良好的疏水親油性。
2.1.2 稀釋劑 在萃取過程中很少使用100%的純萃取劑,而是根據實際需要添加某種惰性溶劑配成有機溶液使用。能溶解萃取劑且與被萃物無化學反應的“惰性”溶劑稱為稀釋劑。稀釋劑可調節萃取劑的黏度和表面張力、增加萃合物在有機相的溶解程度、增強溶劑化作用、加速水-油分相速率,故萃取組分中萃取劑和稀釋劑的復配比例較為重要。通過前期實驗和相關參考資料,初步篩選出非水溶性稀釋劑為正己醇、異戊醇、正丁醇。
2.2 萃取體系-水相中CO2吸收過程
非水溶性叔胺為萃取劑,復配稀釋劑后構成了Cl-的萃取體系。CO2在萃取體系-水相中的吸收過程較為復雜,主要有:CO2的非均相溶解;水相中H2CO3的生成和電離(H2CO3電離為萃取和反應耦合提供H+)。而H+濃度可直接影響有機胺對Cl-的最終萃取效果。因此,考察CO2在有機胺-水相吸收過程,選擇最佳吸收體系和吸收條件對萃取過程尤為重要。
2.2.1 CO2吸收設備可信度評價 對CO2吸收設備的試驗準確性進行評價。測定300K下,CO2在去離子水中的溶解度,與物性手冊中CO2的溶解情況進行比較[6,7],結果見表1,實驗測試值與真實值的平均誤差+4.67%<5.00%,判定實驗方法及設備準確,所得數據有參考價值。
表1 CO2在水中溶解度與真實值比較(mL·)Tab.1 Comparison of the solubility of CO2 in water with the true value(mL·)
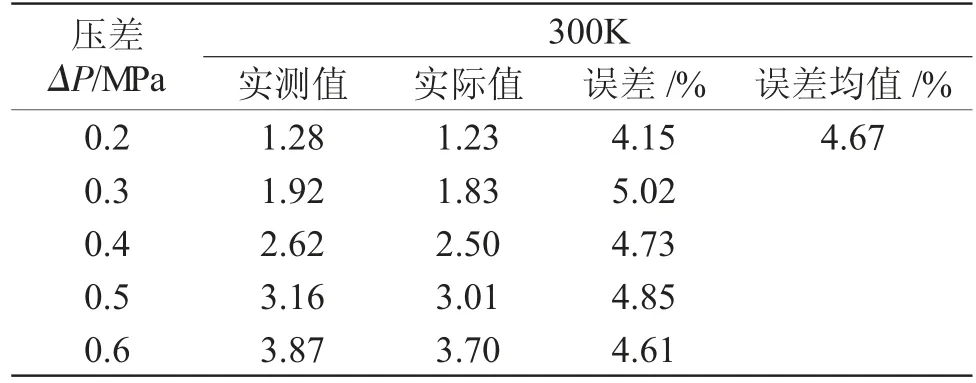
表1 CO2在水中溶解度與真實值比較(mL·)Tab.1 Comparison of the solubility of CO2 in water with the true value(mL·)
壓差ΔP/MPa 300K實測值 實際值 誤差/% 誤差均值/%0.2 1.28 1.23 4.15 4.67 0.3 1.92 1.83 5.02 0.4 2.62 2.50 4.73 0.5 3.16 3.01 4.85 0.6 3.87 3.70 4.61
2.2.2 有機萃取體系-水中CO2的吸收情況 通過研究CO2在萃取體系-水中的吸收情況,為Cl-萃取尋找最佳萃取組分和條件,因此,需要對萃取組分、稀釋劑的選擇、質量配比及實驗過程CO2-N2初始壓力和溶解過程溫度進行考察。實驗采用擬水平正交試驗,正交表表頭設計為L18(37),各因素水平見表2。

表2 正交試驗因素表Tab.2 Orthogonal test factor table
將萃取劑、稀釋劑、水溶液依據表2配制成不同的有機相-水相組分,每份100g,在相應的初始壓力和溫度進行實驗,通過1.3.1計算得到CO2在該萃取組分下的溶解情況(mol/100g),相應結果見表3。

表3 CO2在萃取體系-水中的溶解情況Tab.3 Dissolution of CO2 in the extraction system-water
以CO2的溶解情況為考察標準對正交數據進行極差分析,得到主→次要影響因素:初始壓力>萃取劑種類>溫度>有機萃取組分質量比>稀釋劑種類>萃取組分-水質量比。低溫和較高的壓力有助于CO2在有機體系中的溶解;在低碳鏈的萃取劑和稀釋劑的組分中,CO2的溶解度較大。有機萃取相與水相的質量比對CO2吸收過程的影響最小。最佳方案:萃取劑選用TNOA,稀釋劑選擇正丁醇(NBA),二者質量比為1∶2;初始壓力為1.8MPa,溫度293K;萃取組分-水質量比為1∶2。
2.2.3 CO2在萃取劑中的溶解情況 不同初始壓力下CO2在TNOA、D12MA、DMA163種叔胺中的溶解情況(圖2)中發現,CO2的溶解摩爾量隨初始壓力增加而增大且滿足線性關系,可推斷CO2在非水溶性長鏈有機叔胺(C≥8)中以物理吸收為主,TNOANBA體系對CO2的吸收容量高于D12MA-NBA及DMA16-NBA體系。

圖2 不同壓力下CO2在TNOA和D12MA組分中溶解情況Fig.2 Dissolution of CO2 in different components under different pressures
理論而言,氣體在有機體系中物理吸收步驟:(1)有機分子間交互形成可容納溶質的“空穴”,分子的極性和空間位阻會影響空穴接納溶質的能力;(2)氣體進入空穴與有機分子通過物理作用力形成新的交互作用[8]。因此,當萃取劑和稀釋劑碳鏈增長時,空間位阻的影響較大,因此,TNOA-NBA體系的CO2溶解能力較優。
2.2.4 不同TNOA濃度對CO2的吸收情況 萃取劑在萃取組分的濃度也會影響Cl-的萃取和反應耦合程度。萃取劑含量較低,Cl-萃取容量不足,水相中過量的HCl無法被叔胺絡合轉移,萃取效果較差;萃取劑含量過高,有機體系黏度和表面張力過大,影響有機相對水相的包裹浸潤、制約反應耦合動力學過程。
圖3為293K下,不同TNOA濃度的萃取體系對CO2的溶解情況。

圖3 不同TNOA含量下CO2溶解情況Fig.3 CO2 dissolution under different TNOA content
由圖3可知,在相同壓力下,隨著TNOA質量分數的增加,CO2溶解度先增大后減小,以TNOA與NBA質量比在1∶1和1∶2時CO2的溶解效果較為理想。適量添加呈弱堿性的叔胺有助于酸性CO2的溶解,但隨著叔胺質量進一步增加,有機體系的黏度隨之提高,CO2傳質過程受阻難以進入“空穴”,進而溶解度降低。
2.3 萃取體系-CO2對水中Cl-的萃取過程
2.3.1 萃取體系-CO2對Cl-的萃取 在CO2最佳吸收體系下進行Cl-的萃取和反應耦合研究。吸收CO2的水相更換為NaCl溶液,萃取體系(O)與NaCl溶液(W,Cl-濃度14980mg·L-1)的質量比m(O∶W)=1∶2,1∶1,2∶1,考察不同m(O∶W)對CO2吸收及Cl-單級萃取脫除情況,相關結果見表4。

表4 萃取體系-CO2單級耦合萃取水中Cl-Tab.4 Extraction system-CO2 single-stage coupling extraction of chloride ions in water
由表4可知,實驗1#為H2SO4調節NaCl溶液pH值為2的空白實驗,無CO2通入,萃取過程為常壓。
從Cl-萃取角度分析,水相中H+隨萃取的進行逐漸被消耗,足量的H+可與水中Cl-生成HCl與TNOA耦合進入有機相,若由CO2吸收和H2CO3電離中提供的H+不足,水中剩余Cl-濃度偏高,萃取效果不理想。用H2SO4調節水相的pH值,可提供定量的H+,隨萃取的進行H+被消耗無額外補充,萃取效果不理想。而通過CO2在萃取體系(TNOA-NBA)-水中吸收和水中電離,可以持續為Cl-提供H+,有助于Cl-的萃取脫除。293K,初始壓力為1.8MPa,有機相和水相相比1∶2時,單級Cl-脫除率最高。
2.3.2 CO2吸收與Cl-脫除情況 萃取體系與NaCl溶液質量比為1∶2時,每隔相同時間段從反應釜中取樣,測定水溶液中Cl-的濃度,計算Cl-脫除率;通過釜內壓力變化得到CO2在萃取體系-NaCl溶液中溶解情況。Cl-脫除率與CO2溶解吸收關系見圖4。
由圖4可見,Cl-的脫除率隨CO2溶解量基本呈線性增長。在萃取初期,脫除率隨CO2在液相的溶解度增加而增長,且脫除速率較快;隨著反應的進行,Cl-脫除速率逐步降低,Cl-脫除率停止增長趨于穩定。由此可見,CO2的溶解量直接影響Cl-的脫除情況。
由此可知,一定壓力下,CO2既可被TNOA吸收,也可溶于水中,水相(W)與有機相(O)中的CO2溶解度存在動態平衡,CO2在TNOA-水的混合液體中溶解度高于單一有機相:
CO2在水中溶解生成弱酸——H2CO3并伴隨水解平衡[11],H2CO3在水解過程中為Cl-的萃取和反應耦合提供H+,H2CO3在水中可進行二級電離:

雖然H2CO3在水中電離較弱,但H+與Cl-以HCl形式轉移至有機相,H+被消耗,平衡向電離方向移動,H2CO3持續為萃取過程提供H+。通過Cl-脫除率可推算H2CO3電離的H+濃度進而得到液相中CO2的利用率。當Cl-脫除率57.5%,CO2在液相的溶解達到0.061mol·100g-1,其利用率在30%左右,提高CO2利用率仍是今后的重點研究方向。有機叔胺-CO2對水中Cl-的萃取和反應耦合過程如下:
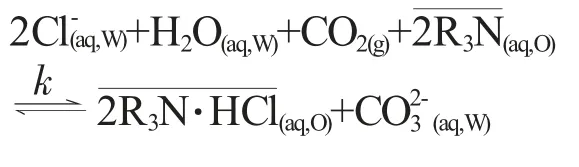
3 結論
本文首先通過恒定容積法采用擬水平正交試驗測定了CO2在非水溶性叔胺(三辛胺、雙十二烷基甲基叔胺、十六烷基二甲基叔胺)的溶解情況,其影響CO2物理溶解過程因素主次為:初始壓力>萃取劑種類>溫度>有機萃取組分質量比>稀釋劑種類,CO2最佳吸收條件為:三辛胺與正丁醇質量比為1∶2,初始壓力1.8MPa,溫度293K;在最佳吸收條件下考察了叔胺-CO2萃取脫除NaCl溶液中Cl-情況,在水油相比為1∶2條件下,三辛胺萃取體系-CO2對水中Cl-單級萃取脫除率達到57.5%,高于使用H2SO4酸化的脫氯效果。通過對非水溶性叔胺-CO2萃取耦合脫除Cl-的相關研究,為Cl-萃取過程提供基礎數據,擴大了萃取劑選擇范圍,也為將CO2引入離子萃取過程的工業應用提供理論參考。

