一株貝萊斯芽孢桿菌的分離與鑒定
繆伏榮,陳鑫珠,邱華玲,劉 景
(福建省農業科學院畜牧獸醫研究所,福州350013)
0 引言
茶渣是茶飲料、速溶茶和茶單寧產業等加工茶葉后產生的殘渣,據統計,僅茶飲料和速溶茶公司每年產生的茶渣超10萬t。研究報道,干基的茶渣粗蛋白質含量為17%~25%,是一種良好的蛋白質飼料資源[1-3]。日本研究者[4]、高風仙[5]和陳曉虹[6]以茶渣為添加劑喂養禽畜不僅可以降低成本,還可以一定程度上改善畜牧產品的質量,提高經濟效益。但馬幫軍[7]研究表明,豬日糧中添加茶粉1%~3%會降低豬的平均日增重;舒慶齡[8]的實驗結果表明,在肉雞飼料中添加茶渣3%~5%,喂養60天,肉雞增重明顯低于對照組。這主要原因是茶渣粗纖維含量高,畜禽纖維素酶活力低,不利于吸收利用;其次剛出產的茶渣水分達到80%不易儲藏和運輸,因此僅有小部分的茶渣作為飼料源利用,大部分茶渣被丟棄或掩埋;這不僅造成資源浪費,而且造成生態環境污染[9-10]。為了更好利用茶渣資源,劉姝等[11]利用木霉等組合微生物發酵茶渣,30℃,經4~8天發酵后測定飼料中粗蛋白含量達到25%以上,比對照組提高了20%,其營養價值達到了仔豬配合飼料中粗蛋白的含量。胡桂萍等[12]以提取茶多酚后的茶渣為發酵原料,利用乳桿菌、枯草芽孢桿菌、酵母菌和米曲霉菌進行常溫(25~35℃)的厭氧固態發酵5~7天,發酵產品中粗蛋白含量達29.49%。倪星虹[13]以混合菌種溫度28℃、發酵7天,茶渣發酵產物中蛋白質含量提高了60.78%。朱飛等[14]利用黑曲霉在添加5%玉米粉的茶渣中進行固態發酵,自然pH、37℃、8天發酵后顯著提高茶渣的營養價值,茶渣經發酵后雖然能在一定程度上提高茶渣的營養價值。但發酵溫度均不超過37℃,發酵效率低,時間長,易被雜菌污染。因此有必要篩選能高效分解茶渣的高溫菌株。貝萊斯芽抱桿菌(Bacillusvelezensis)是2005年由Ruiz-Garcia等[15]新命名的一種生防菌,是芽孢桿菌屬的一個新種[16-19]。國內外己有學者研究表明Bacillusvelezensis能產生具有廣譜抗菌活性的次生代謝產物,包括纖維素酶、蛋白酶以及多種抗菌的活性物質,是用來增加作物產量、維護生態環境和農業生態系統的首選生物藥劑[20-28]。貝萊斯芽孢桿也作為水產養殖的益生菌[29]。Liu等[30]對從海洋微生物中篩選到菌株BacillusvelezensisH3的發酵培養基和拮抗物質進行研究,發現該菌株的活性物質是一種替代性的表面活性素,有較高的研究價值。但鮮見貝萊斯芽抱桿菌(Bacillusvelezensis)分離茶渣的研究報道。
本研究從堆積廢棄茶渣中分離到即耐高溫又能產生較高酶活力的貝萊斯芽孢桿菌,對該菌進行形態學、生理生化以及分子生物學鑒定,同時研究其最適的生長條件,為后續的茶渣開發研究奠定理論的基礎。
1 材料與方法
1.1 材料
LB培養液(L):酵母粉10 g,蛋白胨10 g,牛肉浸膏5 g,NaCl 10 g,pH 5.5~6.0。
純化固體培養基:LB培養液中時加入20 g瓊脂粉。
分離固體培養基:取新鮮茶渣50 g加蒸餾水500 mL蒸煮30 min,過濾后的茶渣液定容到200 mL,加入4 g瓊脂粉。
液體發酵培養基:同LB培養液。
主要儀器:LRH-250A生化培養箱、SW-CJ-1FD單人超凈工作臺、LDZS-30KBS立式高壓滅菌器、CRY-200恒溫搖床、Multiskan MK3酶標儀等。
試劑:酵母粉、蛋白胨、NaCl、硫酸、硼酸、硫酸銅、硫酸鉀、氫氧化鈉、辛醇、鹽酸等均為AR級。
1.2 方法
1.2.1 菌株的培養與分離
(1)富集培養:從某地堆積多年的茶渣處取樣品10 g,加入盛有30 mL LB培養液的250 mL錐形瓶中,在42℃、120 r/min條件下富集培養24 h,取2 mL培養物接種到新鮮的LB培養液,以相同的條件進行培養。如此重復3次。
(2)初篩:富集培養物在分離固體培養基上劃線培養,42℃培養24 h。挑取生長明顯的菌落進行復篩。
(3)復篩:將初篩菌落在純化固體培養基上劃線分離3次,以獲得純培養物,并依據菌種在分離固體培養基的生長情況,挑取有不同形態特征的單菌落,于42℃ LB培養基上分別擴繁后加20%甘油混勻,于-80℃條件下保存。
1.2.2 菌株產酶能力測定 選取生長較好的菌株進行試驗。將菌株活化24 h后挑取1環至用液體發酵培養液中,42℃、120 r/min條件下培養48 h后,測定發酵液的蛋白酶、纖維素酶的活力。
采用蒽酮比色法測定纖維素酶(CL)催化羧甲基纖維素鈉降解產生的還原糖的含量[31]。每mL樣本每分鐘催化產生1 μg葡萄糖定義為一個酶活力單位(U)。
酸性蛋白酶(ACP)、中性蛋白酶(NP)和堿性蛋白酶(AKP)的測定按照國標GB/T23527-2009和相關文獻[32-33]執行。
1.2.3 菌株形態學觀察 篩選獲得的菌株,平板劃線42℃分別培養16 h和25 h,在自然光下觀察菌落形態;革蘭氏染色后,觀察菌株形態[34-35]。
1.2.4 菌株生理生化特性 糖發酵試驗、吲哚試驗、淀粉水解試驗、油脂試驗等實驗參考參照文獻[36-37]進行。
1.2.5 分子鑒定 菌株的分子鑒定用16S rDNA和gyrB基因進行[38]。以下細菌擴增引物均由生工生物工程(上海)股份有限公司合成。利用NCBI網站的BLAST功能對所測的16S rDNA和gyrA序列進行同源性分析,確定親緣關系,使用MEGA 5.0軟件Neighbor-Joining[39-41]構建系統發育樹,進行1 000次的相似度重復計算。
1.2.6 菌株生長特性 首先測量菌株的生長曲線,判斷最適生長溫度以及生長代時[42]。其次對其他生長條件進行單因素試驗按表1中的設計方案,分析不同因素對菌株生長的影響,其他培養條件和培養基相同,間隔2 h取樣用酶標儀在波長630 nm處測吸光度。每組設置3個重復。
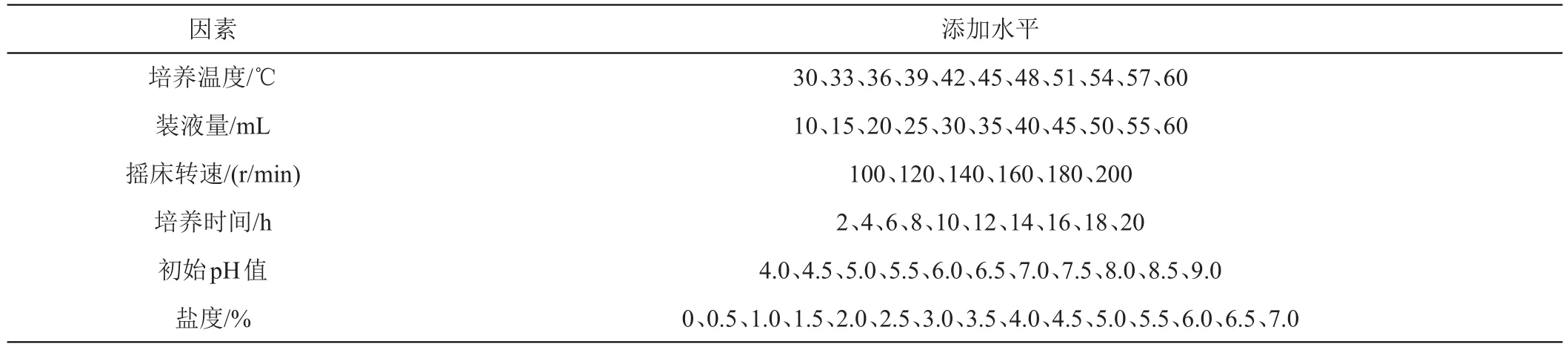
表1 菌株生長條件單因素試驗
1.2.7 數據分析 所得數據用SPSS 16.0生統軟件進行分析,f檢驗分析實驗數據。
2 結果與分析
2.1 菌株產酶能力比較
對5株菌的發酵液進行分析,產纖維素酶(CL)活力由高到低分別是DJ、8106、Fb、8116、HLH;酸性蛋白酶(ACP)活力由高到低分別是8106、8116、DJ、HLH、Fb;中性蛋白酶(NP)活力由高到低分別是8106、HLH、8116、DJ、Fb;堿性蛋白酶(AKP)活力由高到低分別是Fb、8116、8106、DJ、HLH(表2)。可見Fb株菌產4種酶的活力均較強。

表2 菌株酶活力比較
2.2 菌落形態和菌株形態
Fb菌株在自然光下,LB培養基,42℃培養16 h,其菌落淺黃色,圓形,表面干燥,不透明,邊緣不整齊,如圖1。菌體呈桿狀,0.4~0.6 μm×0.9~4.0 μm,單個或成對排列,見圖2。
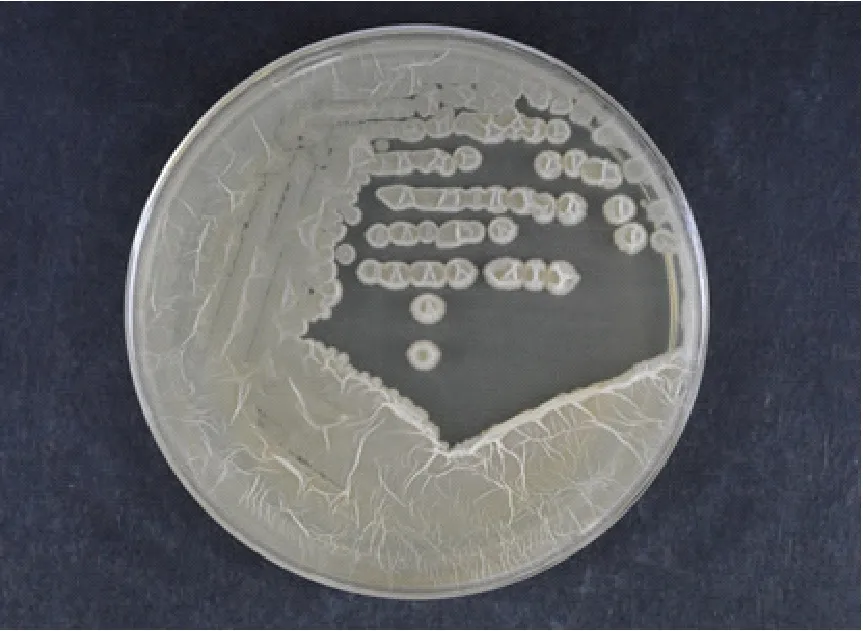
圖1 菌落形態
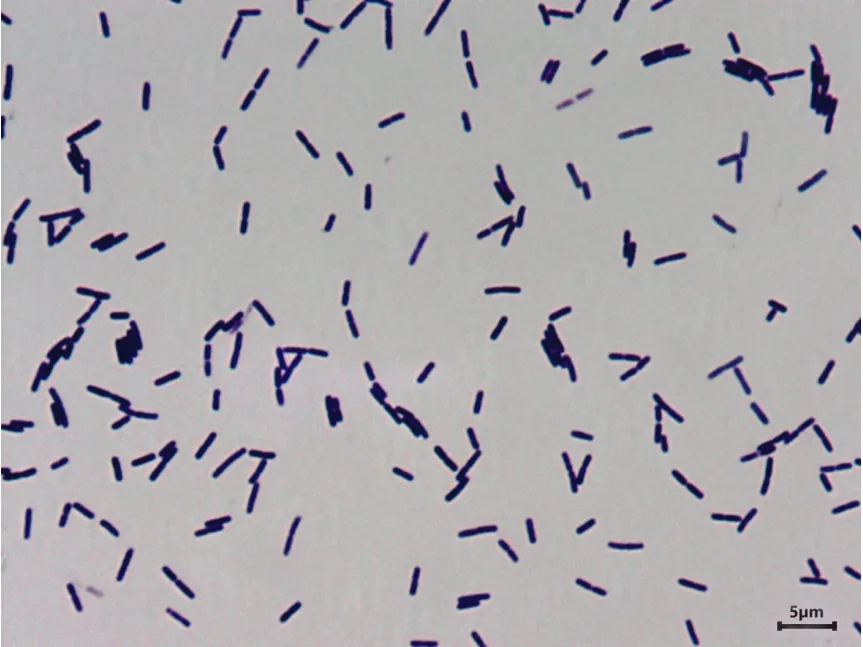
圖2 菌株形態
2.3 菌株生理生化特性
由表3可知,Fb菌株能水解七葉苷;吲哚試驗陽性;可在β-木糖苷酶、苯丙氨酸芳胺酶、α-半乳糖苷酶、丙氨酸-苯丙氨酸-脯氨酸芳胺酶、L-吡咯烷酮芳胺酶等酶中生長;能利用D-甘露醇、D-甘露糖、古老糖、D-海藻糖、D-葡萄糖、D-核糖等多種糖作為碳源生長;但不能利用肌醇、L-鼠李糖、菊粉、環糊精、N-乙酰-D-氨基葡萄糖、D-塔格糖、糖原、麥芽三糖、D-松三糖等。Fb菌株能在低劑量的抗菌素中生長,其卡那霉素、竹桃霉素和多粘菌素B耐藥劑量分別是0.2 g/L、0.1 g/L和0.031 g/L。
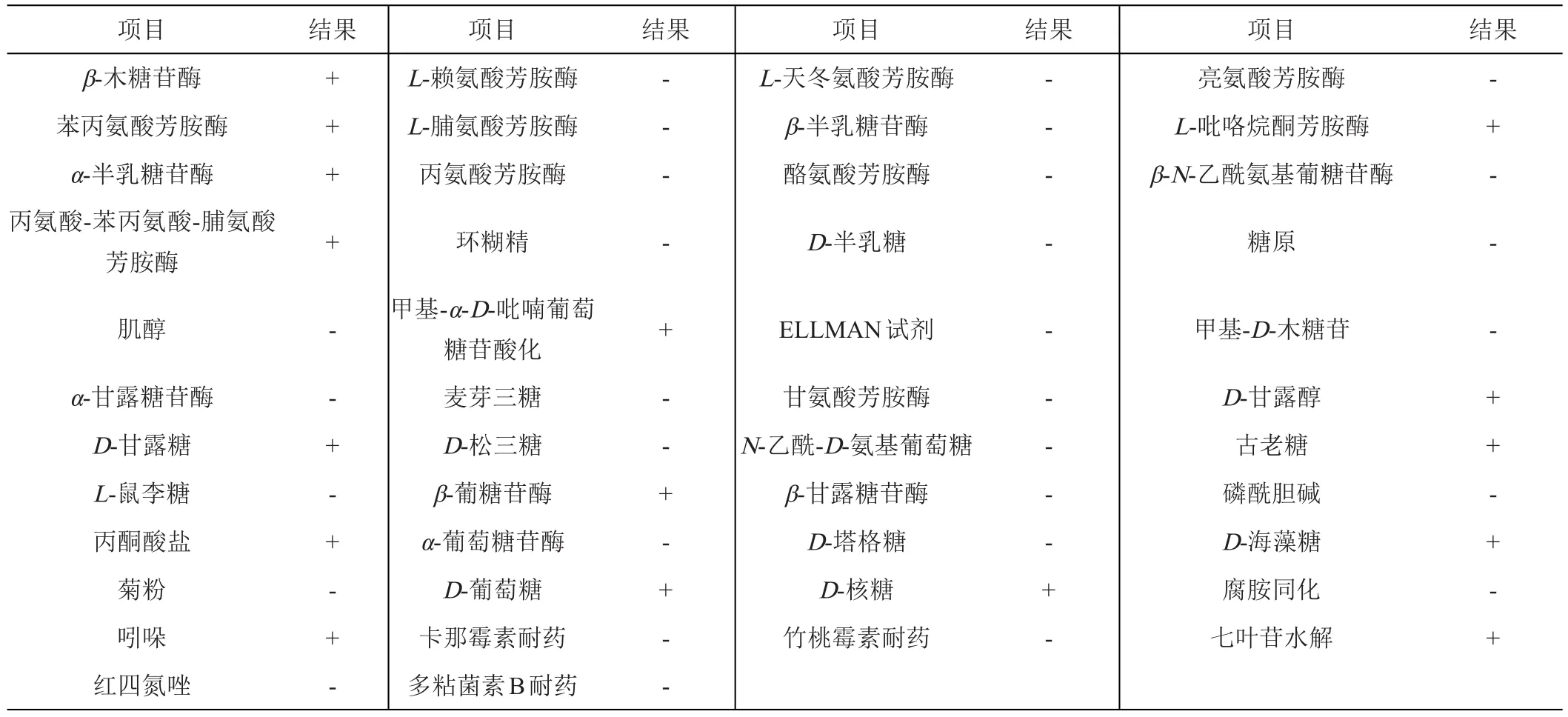
表3 Fb菌株生理生化特性
2.4 菌株的分子鑒定
利用NCBI數據庫中的Blast程序分析結果表明,Fb菌株與BacillussiamensisKCTC13613(AJVF01000043)和BacillusamyloliquefaciensDSM 7T(FN597644)菌株的同源性最高,相似性達到99.93%。采用MEGA 5.0軟件,鄰位鏈接法顯示Fb菌株與相關種的16S rDNA序列系統發育樹(圖3)。菌株gyrB測序分析表明,序列長1176 bp。MEGA5.0軟件分析結果表明,其與BacillusvelezensisBCRC 17467T(DQ903176)的同源性較高,相似性達到100%。同理將該菌株與其他種屬明確的10株菌的gyrB基因構建系統發育樹(圖4)。
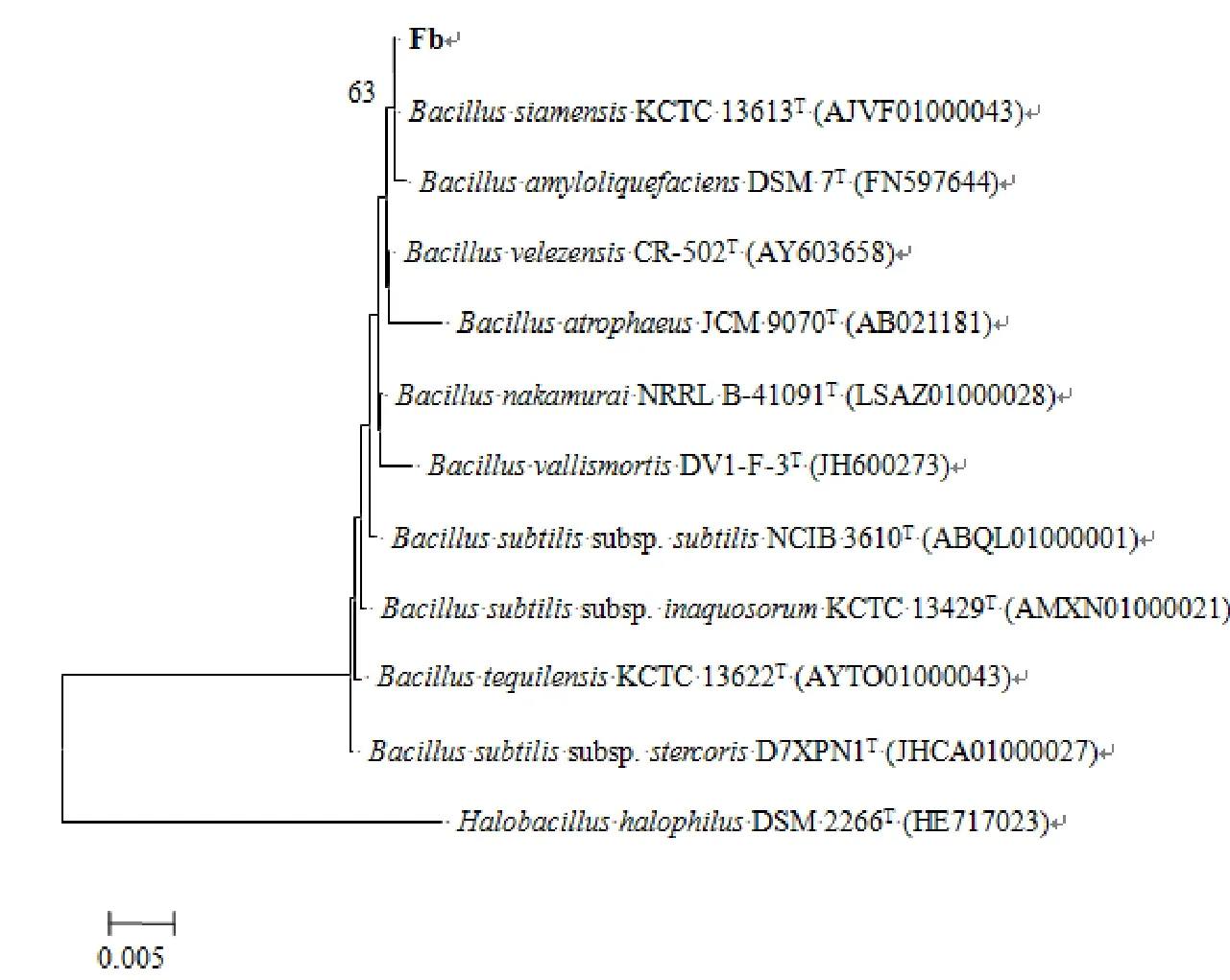
圖3 基于16S rDNA的相似菌株系統發育樹
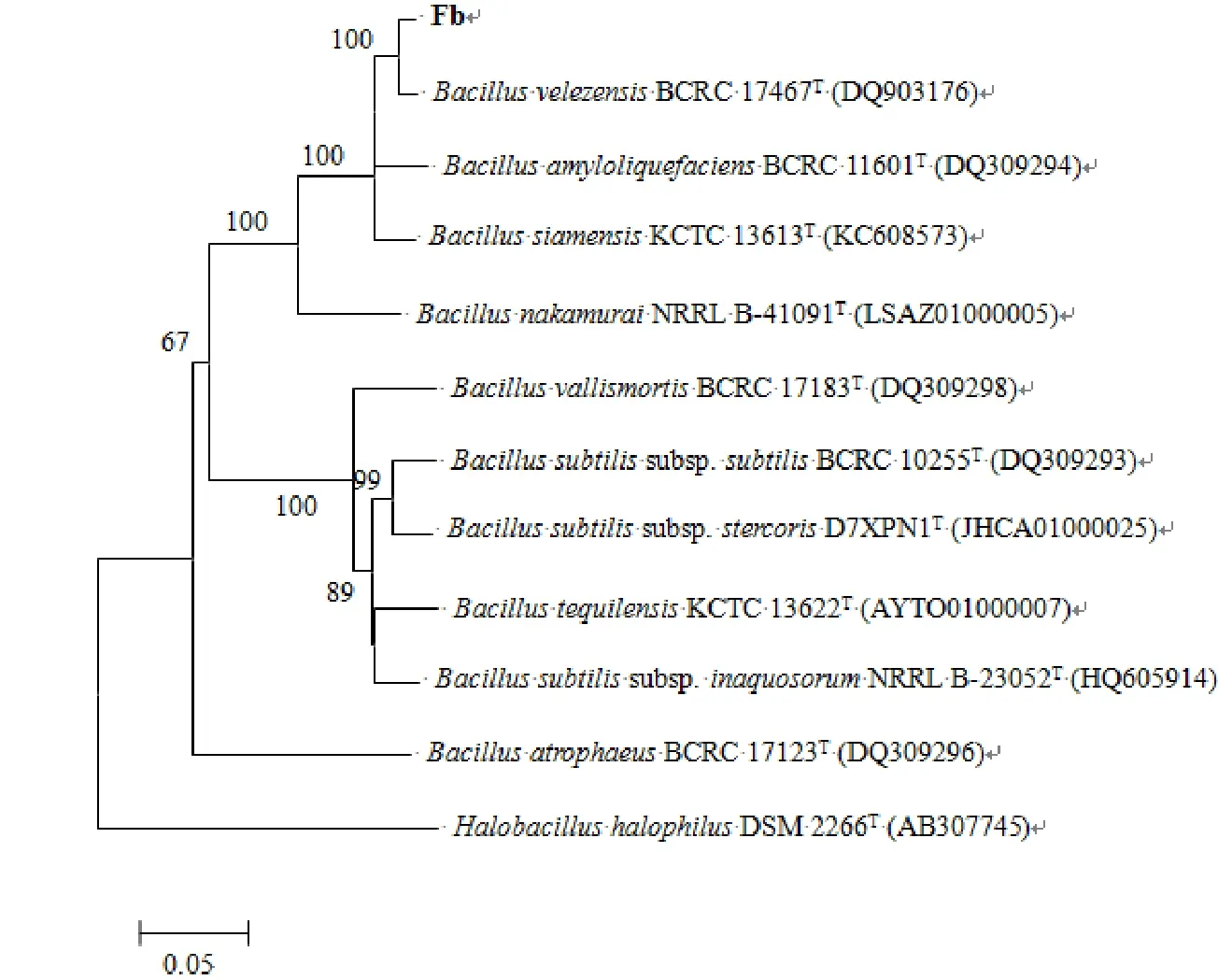
圖4 基于gyrB的相似菌株系統發育樹
結合菌株形態學、生理生化特性以及16S rDNA和gyrB的序列比較分析,將Fb菌株鑒定為貝萊斯芽孢桿菌(Bacillusvelezensis)。
2.5 菌株生長特征
2.5.1 Fb菌株的生長曲線 從圖5可以看出,Fb菌株可在30~60℃下生長,在30~39℃培養時隨著培養溫度的提高菌株的細胞分裂加快,即吸光值增加;在39~54℃培養時其吸光值(0.89~0.93)最高,組間差異不顯著;54~60℃隨著培養溫度的提高吸光值下降;因此Fb菌株最適的生長溫度為39~54℃。
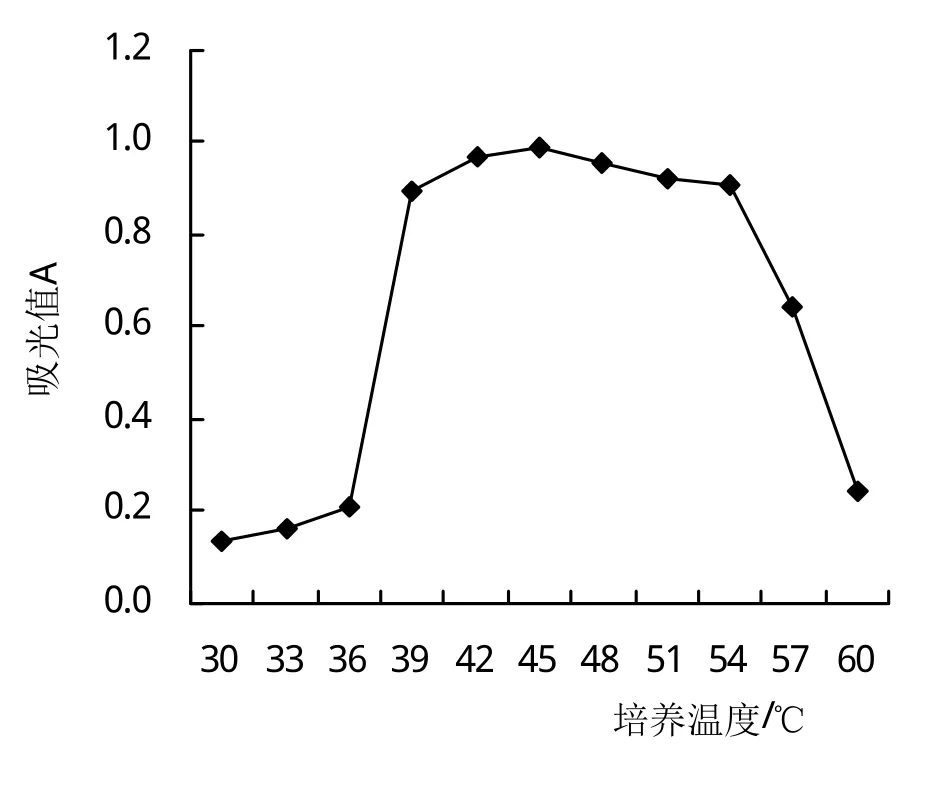
圖5 培養溫度對菌株生長的影響
2.5.2 裝液量和搖床轉速對菌株生長的影響 搖床轉速120 r/min,隨著裝液量的增加,菌液的吸光值升高,至裝液量30 mL時,Fb菌株的吸光值達最高0.97;再提高裝液量,吸光值逐漸降低(圖6)。從圖7可知,裝液量30 mL時,隨著搖床轉速的提高,吸光值升高,當搖床轉速為120 r/min時,Fb菌株的吸光值達到最高0.98;再提高搖床轉速,吸光值逐漸降低。表明Fb菌株最佳裝液量和搖床轉速分別為30 mL和120 r/min。
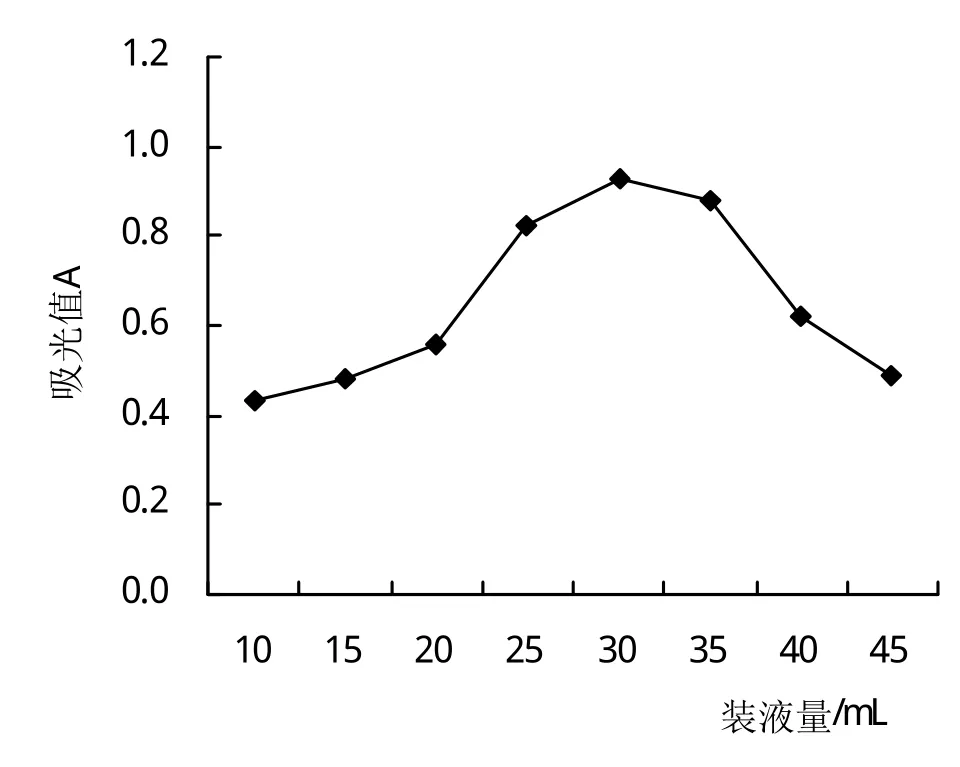
圖6 裝液量對菌株生長的影響

圖7 搖床轉速對菌株生長的影響
2.5.3 培養時間對Fb菌生長的影響 圖8為Fb菌株在培養溫度42℃下的生長曲線。0~6 h是菌體適應新環境的遲緩期,細胞分裂增殖緩慢;6~16 h為生長繁殖迅速的對數生長期;16 h的菌體吸光值最高0.974;16~18 h為穩定生長期;18 h后由于自溶酶作用或有毒代謝產物積累,細胞裂解菌體吸光值隨之下降。表明Fb菌的最適培養時間為16 h。
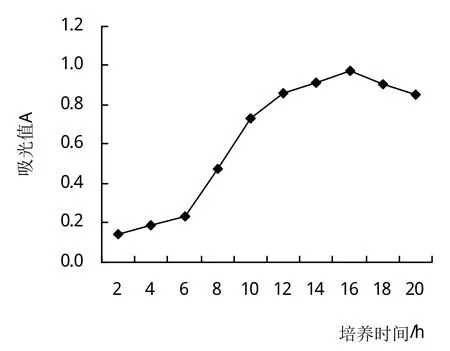
圖8 培養時間對Fb菌生長的影響
2.5.4 初始pH對Fb菌生長的影響 從圖9可以看出,培養基初始pH 4.0~5.0時,菌體吸光值隨pH的提高而提高;培養基初始pH 5.0~7.0范圍內,Fb菌生物量較高且各組間差異不顯著,吸光值均高0.93;再逐漸提高培養基的初始pH培養時,菌體吸光值隨之下降;表明Fb菌株的培養基最適初始pH 5.0~7.0。
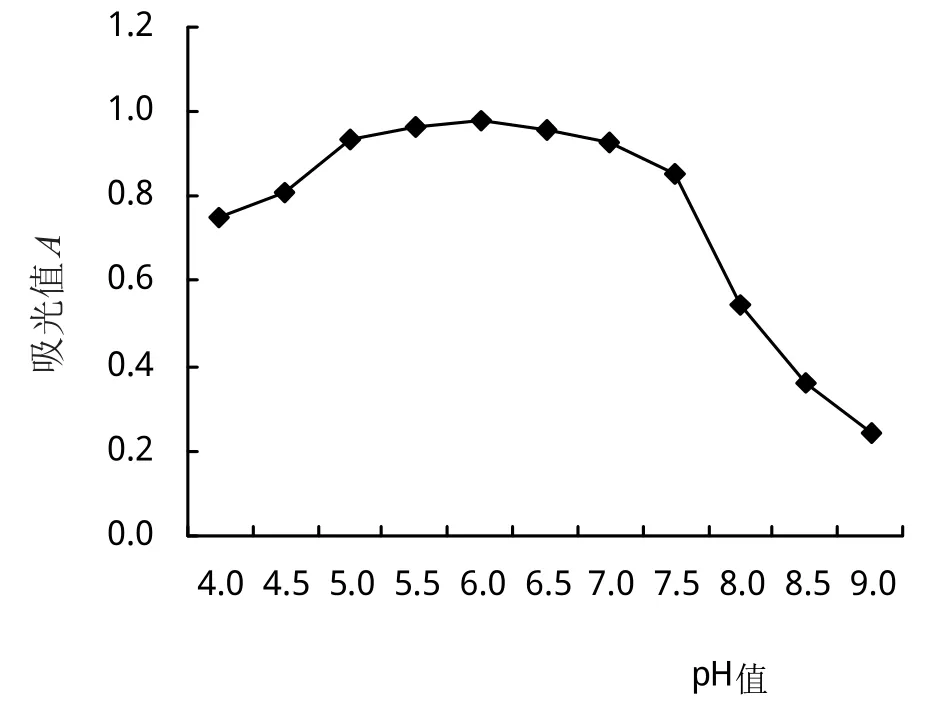
圖9 初始pH對Fb菌生長的影響
2.5.5 鹽度對菌株生長的影響 實驗中改變培養基的鹽度,來研究Fb菌株生長最適的鹽度。從圖10可以看出,培養液的鹽度從0.0增加到1.0%菌株的吸光值也從0.46增加到0.92;培養液的鹽度1.0%~6.0%菌株的吸光值均大于0.92,無顯著差異;6.0%~7.0%菌株的吸光值下降至0.81。
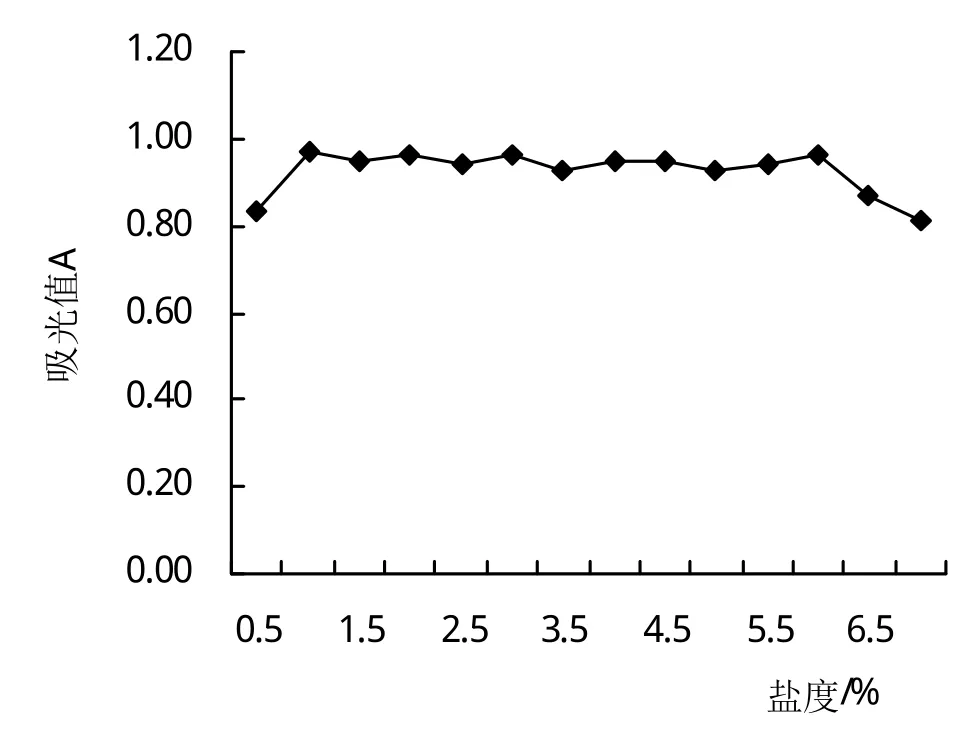
圖10 鹽度對菌株生長的影響
3 討論與結論
研究表明,在固態發酵中,適宜的水分和原料粒度能夠保證發酵基質深層微生物對氧氣的需求,疏松多孔的基質狀態還能使得微生物的代謝廢物及時排出,基質內部的養分也可隨著自由水通過原料間隙擴散到基質表面,滿足基質表面微生物對營養的需求,有利于微生物正常繁殖并保持高產酶活性狀態[43-44]。對于含水率高的物料一般選擇吸水性強的鋪料如麥麩等來降低物料的含水率;或選擇中高溫菌發酵利于物料中水分蒸發。本研究獲得貝萊斯芽孢桿菌Fb屬高溫菌,茶渣經7天發酵后水分下降了42.06%(P<0.05),可有效解決新鮮茶渣水分過高的問題。此外Fb菌株的生長溫度均高于劉姝等[11]、胡桂萍等[12]、倪星虹[13]和朱飛等[14]的發酵菌株,這不僅可減少其他雜菌生長,而且可提高發酵效率。
本研究從堆積多年的茶渣中分離篩選到5株茶渣降解菌,其中一株Fb菌株經菌落形態、菌株形態、生理生化特性的研究,及分子鑒定為貝萊斯芽孢桿菌(Bacillusvelezensis)。該菌最適生長條件為:裝液量30 mL、搖床轉速120 r/min、培養溫度39~54℃、培養時間為16 h、初始pH5.0~7.5、鹽度為1.0%~6.0%。同時,Fb菌株產生具有較強酶活力的纖維素酶、酸性蛋白酶、中性蛋白酶和堿性蛋白酶。與胡寶東等[45]從醬香型大曲中分離獲得的甲基營養型芽胞桿菌(即貝萊斯芽胞桿菌)FBKL 1.0190相似。Fb菌株是否在發酵過程中還會產生一些抗菌的活性物質[20-28]和表面活性素[30],這有待下一步的研究。本研究在茶渣中分離篩選出貝萊斯芽抱桿菌鮮見報道。

