亞熱帶水庫浮游植物季節動態及其與環境因子的關系
王遠飛,周存通,趙增輝,林植華,*
1 南京師范大學生命科學學院, 南京 210023
2 麗水學院生態學院, 麗水 323000
浮游植物群落是湖泊和水庫的主要初級生產者,是水生食物鏈的基礎[1]。因此,浮游植物對維持健康的水生生態系統至關重要,經常被用作水生生態系統健康和化學污染物脅迫效應的指標[2]。浮游植物種類組成、分布和主要色素葉綠素a(Chl-a)濃度的動態變化是水質和營養狀況的生物指標。一般來說,浮游植物的種類組成和數量分布在理化參數的影響下呈現出廣泛的時空變化[3]。這種變化通常被認為是由環境變量例如溫度[4- 5],光照,營養鹽[6- 7]的上行效應和浮游動物的下行效應控制[8]。這些因子發生變化,將在一定程度上影響浮游植物群落結構[9]。由于浮游植物對環境因素的敏感性,通常作為檢測河流、湖泊等淡水水體水質局部變化的關鍵指標,為水污染和富營養化提供早期預警信號[10]。
水庫是具有經濟和生態重要性的人造水體,提供重要的淡水資源和生態服務,具有重要的社會和經濟價值[11]。富營養化是湖泊和水庫最嚴重的生態問題之一,導致水質退化和用水嚴重限制[12],由此造成的浮游植物大量繁殖引起的藻類水華已成為全球水質的重大威脅[13],已成為中國和許多其他國家最普遍的水質問題[14]。近年來,在中國沿海和湖泊等大型水生生態系統中已經開展了關于浮游植物及其控制因素的廣泛研究[15- 17],對小型亞熱帶水庫浮游植物群落與環境因子的關系也有少量相關的報道[18- 19]。
黃村水庫流域位于浙江省西南部,屬亞熱帶小型飲用水水庫,近年來遭受污染并出現局部藍藻水華。本研究對水庫表層水中的浮游植物進行了鑒定和計數,記錄相關的環境因子。研究了亞熱帶小型水庫浮游植物豐度的動態變化及其演替模式;通過浮游植物群落組成與水生環境因子的冗余分析(RDA),分析了影響浮游植物動態變化的關鍵環境因子;為該流域生態變化、水質評價和污染控制提供基礎數據和科學依據。
1 材料與方法
1.1 研究區域
黃村水庫流域位于浙江省西南部,坐標東經118°41′—120°26′和北緯27°25′—28°57′之間。該水庫正常蓄水位149.20m,流域面積184.3km2,水庫總庫容1876萬m3,年供水總量為2920萬t。黃村水庫流域地處亞熱帶季風氣候區,溫暖濕潤,降水豐沛。流域內無工業企業、養殖場,且流域內耕地為梯田和水平地并無順坡耕作現象,因此流域內無工業污染源、養殖場污染及農業污染[20]。
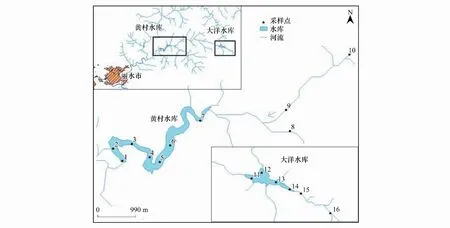
圖1 黃村水庫流域采樣點設置
1.2 取樣和分析
根據候平均氣溫四季劃分方法,研究區域四季變化為春季3—5月、夏季6—9月、秋季10—11月和冬季12月—次年2月[21]。在2017年4月至2018年3月期間,從該流域16個取樣點每月采集浮游植物和水樣。浮游植物的分類分析,用浮游生物網(55μm網目)從表層水中提取定性浮游植物樣品,并轉移到100mL聚乙烯瓶中。對于浮游植物的定量分析,采集表層水樣并轉移到500mL聚乙烯瓶中。定性和定量浮游植物樣品均在現場用魯哥試劑保存(最終濃度為4%)[22]。使用×20,×40和×100物鏡在光學顯微鏡(Olympus BX51)下測定浮游植物物種組成、生物量等信息。浮游植物鑒定依據中國淡水藻類和藍藻分類的最新研究[2]。根據Uterm?hl沉淀法用倒置顯微鏡(Olympus CKX- 41)分別用×20和×40物鏡對藻類進行計數[23]。
在浮游植物采樣的同時采集表層水樣品,轉移到2L聚乙烯瓶中,立即送往實驗室進行水化學分析。使用YSI-多參數水質測量儀現場測量電導率(EC)、pH、溶解氧(DO)和水溫(WT)。用薩氏盤測量水透明度(Turb)。
水樣在取樣當天進行過濾。對過濾后的水樣進行硝酸鹽氮(NO3-N)、銨態氮(NH4-N)、亞硝酸鹽氮(NO2-N)分析,對未過濾的水樣進行總氮(TN)、總磷(TP)、高錳酸鹽指數(CODMn)分析。
用分光光度法對NO3-N(2,6-二甲基苯酚法)、NH4-N(苯酸鹽法)、NO2-N(重氮化法)、TN(過硫酸鹽消解后2,6-二甲基苯酚法)和TP(過硫酸鹽消解后抗壞血酸法)進行分析,通過重鉻酸鹽回流法測定CODMn[24]。
1.3 數據分析
根據每個物種的優勢度確定浮游植物的優勢種,如下式所示。
Y=(ni/N)×fi
式中,N為樣品所有物種的總豐度,ni為樣品中第i個物種的總豐度,fi為該物種在所有樣品中出現的頻率。如果物種的優勢度值Y大于0.02,則認定為優勢種[17]。
利用Shannon-Wiener多樣性指數(H′)、Margalef豐富度指數(D)和Pielous均勻度指數(J)計算浮游植物群落指標。指數通過以下等式計算[25]:
D=(S-1)/lnN
J=H′/lnS
式中,Pi是物種i的豐度與所有物種豐度(N)的比值,S是物種總數。
利用物種豐度數據進行去趨勢對應分析(DCA)來確定是采用線性排序還是單峰排序。DCA四個軸中梯度最大值超過3,選擇典范對應分析(CCA),否則選擇冗余分析(RDA)。數據分析時,所有物種數據均進行lg(x+1)轉化,通過這種轉化,降低稀有種對分析結果的影響。此外,除pH外的所有環境變量均進行lg(x+1)轉化。DCA是使用CANOCO 5進行的[1]。
數據用STATISTICA統計軟件包(verison 10.0)分析。在作進一步統計分析前,用Kolmogorov-Simirnov和Bartlet方法分別檢驗數據的正態性和方差同質性。Pearson相關分析用于評估浮游植物豐度與環境因子之間的關系,方差分析及后續的多重比較檢驗相關因子的季節差異,顯著性水平設為α=0.05。
2 結果
2.1 環境變量
方差分析結果顯示(表1),NH4-N和電導率季節差異不顯著。水溫季節差異顯著,從高到低依次為夏季、秋季、春季和冬季;冬季pH顯著低于春季、夏季和秋季,春季、夏季和秋季之間pH差異不顯著;春季DO顯著高于夏季、秋季和冬季,冬季DO顯著高于夏季和秋季,夏季和秋季之間差異不顯著;春季、冬季TN顯著高于夏季、秋季,春季和冬季之間差異不顯著,夏季、秋季之間差異不顯著;冬季NO3-N顯著高于夏季,春季和秋季NO3-N處于二者之間并無顯著差異;春季和夏季高錳酸鹽指數顯著高于冬季,秋季與其他季節差異不顯著;春季、夏季NO2-N顯著高于秋季、冬季,春季和夏季之間、秋季和冬季之間差異不顯著;秋季TP最高、冬季最低,春季和夏季處于二者之間;冬季透明度最高、春季最低,夏季和秋季處于二者之間。
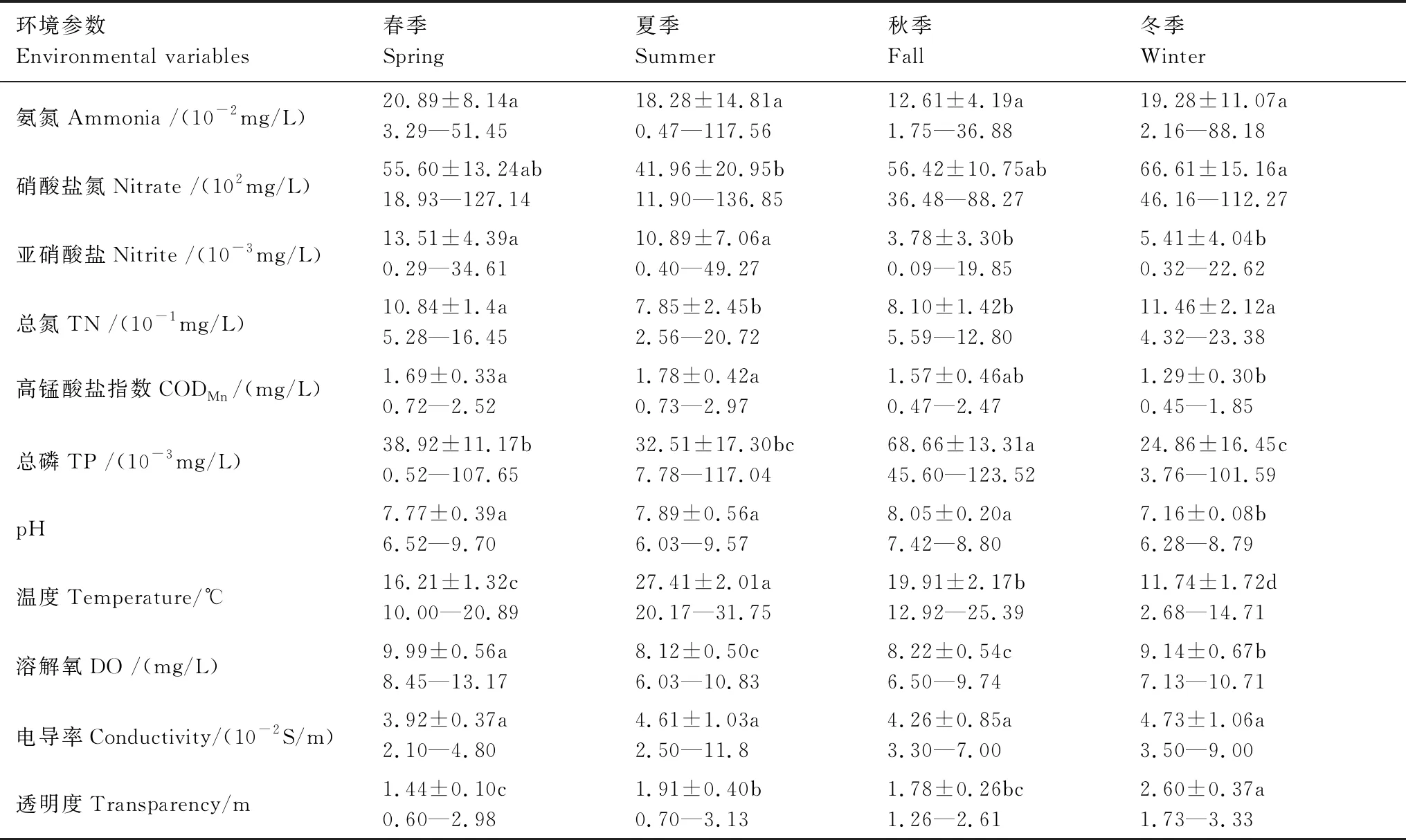
表1 環境因子季節比較(平均值±標準差)
2.2 浮游植物群落動態
2.2.1浮游植物群落組成
本研究共鑒定出浮游植物9門51種。種類最多的是綠藻門(18種)(35.29%),其次是硅藻門(15種)(29.41%)和藍藻門(11種)(21.57%),甲藻門、褐藻門、黃藻門、隱藻門、眼蟲藻門、金藻門分別各1種(1.96%)。
浮游植物年平均豐度為19.92×106個/L。平均豐度春季最高(35.14×106個/L),夏季和冬季次之(分別為19.13×106個/L,19.67×106個/L),秋季最低(5.74×106個/L)(圖2),但差異不顯著(P> 0.05)。春季藍藻門豐度最高(62.96%)、硅藻門次之(18.40%),夏季藍藻門豐度最高(71.03%)、綠藻門次之(11.93%),秋季硅藻門豐度最高(56.11%)、綠藻門次之(22.47%),冬季硅藻門豐度最高(80.74%)、隱藻門次之(13.69%)(圖3)。
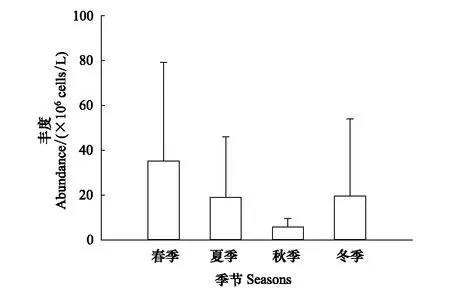
圖2 黃村水庫流域不同季節浮游植物豐度(平均值±標準差)
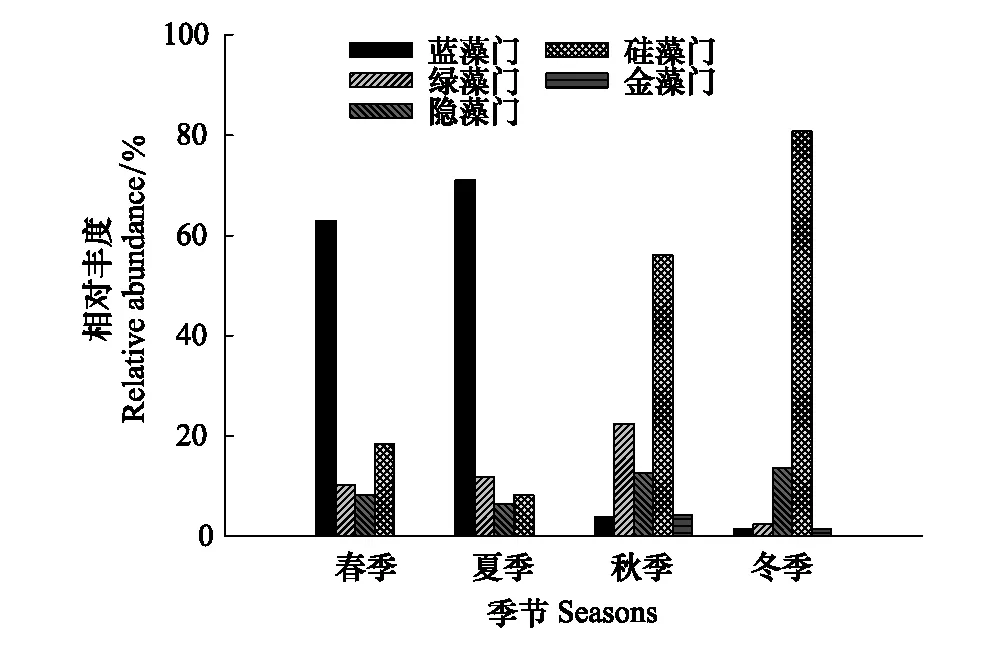
圖3 黃村水庫不同季節各門類浮游藻類相對豐度
2.2.2浮游植物優勢種
黃村水庫流域4個季節浮游植物優勢種及優勢度見表2。這些優勢種中,尖尾藍隱藻(Chroomonasacuta)和曲絲藻(Achnanthidiumsp.)在春夏秋冬季節均出現,其中曲絲藻是秋季優勢度最高的物種(表2)。除春季外,優勢種嚙蝕隱藻(Cryptomonaserosa)和小環藻(Cyclotellasp.)在其余3個季節均出現,其中小環藻是冬季優勢度最高的物種。春季和夏季,黃村水庫流域優勢度最高的物種均為偽魚腥藻(Pseudoanabaenasp.),且豐度最大。漂浮澤絲藻(Limnothrixplanctonica)在春夏季出現,浮游藍絲藻(Planktothrixsp.)在夏季出現,圓篩藻(Coscinodiscussp.)在秋冬季出現,針桿藻(Synedra)和雙對柵藻(Scenedesmusbiguga)在秋季出現,鈍脆桿藻(Fragilariacapucina)、異極藻(Gomphonema)和扁圓卵形藻(Cocconeisplacentula)在冬季出現。

表2 黃村水庫流域浮游植物優勢種及優勢度
2.2.3浮游植物多樣性指數
不同的生物多樣性指標可以以不同的方式表達浮游植物群落或組合的多樣性,但綜合利用這些指標是評價群落多樣性的最佳方法[17](圖4)。方差分析結果顯示,夏季物種數最多、秋季最低,春季和冬季處于二者之間;Shannon-Wiener指數季節差異不顯著;Margalef豐富度指數夏季最高、秋季最低,春季和冬季處于二者之間;Pielous均勻度指數冬季最高、春季最低,夏季和秋季處于二者之間。
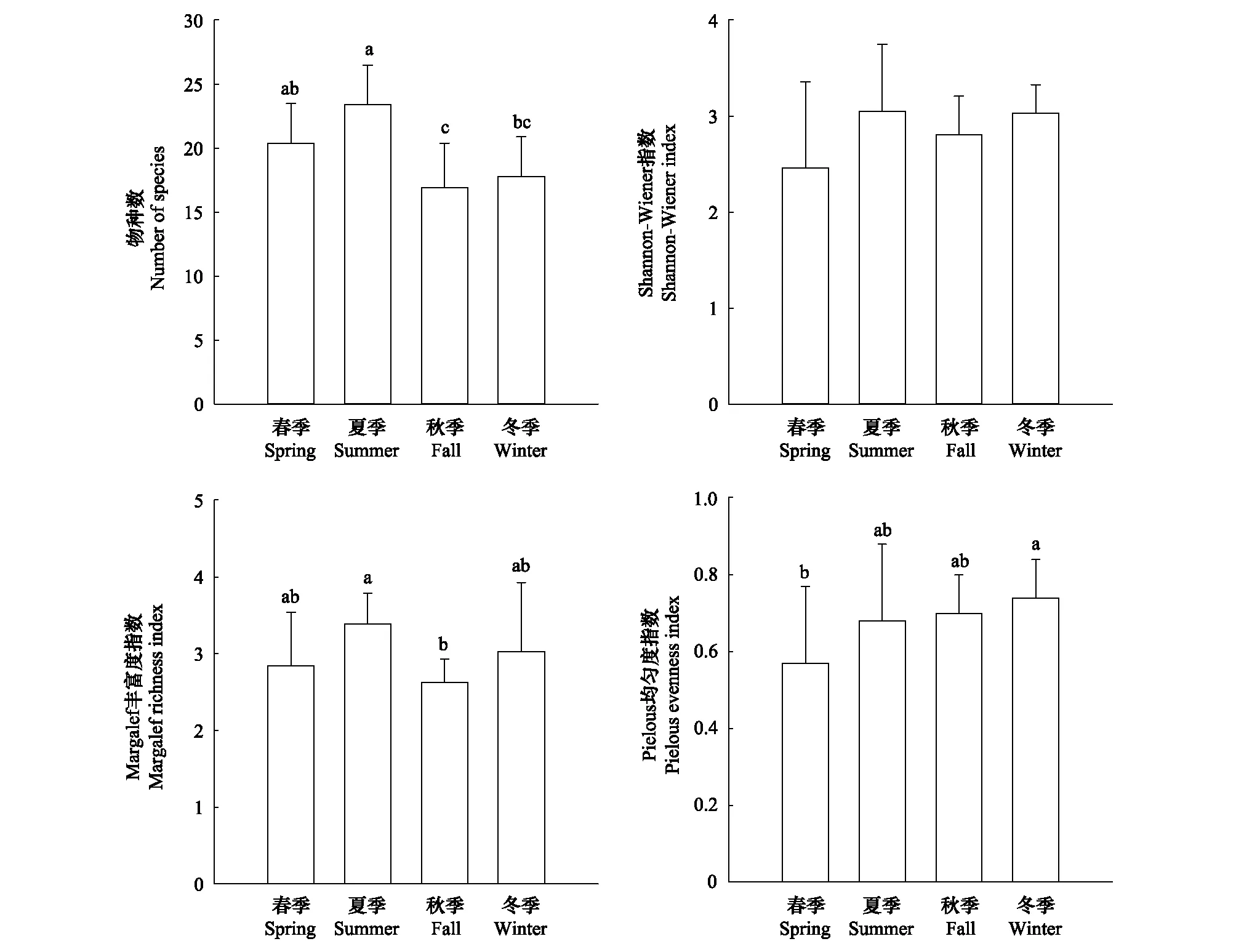
圖4 不同季節浮游藻類種類數和多樣性指數(平均值±標準差)
2.3 浮游植物群落與環境因子的關系
浮游植物豐度與環境因子相關性矩陣見表3。春季浮游植物總豐度與電導率呈顯著負相關(P=0.048);夏季浮游植物總豐度與高錳酸鹽指數呈顯著正相關(P=0.038);秋季浮游植物總豐度與高錳酸鹽指數(P=0.001)、pH(P=0.014)和溫度(P=0.012)呈顯著正相關,與電導率呈顯著負相關(P=0.022);冬季浮游植物總豐度與電導率(P=0.002)、NO3-N(P=0.024)呈顯著正相關,與溫度(P=0.008)呈顯著負相關。Pearson相關性表明,影響黃村水庫流域浮游植物群落的環境因子較為復雜,電導率、高錳酸鹽指數、溫度、pH和NO3-N是影響較大的環境因子。
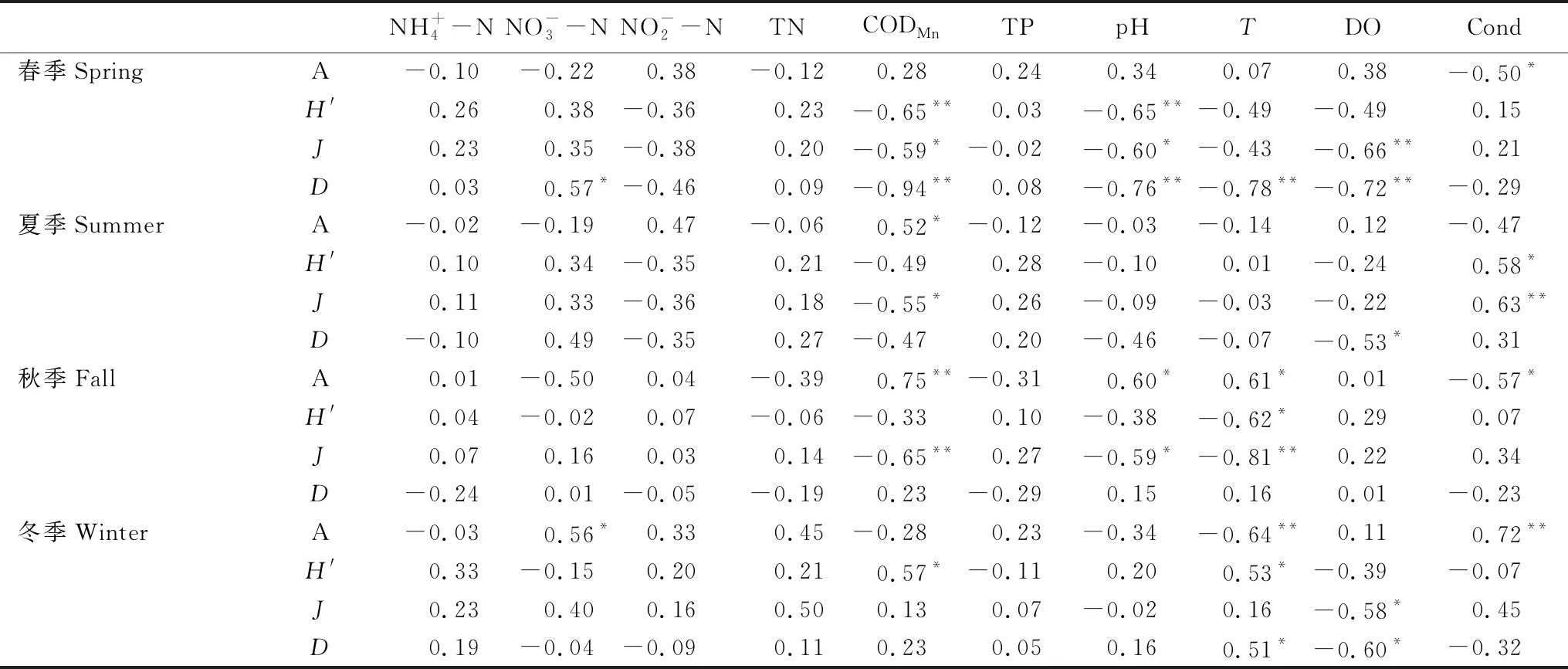
表3 浮游植物豐度與環境因子相關性矩陣
DCA表明,4個季節所有軸的梯度最大值均小于3,為線性排序模型。因此,直接梯度分析采用冗余分析(RDA)。在RDA中,利用蒙特卡羅置換檢驗方法,檢驗環境參數對RDA中浮游植物數據解釋的顯著性。蒙特卡羅檢驗結果表明,4個季節RDA排序圖第一軸與全部軸均呈顯著性差異(P< 0.05),表明排序結果是可信的。春季RDA排序圖如圖5所示,春季環境因子共解釋了89.00%的浮游植物群落總變量,軸Ⅰ和軸Ⅱ的特征值分別為0.87和0.02,累積解釋了88.93%的物種變化信息。春季RDA顯示漂浮澤絲藻、嚙蝕隱藻、尖尾藍隱藻、曲絲藻和衣藻(Chlamydomonas)與pH呈正相關,與氨氮呈負相關;色球藻(Chroococcussp.)和偽魚腥藻與亞硝酸鹽氮呈正相關,與電導率呈負相關。
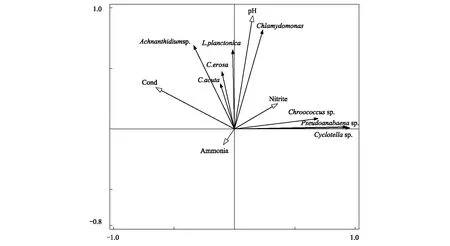
圖5 春季主要浮游植物和環境變量RDA排序圖
夏季RDA排序圖如圖6所示,夏季環境因子共解釋了59.50%的浮游植物群落總變量,軸Ⅰ和軸Ⅱ的特征值分別為0.51和0.07,累積解釋了58.22%的物種變化信息。與Pearson相關分析結果一致,夏季RDA顯示高錳酸鹽指數、pH和亞硝酸鹽氮是影響浮游植物群落分布的主要環境因子。浮游藍絲藻、四尾柵藻(Scenedesmusquadricauda)和銅綠微囊藻(Microcystisaeruginosa)等大多數藻類與高錳酸鹽指數呈正相關,與總氮呈負相關。
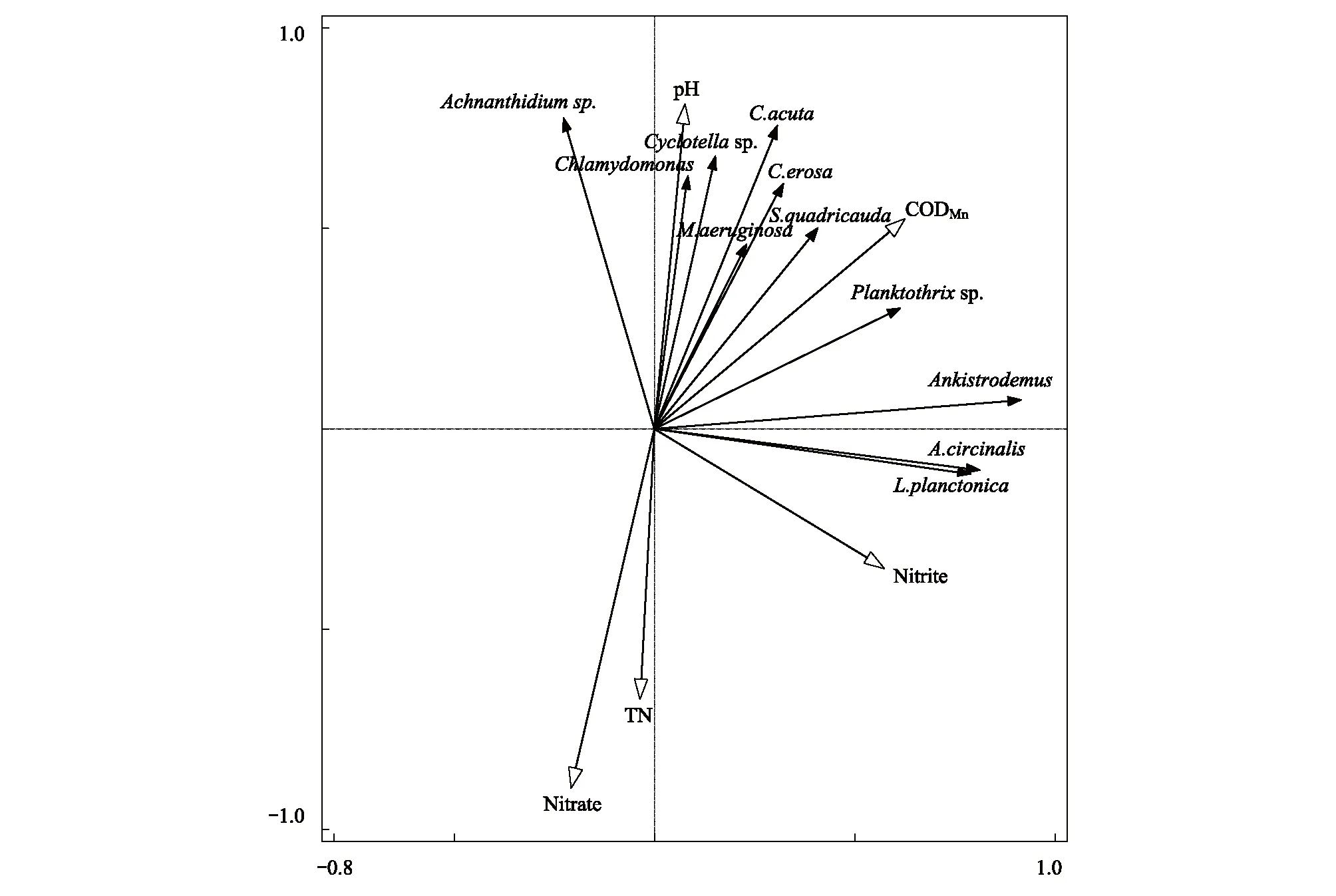
圖6 夏季主要浮游植物和環境變量RDA排序圖
秋季RDA排序圖如圖7所示,秋季環境因子共解釋了80.10%的浮游植物群落總變量,軸Ⅰ和軸Ⅱ的特征值分別為0.57和0.23,累積解釋了79.49%的物種變化信息。與Pearson相關分析結果一致,秋季RDA顯示高錳酸鹽指數、pH、溫度和電導率是影響浮游植物群落分布的主要環境因子。尖尾藍隱藻、嚙蝕隱藻和小環藻與高錳酸鹽指數呈顯著正相關,與電導率呈負相關;曲絲藻和衣藻與溫度和pH呈正相關,與電導率呈負相關。

圖7 秋季主要浮游植物和環境變量RDA排序圖
冬季RDA排序圖如圖8所示,選取的環境因子共解釋了65.50%的浮游植物群落總變量,軸Ⅰ和軸Ⅱ的特征值分別為0.56和0.08,累積解釋了64.36%的物種變化信息。與Pearson相關分析結果一致,冬季RDA顯示硝酸鹽氮、溫度和電導率是影響浮游植物群落分布的主要環境因子。舟形藻(Naviculasp.)、扁圓卵形藻和鈍脆桿藻與電導率和硝酸鹽氮呈正相關,與溫度呈負相關;鼓藻(Cosmarium)和橋彎藻(Cymbellasp.)與DO呈正相關,與溫度呈負相關。
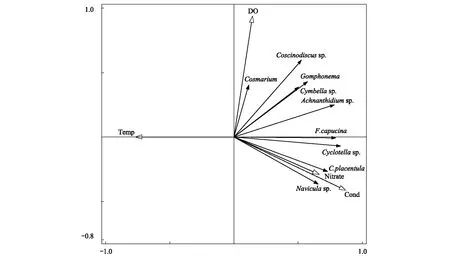
圖8 冬季主要浮游植物和環境變量RDA排序圖
3 討論
3.1 環境變量季節變化
本研究發現黃村水庫流域水質存在明顯的季節性模式,例如亞熱帶氣候導致水溫隨季節變化顯著。pH反映了水中可用于浮游植物光合作用的溶解無機碳的量[26],秋季pH超過8,原因可能是強烈的光合作用減少可以利用的CO2,使水體的pH增加[27]。在11月份和12月份分別測得最大TP和TN濃度,這可能歸因于流入的營養鹽和水庫沉積物釋放的營養鹽[28]。本研究夏季平均高錳酸鹽指數最高,平均溶解氧含量最低,表明研究區內有機負荷較高,這可能與周邊居民不良生產生活方式有關[11]。從水的透明度可以很好地預測淺層水庫的水清澈度和生態質量[29-30],黃村水庫流域春季水透明度最低,可能是由于整個水體的頻繁混合和松散沉積物的再懸浮造成的[31]。此外,溶解的有機物質也會對水的透明度產生影響[32]。
3.2 浮游植物群落動態
在黃村水庫流域觀察到浮游植物群落的季節變化,春季NH4-N、NO2-N和TN平均濃度高導致浮游植物平均豐度春季最高。在群落季節組成上,春季(62.96%)、夏季(71.03%)藍藻門豐度最高,黃村水庫流域在春夏季已出現局部水域藍藻水華,秋季(56.11%)、冬季(80.74%)硅藻門豐度最高,這與Wang等[33]對盛錦湖浮游植物群落結構變化的研究一致。
黃村水庫流域優勢種尖尾藍隱藻在春夏秋冬季節均出現,由于隱藻獨特的光合作用和輔助色素,其在低光條件下也能生長和繁殖[34]。此外,隱藻還具有鞭毛,能夠調節自身在水體中的位置以獲得最佳光照條件[35],因此在本研究期間廣泛存在。春夏季優勢度較高的優勢種偽魚腥藻、浮游藍絲藻和漂浮澤絲藻,主要是藍藻門,由于藍藻中存在的氣泡可以調節細胞的浮力,所以藍藻比其他浮游植物更耐光[36],如果光線較弱,氣泡則可以使藍藻細胞移到水面,如果光線較強,氣泡的作用是讓藍藻細胞移動到水底[2]。這種能力是藍藻作為一年生優勢種在春夏季廣泛分布的原因之一。秋冬季優勢度較高的圓篩藻、針桿藻、鈍脆桿藻、異極藻和扁圓卵形藻,均屬于硅藻門,這表明浮游植物優勢種從春夏季藍藻門向秋冬季硅藻門演替,Winder等[37]發現,在秋季水溫較低時,在湖泊和水庫中存在大量硅藻。
Shannon-Wiener指數、Margalef豐富度指數、Pielous均勻度指數等單變量物種多樣性指數被認為是識別浮游植物群落結構和指示生態系統健康的解釋參數[38]。物種多樣性指數的下降模式可能與某一特異性或多物種浮游植物水華形成有關[3],春季,有益的環境水質促進偽魚腥藻的增殖(占春季浮游植物總豐度的57.10%),導致物種多樣性指數下降。浮游植物多樣性指數在夏季表現出較高的值,表明浮游植物群落由更多物種主導,這與我們的觀測結果相一致。此外,浮游植物多樣性指數也被用來評估湖泊和水庫的營養狀況[39-40]。高多樣性指數表示生態系統健康,而低值表示生態系統不健康或退化[41]。在富營養化湖泊水庫中,Shannon-Wiener指數通常在0—1之間,在中-富營養化湖泊水庫中,Shannon-Wiener指數通常在1—2之間,在中營養化湖泊水庫中,Shannon-Wiener指數通常在2—3之間,在寡營養湖泊水庫中,Shannon-Wiener指數通常大于3[1,42]。在該研究中,Shannon-Wiener指數年平均值為2.84,表明水體處于中營養狀態,因此,黃村水庫可歸類為中營養化水庫。
3.3 浮游植物群落結構對環境水質的響應
浮游植物的生長和分布很大程度上取決于環境變量的影響[43]。Pearson相關分析顯示,溫度和營養鹽是影響較大的環境因子。溫度對不同的浮游植物分類群產生物種特異性影響[44],影響大多數浮游藻類的生長和繁殖速率[45],導致浮游植物群落組成的變化。通常認為較高的溫度有利于綠藻門和藍藻門的生長和繁殖[46-47],當水溫升高到25℃以上時,藍藻達到最大生長速率,當春季和夏季水溫大幅上升時,它們的細胞豐度會迅速增加,相反,硅藻喜歡較冷的水[35],秋冬季水溫相對較低并伴隨著水體熱分層的破壞[1],水體混合完全,硅藻通常會興盛,因為它們沉重的硅質細胞壁會導致它們在熱分層過程中下沉[37]。Turner等[48]研究發現,硅藻的豐度與溫度呈反比關系,在低于18℃的溫度下,硅藻的豐度較高。在本研究中,夏季藍藻占71.03%,冬季硅藻占80.74%,這與Abirhire等[35]和Turner等[48]的研究結果相一致。
與Pearson相關分析結果一致,RDA結果顯示黃村水庫流域中的浮游植物群落受水溫、DO、pH和高錳酸鹽指數的調控。在春季,浮游植物群落中以偽魚腥藻為主,與NO2-N和pH呈正相關,與NH4-N和電導率呈負相關,表明浮游植物群落受到綜合因素的影響。夏季水體出現銅綠微囊藻,本文數據表明與DO呈顯著正相關,與TN、TP呈負相關,Varol[1]認為與水溫、DO和高錳酸鹽指數呈正相關,與TN,NO3-N,DIN和TP呈負相關,該物種也出現在土耳其Arancio湖[49],Charzykowskie湖[50]以及Glebokie湖[51]。除春季外,優勢種小環藻在其余2個季節均出現,是冬季優勢度最高的物種,與TP和TN呈負相關,表明其在低營養鹽濃度下也能快速生長,這與Yuan[10]等人的研究結果一致。
4 結論
在這項研究中,共鑒定出51種浮游植物,分屬于9門和41屬,其中綠藻門占總物種數的35.29%,硅藻門、藍藻門分別占29.41%和21.57%。夏季浮游植物種類最多,秋季最少。從浮游植物群落季節組成來看,春季豐度最高,秋季豐度最低,春夏季藍藻門豐度最高,秋冬季硅藻門豐度最高。黃村水庫流域優勢種尖尾藍隱藻和曲絲藻在春夏秋冬季節均出現,春季和夏季偽魚腥藻優勢度最高,秋季曲絲藻優勢度最高,冬季小環藻優勢度最高。Shannon-Wiener指數年平均值為2.84,表明該流域水體處于中營養狀態。Pearson相關分析和冗余分析(RDA)顯示,溫度、電導率和營養鹽是影響浮游植物群落組成最主要的環境因素。

