RepSox對X射線輻照后血管內皮細胞ALK5表達的抑制作用
馮俊博,程永波
(新疆醫科大學第一附屬醫院消化一科,烏魯木齊 830000;*通訊作者,E-mail:chengyb2001@163.com)
放射治療是治療惡性腫瘤常用手段之一,但是在殺滅癌細胞的同時,對正常的血管內皮細胞也會產生不良影響,醫學上稱為放射性血管損傷,血管內皮細胞的纖維化是其主要的病理特征[1,2]。可以肯定的是,由轉化生長因子TGF-β所介導的TGF-β-ALK5-Smad2/3信號通路與內皮細胞的纖維化有著密切的聯系[3]。已有文獻報道,TGF-β1可作為誘導劑激活細胞內的TGF-β-Smad2/3信號通路,誘導內皮細胞間充質轉化(EndoMT)的發生,最終導致內皮細胞纖維化[4-6]。但是就目前而言,對于該通路的上游靶點TGF-βⅠ型受體ALK5的相關研究較少,它作為一種絲氨酸-蘇氨酸激酶,存在于細胞膜上。本研究提出假設,當使用X射線輻照內皮細胞后,細胞膜上的ALK5被激活,從而誘導下游的Smad2/3發生磷酸化,調控整個纖維化的進程。因此,研究輻照后內皮細胞ALK5的表達變化以及使用RepSox(一種ALK5選擇性抑制劑)進行干預,有助于我們深入地了解輻照后內皮細胞發生纖維化與該信號通路的聯系,為防治放射性血管損傷提供新的靶點和理論依據。
1 材料與方法
1.1 材料
1.1.1 主要試劑 ECM培養基購自美國ScienceCell公司;CCK-8試劑盒購自中國Biosharp公司;RIPA裂解液購自中國Solarbio公司;PMSF蛋白酶抑制劑購自中國Solarbio公司;BCA蛋白定量試劑盒購自美國Thermo公司;SDS-PAGE凝膠制備試劑盒購自中國Solarbio公司;ALK5、p-Smad2/3一級抗體購自英國Abcam公司;GAPDH一級抗體購自中國博奧森公司;二級抗體購自中國博奧森公司;熒光二級抗體Alexa Fluor 594購自中國中杉金橋公司;ReverAid First Strand cDNA Synthesis Kit購自美國Thermo公司;TB Green Premix Ex Taq購自日本Takara公司;RepSox購自美國MCE公司。
1.1.2 主要儀器 酶標儀購自美國Bio-Rad公司;熒光倒置顯微鏡購自日本Olympus公司;實時熒光定量PCR儀購自美國Thermo公司;化學發光儀購自美國Bio-Rad公司;Varian cx直線加速器購自美國Varian公司。
1.2 方法
1.2.1 細胞培養與輻照 人臍靜脈內皮細胞細胞株HUVEC購自中國上海賽百慷生物技術股份有限公司。將HUVECs分為對照組、輻照組(IR)和RepSox干預組(IR+RepSox),使用內皮細胞培養基ECM(含5%胎牛血清、1%內皮細胞生長因子和1%雙抗)進行培養,于37 ℃,5%CO2培養箱中生長,細胞密度80%傳代。輻照前24 h進行細胞計數并均勻鋪板。待細胞貼壁后,RepSox干預組加入濃度為1 μmol/L的RepSox,對照組和輻照組同時更換ECM培養基。干預24 h后使用Varian cx直線加速器X線(6 MV)照射輻照組和RepSox干預組,總劑量7 Gy。置于培養箱中繼續培養,于輻照后24 h進行后續實驗。
1.2.2 CCK-8檢測細胞增殖 將對數生長期的細胞均勻鋪至96孔板中,每孔細胞約3×103個。待細胞貼壁后,RepSox干預組分別加入濃度為1,5,10,20,40 μmol/L的RepSox 200 μl,對照組和輻照組加入等體積的ECM培養基。然后使用X線照射輻照組和RepSox干預組,于輻照后24,48 h向各組中加入CCK-8工作液20 μl,1 h后用酶標儀測量每個孔在波長450 nm處的吸光度(OD值)。
1.2.3 Western blot檢測ALK5和p-Smad2/3蛋白表達水平 將輻照后24 h的細胞用RIPA裂解液提取總蛋白;用BCA法測定蛋白濃度;進行電泳、轉膜、封閉、抗體孵育(一抗:ALK5 1 ∶1 000;p-Smad2/3 1 ∶1 000;GAPDH 1 ∶5 000;二抗:1 ∶5 000)和ECL試劑顯色。使用化學發光儀和Image Lab軟件分析條帶灰度值。
1.2.4 免疫熒光法檢測ALK5蛋白表達水平 將細胞均勻鋪至共聚焦皿中,每個皿中細胞約3×104個。輻照后24 h加入4%多聚甲醛室溫固定30 min,山羊血清工作液室溫封閉1 h,并加入一抗4 ℃孵育過夜(ALK5 1 ∶200)。次日二抗室溫孵育2 h(Alexa Fluor 594 1 ∶200),使用DAPI試劑染色15 min。使用熒光顯微鏡成像和ImageJ圖像合成,ALK5表現為紅光,細胞核表現為藍光。
1.2.5 qRT-PCR檢測ALK5、Smad2、Smad3 mRNA表達水平 輻照后24 h用Trizol提取mRNA,OD260/OD280為1.8-2.0;按試劑說明書將mRNA逆轉錄為cDNA(基因引物序列見表1);將合成的cDNA進行實時熒光定量。結果分析采用比較Ct法計算各樣本間基因表達差異,最終結果用2-ΔΔCt表示。

表1 目的基因引物序列Table 1 Primer sequence of target genes
1.3 統計學方法
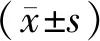
2 結果
2.1 輻照后細胞增殖情況
輻照后24 h和48 h,與對照組比較,輻照組細胞數量明顯降低(P<0.05)。與輻照組比較,1 μmol/L RepSox干預組細胞數量升高(P<0.05),5,10,20,40 μmol/L RepSox干預組細胞數量降低(P<0.05)。故選擇RepSox濃度1 μmol/L進行后續實驗(見圖1,2)。

與對照組比較,*P<0.05;與輻照組比較,#P<0.05圖1 不同濃度RepSox干預下輻照后24 h內皮細胞增殖情況Figure 1 Proliferation of endothelial cells at 24 h after irradiation under different concentrations of RepSox

與對照組比較,*P<0.05;與輻照組比較,*P<0.05圖2 不同濃度RepSox干預下輻照后48 h內皮細胞增殖情況Figure 2 Proliferation of endothelial cells at 48 h after irradiation under different concentrations of RepSox
2.2 輻照后24 h蛋白表達情況
與對照組比較,輻照組ALK5、p-Smad2/3蛋白表達量均上調(P<0.05)。與輻照組比較,RepSox干預組ALK5、p-Smad2/3蛋白表達量均下調(P<0.05,見圖3)。使用總劑量為7 Gy的X射線照射血管內皮細胞24 h,輻照組ALK5蛋白表達量較對照組上調了113%;p-Smad2/3蛋白表達量較對照組上調了194%。在輻照前加入RepSox進行干預,RepSox干預組ALK5蛋白的表達量較輻照組下調了35.6%;p-Smad2/3蛋白的表達量較輻照組下調了13.6%。

與對照組比較,*P<0.05;與輻照組比較,#P<0.05圖3 輻照后24 h內皮細胞ALK5、p-Smad2/3蛋白表達Figure 3 Expression of ALK5 and p-smad2/3 proteins in endothelial cells 24 h after irradiation
2.3 輻照后24 h mRNA表達情況
與對照組比較,輻照組ALK5、Smad2、Smad3 mRNA表達量均上調(P<0.05)。與輻照組比較,RepSox干預組ALK5、Smad2、Smad3 mRNA表達量均下調(P<0.05,見圖4)。使用總劑量為7 Gy的X射線照射血管內皮細胞24 h后,輻照組ALK5 mRNA表達量較對照組上調了56.2%;Smad2 mRNA表達量較對照組上調了86%,Smad3 mRNA表達量較對照組上調了79.5%。RepSox干預組ALK5 mRNA的表達量較輻照組下調了29.1%;Smad2 mRNA的表達量較輻照組下調了29.7%,Smad3 mRNA的表達量較輻照組下調了17.1%。

與對照組比較,*P<0.05;與輻照組比較,#P<0.05圖4 輻照后24 h內皮細胞ALK5、Smad2、Smad3 mRNA表達Figure 4 The expression of ALK5,Smad2,Smad3 mRNA in endothelial cells 24 h after irradiation
2.4 輻照后24 h細胞免疫熒光
與對照組比較,輻照組ALK5蛋白表達上調。與輻照組比較,RepSox干預組ALK5蛋白表達下調(見圖5)。

圖5 輻照后24 h內皮細胞ALK5熒光表達量Figure 5 The fluorescence expression of ALK5 in endothelial cells 24 h after irradiation
3 討論
放射性血管損傷是癌癥患者長期放療的嚴重并發癥之一,血管內皮細胞在輻照后獲得持久的促凝劑和抗纖溶表型,進而發生纖維化[1]。因此進行輻照后內皮細胞發生纖維化的分子機制研究,是防治放射性血管損傷的重要基礎。
本研究發現,使用總劑量為7 Gy的X射線照射血管內皮細胞24 h后,輻照組ALK5 mRNA表達量較對照組上調了56.2%,ALK5蛋白表達量較對照組上調了113%;Smad2 mRNA表達量較對照組上調了86%,Smad3 mRNA表達量較對照組上調了79.5%,p-Smad2/3蛋白表達量較對照組上調了194%。通過上述結果表明,輻照可以激活內皮細胞中的TGF-β-ALK5-Smad2/3信號通路。而ALK5作為纖溶酶原激活物抑制劑-1(PAI-1)的功能性TGF-βⅠ型受體,調控著核心蛋白Smad3的磷酸化,是位于該信號通路上游的閥門,因此它的上調是輻照后內皮細胞發生纖維化的重要基礎[7]。關于ALK5表達量上調的原因,本研究認為TGF-β1的釋放與之密切相關。現已證實,當潛在相關TGF-β1釋放肽(latency-associated peptide,LAP)和潛在TGF-β結合蛋白(latent TGF-β-blinding protein,LTBP)暴露于各種因素時,如強酸、ROS(活性氧)和血纖維蛋白溶酶等,將釋放出TGF-β1[8]。而輻照可能扮演著與上述暴露因素相似的角色,它促進了血管內皮細胞TGF-β1的釋放,后者作為誘導劑激活了TGF-β-Smad2/3信號通路。本研究從分子機制層面證實了輻照激活了內皮細胞中的TGF-β-Smad2/3信號通路,是導致血管纖維化損傷的重要機制。
在輻照前加入RepSox進行干預,RepSox干預組ALK5 mRNA的表達量較輻照組下調了29.1%,ALK5蛋白的表達量較輻照組下調了35.6%;Smad2 mRNA的表達量較輻照組下調了29.7%,Smad3 mRNA的表達量較輻照組下調了17.1%,p-Smad2/3蛋白的表達量較輻照組下調了13.6%。這一結果說明了RepSox對ALK5及其下游的Smad2/3有抑制作用,ALK5、p-Smad2/3的表達量均呈現下調。因此可以認為RepSox對于輻照后所引起的血管內皮細胞的放射性損傷具有一定的保護作用。就目前而言,對于纖維化防治靶點這方面的研究是具有顯著意義的,因為對于纖維化這一病理現象尚無明確統一的治療策略。在一些研究中證明,使用可溶性的TGFβRII蛋白片段和TGF-β中和抗體可以有效抑制TGF-β的促纖維化作用[9]。而對ALK5的探究,是對纖維化防治方案的一種重要補充,并提供了新的基因靶點和理論依據,為后續靶向治療的相關研究打下重要基礎。
在接下來的研究中,我們將測定輻照后TGF-β1的釋放量,通過體內實驗探求輻照后內皮細胞和ALK5之間的聯系,進一步深入了解ALK5在纖維化形成過程中的分子機制。同時將其下游的Smad2、Smad3、Smad7等基因和蛋白作為潛在的抑制靶點進行研究,為防治放射性血管損傷提供新的基因靶點和理論依據。

