TRPA1 抑制劑的高通量篩選及新型骨架的發現
丁強
(上海璃道醫藥科技有限公司,上海 201114)
TRPA1 是瞬時受體電位通道超家族中的一員[1],作為一種非選擇性陽離子通道,可通透Na+,K+和Ca2+等[2]。TRPA1 主要分布在背根神經、三叉神經等初級感覺神經元上,且在肽能和非肽能神經元均有表達[3]。從分布的人體系統來看,TRPA1 高表達在外周感覺神經系統、呼吸系統、胃腸系統和泌尿系統[4],當這些器官組織出現功能異常時,TRPA1 通道的表達和功能通常也同步發生異常。TRPA1 可感受多種不同類型的刺激,如低溫、內/外源性化合物和機械性刺激等[5,6],并參與機體的炎癥和免疫反應[7]。基因學證據表明TRPA1 發生基因突變可導致人類疼痛[8],且藥理學實驗也證明TRPA1 通道的抑制劑可在多種不同的疼痛模型上有效鎮痛[9,10]。此外,TRPA1 激活還可導致呼吸系統障礙[11],如咳嗽、哮喘和慢性阻塞性肺病[12,13]。
TRPA1 作為確定的鎮痛和鎮咳新靶點,近年來國際上各大制藥公司都在圍繞TRPA1 通道進行創新藥物研發和布局,但尚無小分子被批準上市[14]。黃嘌呤衍生物HC030031 是TRPA1 的經典抑制劑,在小鼠模型中通過靜脈注射可以緩解緩激肽引起的觸覺異常痛敏,口服可減輕異硫氰酸烯丙酯(AITC)誘導的疼痛,在炎癥模型中表現出抗炎活性[15];霧化吸入可以減輕豚鼠模型中丙烯醛或者肉桂醛引起的咳嗽,同樣對哮喘模型也有效[16]。GRC-17536 是格倫馬克推進到臨床2 期的TRPA1 抑制劑,適應癥為糖尿病性周圍神經痛和呼吸系統疾病[17]。該分子已經在捷克、德國和英國等國家完成概念性驗證實驗,效果顯著,且無明顯副作用,目前還在積極推動中。除此之外,禮來、羅氏、雅培、安進、諾華和阿斯利康等均布局了TRPA1 抑制劑的專利[18]。面對這一國際研發新趨勢,國內尚缺乏靶向TRPA1 通道的藥物研發管線,顯著落后于國際研發進度。
本研究利用自動化高通量篩選系統和手動膜片鉗檢測技術,靶向TRPA1 通道,對自建的已上市藥物樣品庫進行抑制活性篩選,發現多種不同特性的三環類分子具有明顯的TRPA1 抑制活性,且結構呈現一定的規律性。在已報道的TRPA1 抑制劑中,還沒有三環類骨架,本研究將為TRPA1 抑制劑的藥物研發提供新的骨架結構。
1 材料與方法
1.1 試劑
AITC 購自Sigma;HC030031 由Biobond 制藥公司合成;酮替芬和苯噻啶蘋果酸酯購自九鼎化學;米安色林和米氮平購自畢得醫藥;奧氮平購自安耐吉化學。
細胞培養用的DMEM培養基、滅瘟素、潮霉素B、1%青霉素- 鏈霉素溶液和胎牛血清購自Invitrogen;0.25%胰酶溶液購自Life technologies;強力霉素購自Sigma。
1.2 儀器設備
細胞培養箱和超凈臺購自Thermo fisher;超低溫冰箱購自浙江和利制冷設備有限公司;精密電子天平和pH 測量儀購自Sartorius;IonWorks Barracuda 高通量篩選系統購自美國Molecular Devices;Axon700B 手動膜片鉗系統購自美國AXON;電極拉制儀購自美國Sutter;快速程控壓力給藥系統購自法國Bio-Logic。
1.3 方法
1.3.1 構建穩轉細胞株
將小鼠源TRPA1(mTRPA1)通道的cDNA 全長亞克隆到pcDNATM5/FRT/TO 質粒中,整合后的質粒克隆到Flp-InTM-293宿主細胞,使用滅瘟素和潮霉素B 進行壓力篩選,得到穩定表達mTRPA1 通道基因的穩轉細胞系。
1.3.2 細胞培養
mTRPA1 穩轉細胞培養基含有90% DMEM+10%胎牛血清+1%青霉素- 鏈霉素+15μg/mL 滅瘟素+200μg/mL 潮霉素B。細胞置于培養瓶中,放入37℃、5% CO2的無菌培養箱,待細胞密度達到80%左右進行傳代或鋪板。需要檢測時,穩轉細胞經強力霉素誘導過表達mTRPA1 通道。
1.3.3 手動全細胞膜片鉗檢測
電流記錄采用Axon700B 膜片鉗放大器,信號采集使用pClamp10 軟件,采樣頻率10 kHz,濾波2 kHz,電極電阻2~4 MΩ。細胞鉗制在0 mV,電壓刺激命令是一個-100 mV 到+100 mV 的斜坡電壓,時程300 ms,每2 s 給予一個電壓刺激。化合物是由快速程控壓力給藥系統給予細胞。外液(mM):140 NaCl, 5 KCl, 1 MgCl2, 10 HEPES, 0.5 EGTA, 10 Glucose (pH 7.4);內液(mM):140 CsCl, 10 HEPES, 5 EGTA, 0.1 CaCl2, 1 MgCl2(pH 7.2)。
1.3.4 IonWorks Barracuda(IWB)高通量篩選
刺激電壓和內外液成分與手動膜片鉗檢測相同,但內液中加入0.1 mg/mL 膜穿孔試劑兩性霉素B。在PPC384 孔板中加入細胞外液,PPC 板下加入細胞內液,進行封接測試,最后將細胞內液換成含兩性霉素B 的細胞內液,使封接的細胞穿孔后形成全細胞記錄模式。數據記錄和電流幅度測量導出由IWB 軟件完成(version 2.5.3,Molecular Devices Corporation,Union City,CA)。封接阻抗低于20 MΩ 的孔將不納入數據統計。原始電流數據由軟件進行漏減矯正,mTRPA1 電流幅度在+100 mV 時測得。
2 結果
2.1 mTRPA1 穩轉細胞株的構建和活性驗證
mTRPA1 的cDNA 經標準操作流程整合到宿主細胞Flp-InTM-293 的染色體后,經過15 μg/mL 滅瘟素和400 μg/mL 潮霉素B 的壓力篩選,得到mTRPA1 基因穩定傳代的細胞株。為了確認穩轉細胞株能否表達有活性的mTRPA1 通道,我們使用1 μg/mL 強力霉素誘導,并應用手動膜片鉗進行驗證(圖1)。AITC 和HC030031(HC)分別是TRPA1 通道的經典激動劑和抑制劑。檢測結果顯示,AITC 可誘導出明顯的通道電流,且電流呈現典型的TRPA1 通道特點,即外向整流、可被HC030031抑制和反轉電位0 mV。
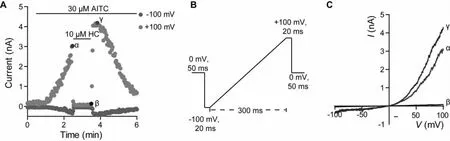
圖1 手動膜片鉗驗證mTRPA1 穩轉細胞株的活性
2.2 已上市藥物樣品庫的構建及TRPA1 抑制劑的高通量篩選
目前,有許多靶向TRPA1 通道的藥物研發,但尚無小分子被批準上市。我們建立了大樣本量的已上市藥物樣品庫,化合物總數超過2000 個,含有多種不同類型的化學結構,其適應癥包括胃腸道疾病、老年癡呆、疼痛、尿失禁、抑郁、鎮咳、降血壓、抗組胺、抗過敏、抗精神病和催吐等。我們采用IWB 高通量篩選平臺,結合mTRPA1 穩轉細胞株,對已上市藥物樣品庫的mTRPA1 抑制活性進行全面評價。此平臺是基于電流檢測,因此相關評價更直觀和精確,檢測結果如圖2 所示,多種化合物均呈現mTRPA1 抑制活性。

圖2 TRPA1 抑制劑的篩選流程和高通量篩選匯總
2.3 具有mTRPA1 抑制活性的三環類骨架分子
對IWB 高通量篩選得到的具有mTRPA1 抑制活性的化合物進行結構分析,我們發現在已上市藥物樣品庫中,多個三環類分子具有明顯的mTRPA1 抑制活性,且結構呈現出一定的規律性,其化學結構和抑制IC50(μM)如圖3 所示。根據臨床應用,這些三環類分子分別具有抗抑郁、抗精神病和抗組胺等特性。

圖3 具有mTRPA1 抑制活性的三環類分子結構
2.4 確證若干三環類分子的mTRPA1 抑制活性
在IWB 高通量篩選中,米安色林、米氮平、奧氮平、乙酰哌普嗪、酮替芬和苯噻啶蘋果酸酯的抑制活性較強。我們采用手動膜片鉗進一步確認這些三環類分子的活性,并檢測其劑量效應。如圖4 所示,上述三環類分子在手動膜片鉗系統中的抑制IC50與高通量篩選結果基本一致,進一步確認了這些三環類分子的mTRPA1 抑制活性,且驗證了IWB 高通量篩選系統的精確性。
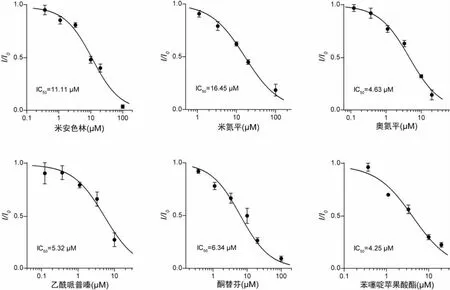
圖4 手動膜片鉗驗證若干三環類分子的TRPA1 抑制活性
3 討論
TRPA1 作為一種可通透Na+,K+和Ca2+的非選擇性陽離子通道,近年來在藥物研發領域受到越來越多的關注,尤其是疼痛。TRPA1 通道是最具潛力的新型鎮痛靶點,主要有以下特點:(1)安全性高:TRPA1 通道主要分布于外周,在中樞神經系統和心臟中的表達豐度很低[4],極大降低了其中樞和心臟副作用的風險,與其它靶點相比顯示出極大優越性,且針對外周靶點開發鎮痛藥物是當前鎮痛藥物研發的重要趨勢。而且,TRPA1 是人TRPA 亞家族中的唯一成員,減少了通道特異性的風險。(2)TRPA1 通道與人疼痛關系明確:TRPA1 是明確的人疼痛感受器,其基因突變可導致人類疼痛,具有明確的基因學證據支持TRPA1 通道,符合藥物靶點的主流理論。(3)已有TRPA1 抑制劑鎮痛效應優異:目前已有數個小分子化合物進入了臨床I 期和II 期研究,主要用于治療糖尿病性神經痛和急性疼痛,如GRC-17536 和CB-625,且GRC-17536 的鎮痛效應已經經過概念性驗證。此外,許多臨床前動物藥效實驗也證明,TRPA1 抑制劑對多種傷害性疼痛、內臟痛、神經痛和纖維肌痛均有較好的鎮痛活性,表明TRPA1 靶點存在廣譜的鎮痛效應。同時,TRPA1的功能改變還可導致呼吸系統和胃腸道系統的異常,因此,TRPA1 靶點的適應癥具有廣闊的開發前景。
國內由于缺乏高通量篩選平臺和新型骨架結構,對TRPA1通道靶點的布局與國外相比嚴重滯后。本研究通過構建mTRPA1 穩轉細胞株和超過2000 個化合物的已上市藥物樣品庫,利用基于電流檢測的IWB 高通量篩選系統和手動膜片鉗,發現了眾多具有TRPA1 抑制活性的化合物。通過結構分析,我們發現一系列具有三環類骨架的分子均具有明顯的TRPA1 抑制活性,且結構呈現一定的規律性。三環類分子是臨床上的一類重要藥物,具有抗抑郁、抗組胺、抗精神疾病或抗過敏等活性。有趣的是,臨床上很多三環類分子還可用于鎮痛,如抗抑郁藥阿米替林可用于纖維肌痛綜合征和糖尿病性周圍神經痛的治療,但其確切機制通常并不清晰。本研究可能為臨床上多種三環類分子拓展鎮痛適應癥提供理論基礎。
三環類骨架作為TRPA1 通道的抑制劑尚未被報道,通過系統的構效關系優化,可能找到抑制活性更強且具有全新結構類型的TRPA1 抑制劑,并針對TRPA1 的相關適應癥進行生物活性驗證,從而找到合適的候選化合物。本研究的發現將為國內靶向TRPA1 通道進行新藥研發提供新型骨架分子做出有益探索。

