基于錳摻雜硫化鋅量子點磷光信號增強快速標定多粘菌素B的研究
楊佳佳, 趙 禹
山西師范大學生命科學學院, 山西 臨汾 041000
多粘菌素B (polymyxin B,PMB)是從多粘芽胞桿菌中分離得到的一種陽離子多肽類抗生素,因具有高效的抗菌活性而廣泛用于泌尿系統感染、腦膜炎及皮膚粘膜感染等疾病的治療.然而,在醫學使用過程中PMB劑量控制不當會造成人體急性腎損傷、皮膚色素沉著等副作用[1],因此,口服及注射PMB時一般需要嚴格的劑量控制.目前可用于PMB測定的方法主要有高效液相色譜-質譜法[2]、毛細管電泳法[3]、化學發光酶免疫分析法[4]等.由于PMB較低的紫外吸收且無本底熒光,用于檢測PMB的常規方法一般較為復雜.因此,在醫學使用PMB的過程中急需一種能快速檢測PMB的方法.近年來,新型納米光學材料相繼涌現,為各種傳感與檢測方法的構建提供了良好的基底材料.量子點作為一種典型的納米光學材料,因具備優良的熒光或磷光性能而備受廣大學者青睞,相應地,各種熒光、磷光量子點的類型也日趨豐富[5~7].相比于各種熒光量子點,磷光量子點因可有效規避生物基質中自體熒光的干擾從而非常適用于復雜生物樣品基質中目標分子的檢測,典型的如:錳摻雜硫化鋅量子點.目前,以錳摻雜硫化鋅量子點為基底材料,基于聚集誘導、電子轉移、能量共振轉移等多種磷光信號響應策略也成功應用于各種目標分子傳感與檢測體系的構建[6],這些策略為各種目標物檢測體系的構建提供了詳盡的技術依據.
鑒于PMB醫學使用過程中劑量標定的現實需求,本研究以錳摻雜硫化鋅量子點為光學材料,嘗試以磷光信號增強為檢測體系構建策略,建立一種可快速檢測和標定PMB的方法,并考察所建立方法的選擇性與實際應用性能,以期為PMB醫藥制劑及其在醫學使用過程中的劑量控制提供一種便捷的檢測方法.
1 材料與方法
1.1 試劑與儀器
多粘菌素B(PMB)購于生工生物工程(上海)股份有限公司;3-巰基丙酸(MPA)、Zn2·Ac·2H2O、Mn2Ac·4H2O、Na2S·9H2O 購于北京百靈威科技有限公司;注射用硫酸多粘菌素B購自上海第一生化制藥有限公司;其它所用試劑均為分析純.
MPA包覆的錳摻雜硫化鋅量子點溶液及反應溶液的磷光(RTP)強度通過Cary Eclipse型熒光分光光度計進行測定,激發波長與發射波長狹縫均設置為10 nm;MPA包覆的錳摻雜硫化鋅量子微觀形貌通過JEM-1 200EX 透射電鏡進行表征;使用Shimadzu UV-29 100分光光度計進行UV-vis吸收光譜分析;量子點及PMB表面電勢通過Zetasizer Nano ZS90 納米粒度儀進行測定;溶液pH值采用PHS-3C pH計測定.
1.2 方法
1.2.1 量子點合成
MPA包覆的錳摻雜硫化鋅量子點(簡寫為QDs)根據文獻報道合成[8],在250 mL圓底燒瓶中依次加入0.1 mol·L-1的Zn2·Ac溶液5 mL、0.01 mol·L-1的Mn2Ac 溶液2 mL、0.04 mol·L-1的MPA 50 mL,充分混勻后,用1.0 mol·L-1的NaOH溶液調節溶液pH至11.0,在氮氣氛圍中于室溫下反應30 min后,加入0.1 mol·L-1的Na2S溶液2 mL,繼續反應20 min后,溶液于50 °C 陳化2 h,反應產物經醇沉蒸餾水清洗后真空干燥備用.
1.2.2 檢測多粘菌素B
在10 mL系列比色管中依次加入2 mg·mL-1MPA包覆的錳摻雜硫化鋅量子點溶液50 μL、500 μL PBS 緩沖液 (20 mM,pH=7.4)及不同濃度的PMB溶液,蒸餾水定容混合溶液至5 mL,混勻反應10 min后,于295 nm激發波長下測定反應溶液的磷光發射光譜,記錄590 nm處的磷光發射強度.
1.2.3 多粘菌素B含量標定
PMB注射液用蒸餾水稀釋至100 μg·mL-1,按照1.2.2試驗步驟進行加標回收試驗標定PMB含量.
2 結果與討論
2.1 MPA包覆的錳摻雜硫化鋅量子點的表征
采用高分辨透射電鏡對所制備的錳摻雜硫化鋅量子點的表觀形貌進行表征顯示:所制備的量子點分散均勻,粒徑小于10 nm(圖1A).從圖1B可以看出,所制備量子點溶液在295 nm處具有明顯的紫外吸收峰(curve 1),且在295 nm激發波長下于590 nm 處具有最大發射強度(curve 2),符合錳摻雜硫化鋅量子點的最佳發射光譜[9],說明量子點被成功制備.
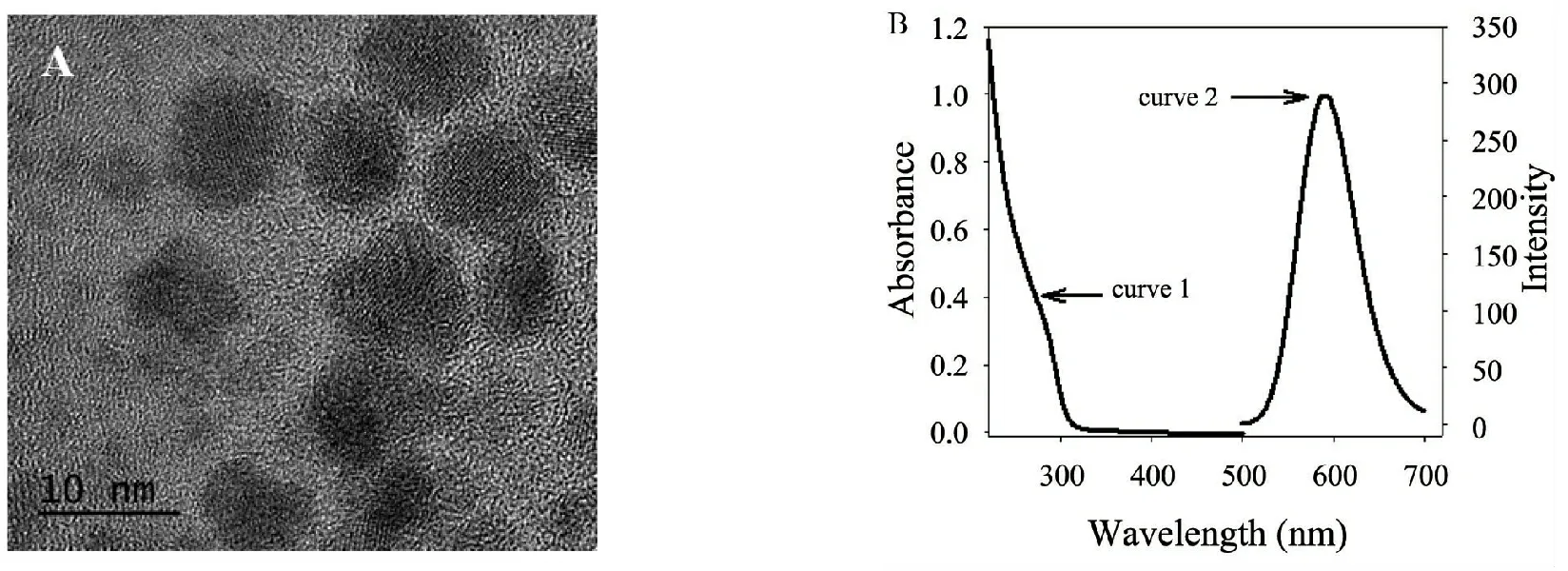
圖1 (A)MPA包覆的錳摻雜硫化鋅量子點透射電鏡形貌(B)MPA包覆的錳摻雜硫化鋅量子點的紫外吸收光譜(curve 1)及磷光發射光譜(curve 2)
2.2 檢測方法構建
量子點發光性質與其表面性質及與化學物質之間的相互作用密切相關[10].一些無機離子、小分子或生物大分子與量子點的相互作用過程會導致量子點表面結構及電荷組成的改變,并改變量子點的發光性能[11,12].錳摻雜硫化鋅量子點經MPA包覆后表面會呈現為明顯的負電性,通過Zeta電勢測定顯示:水溶液中MPA包覆的錳摻雜硫化鋅量子點表面電勢約為-22.0,而PMB 作為一種陽離子多肽類抗生素Zeta電勢約為+3.1(圖2A).因此,PMB可通過靜電相互作用使量子點發生聚集并影響量子點的室溫磷光(RTP)強度.為了證實這一假設,首先分析了PMB對錳摻雜硫化鋅量子點的磷光光譜的影響,結果如圖2B所示:MPA包覆的錳摻雜硫化鋅量子點溶液中加入PMB后,體系磷光強度隨著PMB濃度的增加而逐漸增強,說明PMB可有效增強錳摻雜硫化鋅量子點的RTP強度.為了確定PMB對錳摻雜硫化鋅量子點RTP增強的原因,利用紫外-可見吸收光譜及共振光散射光譜(RLS)分析了PMB與錳摻雜硫化鋅量子點之間的相互作用機制.從圖2C可以看出,PMB無明顯紫外吸收(curve 1),錳摻雜硫化鋅量子點在200 nm~400 nm范圍內存在明顯的紫外吸收(curve 2),當在錳摻雜硫化鋅量子點溶液中加入PMB后,體系的紫外吸收明顯加強(curve 4),且這種加強效應并非量子點與PMB各自紫外吸收疊加所致(curve 3), 意味著二者之間存在明顯的相互作用.進一步通過RLS光譜分析顯示(圖2D):PMB自身的 RLS強度非常低(圖2D插圖),但當PMB加入錳摻雜硫化鋅量子點溶液后,隨著PMB濃度的增加,錳摻雜硫化鋅量子點溶液RLS強度逐漸增強,說明PMB與量子點相互作用的過程中可以使量子點發生聚集并形成更大的散射粒子.在量子點聚集過程中,量子點之間的距離相應縮短,量子點表面缺陷可被鄰近量子點所修復,從而增強了量子點電子空穴復合發光[13].由此說明基于PMB錳摻雜硫化鋅量子點之間的靜電相互作用可用于PMB檢測體系的構建.
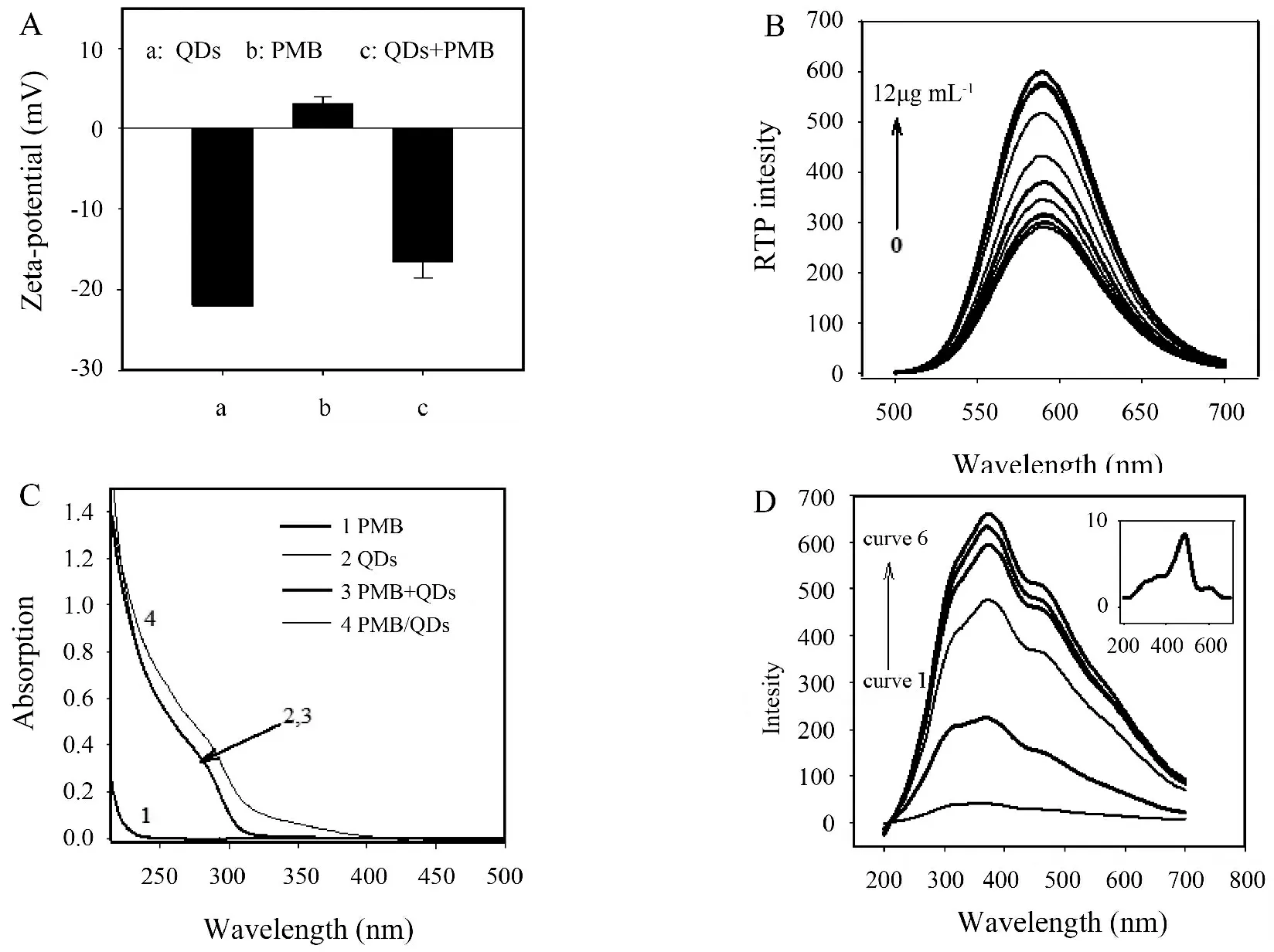
圖2 (A)錳摻雜硫化鋅量子點的Zeta電勢(a), PMB的Zeta電勢(b),錳摻雜硫化鋅量子點/PMB復合體系Zeta電勢(c);(B)錳摻雜硫化鋅量子點和PMBS共存體系磷光發射光譜,PBS濃度為20 mmol·L-1, pH=7.4,PMB濃度分別為0 μg·mL-1、0.1 μg·mL-1、0.2 μg·mL-1、0.5 μg·mL-1、1.0 μg·mL-1、2.0 μg·mL-1、4.0 μg·mL-1、6.0 μg·mL-1、8.0 μg·mL-1、10.0 μg·mL-1、12.0 μg·mL-1;(C)紫外吸收光譜,PMBS (curve 1),錳摻雜硫化鋅量子點(curve 2),錳摻雜硫化鋅量子點與PMB紫外吸收光譜的疊加曲線(curve 3),錳摻雜硫化鋅量子點與PMB 共存體系的紫外吸收曲線(curve 4),錳摻雜硫化鋅量子點濃度:20 μg·mL-1,PMB:8 μg·mL-1,PBS 緩沖液:20 mmol·L-1,pH=7.4;(D)不同濃度PMB作用下,錳摻雜硫化鋅量子點(20 μg·mL-1)的RLS 光譜,PMB濃度分別為0 μg·mL-1、2.0 μg·mL-1、4.0 μg·mL-1、8.0 μg·mL-1、10.0 μg·mL-1、12.0 μg·mL-1,插圖為PMB的RLS 光譜(12.0 μg·mL-1).
2.3 檢測條件優化
在pH為6.0~8.5范圍內考察了PMB對錳摻雜硫化鋅量子點RTP強度的影響,如圖3A所示,當PMB存在時,錳摻雜硫化鋅量子點RTP強度比(P/P0)隨著pH值的增加而逐漸增強,當溶液pH值介于6.8~7.8之間時,QDs-PMB體系的RTP強度比保持相對穩定.因此,后續試驗均在pH=7.4的PBS緩沖液中進行分析測定;通過考察不同反應時間下PMB對錳摻雜硫化鋅量子點RTP強度的影響顯示(圖3B):在錳摻雜硫化鋅量子點溶液中加入PMB反應10 min后,溶液RTP強度比(P/P0)不再隨反應時間的增加而變化,因此選擇10 min作為反應檢測時間.
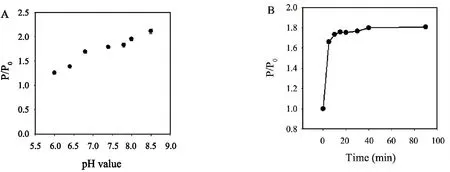
圖3 (A)pH值對PMB增強錳摻雜硫化鋅量子點RTP信號的影響;(B)反應時間對PMBS增強錳摻雜硫化鋅量子點RTP信號的影響;PMB與量子點濃度分別為20 μg·mL-1與6.0 μg·mL-1.
2.4 靈敏性
通過分析不同濃度PMB對錳摻雜硫化鋅量子點磷光強度的影響顯示:隨著PMB濃度的增加,錳摻雜硫化鋅量子點溶液磷光強度逐漸增強,且磷光強度比(P/P0,P和P0分別表示加入與不加入PMB條件下錳摻雜硫化鋅量子點的磷光強度)與PMB濃度在0.1 μg·mL-1~8.0 μg·mL-1范圍內呈現出良好的線性響應關系(圖4),線性方程為:P/P0=0.117CPMB+1.15,R2= 0.994;依據3σ/k檢測限計算方法所計算的檢出限為0.03 μg·mL-1.
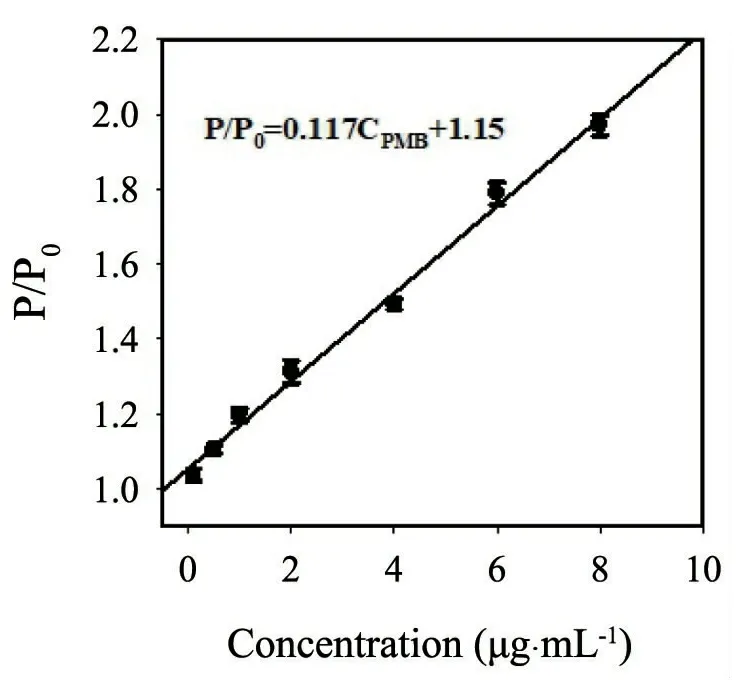
圖4 P/P0與PMB濃度線性響應關系,錳摻雜硫化鋅量子點濃度為20 μg·mL-1,PBS緩沖液濃度為20 mmol·L-1,pH=7.4
與之前報道的一些方法相比(表1),所建立方法的檢出限低于毛細管電泳法[14]、毛細管膠束電動色譜法[15],接近于高效液相色譜法[16]、壓力測量法[17]與熒光法[18].此外值得一提的是,所建立的檢測方法不需要復雜的探針設計與繁瑣的操作步驟,檢測過程方便快捷;此外,相比于熒光光譜法,磷光光譜法可有效規避樣品基質中背景熒光的干擾,從而可增強檢測過程的選擇性.
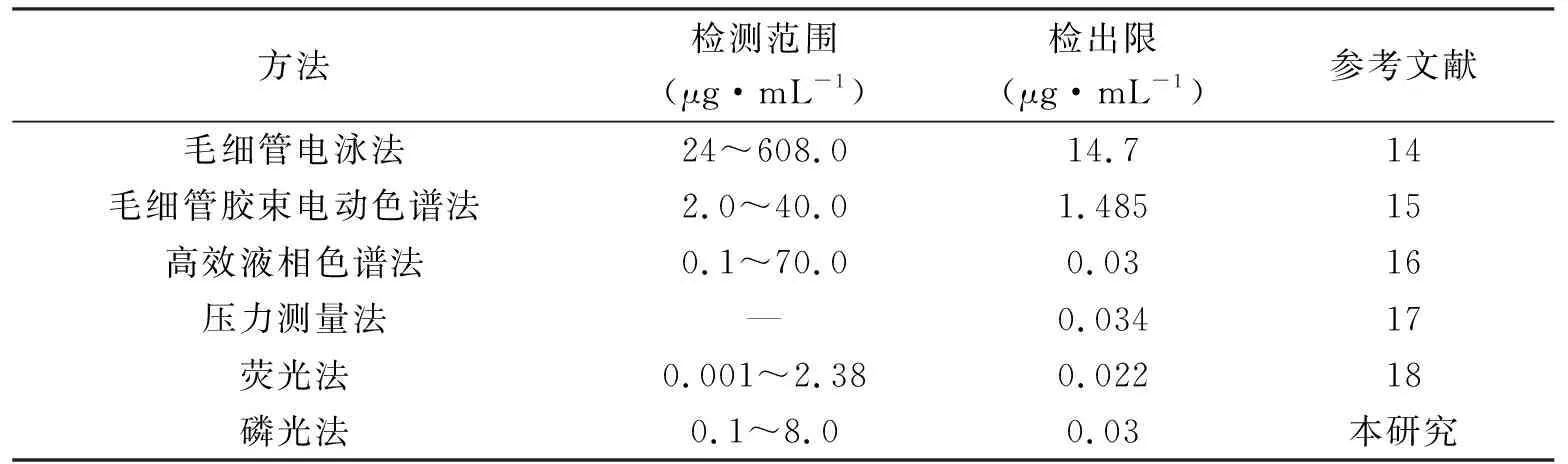
表1 建立方法與其它方法靈敏性的比較Tab.1 Comparison of the sensitivity of the proposed method with other methods for the detection of PMB
2.5 選擇性
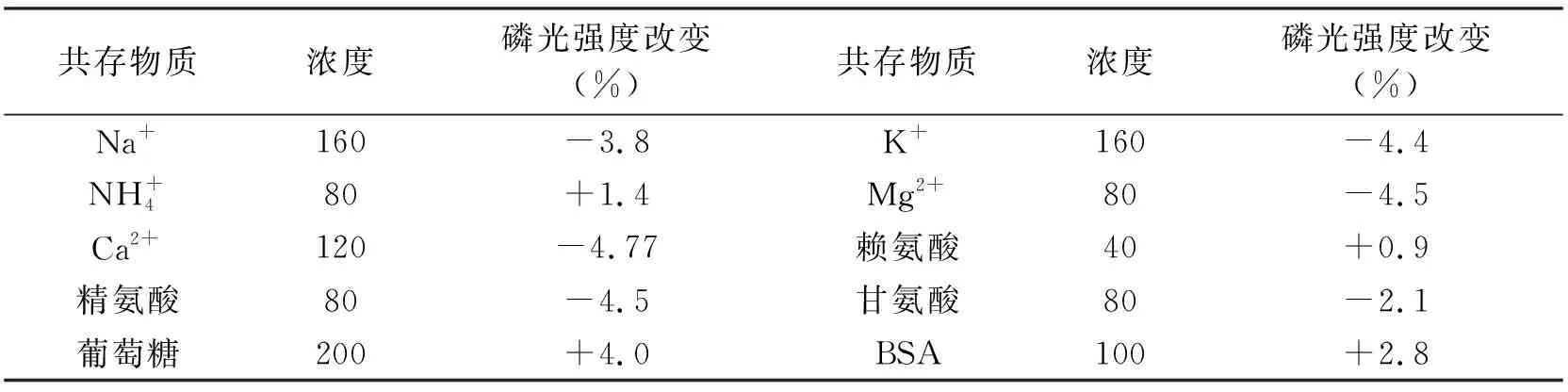
表2 共存物質對QDs-PMB檢測體系的干擾Tab.2 Effect of coexisting substances for MPA-capped Mn-doped ZnS QDs-PMB detection system
2.6 應用性能分析
為了考察所建立方法的實際應用性能,選擇注射用硫酸多粘菌素B作為實際樣品進行了加標回收試驗,從表3可以看出,PMB平均回收率在97.5 %~105.5 % 之間,RSD小于2.5 %,說明所建立的方法可用于醫用藥品中PMB含量的快速標定.

表3 實際樣品加標回收試驗結果Tab.3 The spiked recovery for the real sample
3 結論
基于錳摻雜硫化鋅量子點建立了一種檢測PMB的磷光方法,在水溶液中 PMB可通過靜電相互作用誘導錳摻雜的硫化鋅量子點聚集并使其磷光發射強度增強,檢測線性范圍為0.1 μg·mL-1~8.0 μg·mL-1,檢出限為0.03 μg·mL-1.所建立的方法可用于醫用藥劑中PMB的檢測與標定,且與之前報道的一些方法相比,檢測過程更為簡單、便捷.

