厚樸酚對脂肪酸誘導HepG2細胞脂質積蓄的作用及機制研究
鐘艷花,林 重,鐘映芹,唐東暉
(廣州市荔灣區中醫醫院,廣東 廣州510140)
代謝相關脂肪性肝病(metabolism related fatty liver disease,MAFLD),曾用名非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是指除外酒精和其他明確的損肝因素所致的以肝細胞內脂肪過度沉積為主要特征的臨床病理綜合征,與胰島素抵抗和遺傳易感性密切相關的獲得性代謝應激性肝損傷,包括單純性脂肪肝、非酒精性脂肪性肝炎及其相關肝硬化。隨著肥胖及其相關代謝綜合征全球化的流行趨勢,代謝相關脂肪性肝病現已成為歐美等發達國家和我國富裕地區慢性肝病的重要病因,MAFLD患病率10%~30%,嚴重危害人民健康。但是由于MAFLD發病機制復雜,目前國內外對其發病機制仍不清楚,在一定程度上限制了MAFLD的臨床治療和藥物開發。
藿樸夏苓湯組方源自《醫原》,方由廣藿香、厚樸(姜制)、半夏(制)、茯苓、杏仁、薏苡仁、白蔻仁、淡豆豉、澤瀉和通草組成,具有理氣化濕、疏表和中之功效,與NAFLD的病機特點相吻合,臨床用于濕溫初起濕重于熱者,是臨床常用治濕之良劑,廣泛用于肝膽、胃腸道濕熱證[1-5]。課題組近期研究顯示,藿樸夏苓湯具有改善血脂代謝異常、抗炎等藥理作用[6-9],發揮顯著降脂、保肝、抗MAFLD作用[10],但目前關于其降脂、抗MAFLD的藥理機制以及物質基礎尚不明確。本研究旨在細胞水平上觀察藿樸夏苓湯主要成分對PPARα信號的影響,探討藿樸夏苓湯降脂、抗MAFLD的作用機制及其物質基礎。
1 材料與方法
1.1 實驗材料
1.1.1 藥品與試劑 油酸(OA,批號:O108485)、棕櫚酸(PA,批號:P101061)、非諾貝特(批號:F129682),阿拉丁化學生物試劑公司;廣藿香醇(批號:P0279)、厚樸酚(批號:P0223)、琥珀酸(批號:P0928)、甘油三油酸酯(批號:P0915)、茯苓酸(批號:P0734)、苦杏仁苷(批號:hzm4145)、乙酰澤瀉醇A(批號:YRA1687)等對照品,上海純優生物科技有限公司;HepG2和HEK293T細胞株均購于上海紀寧細胞庫中心;FuGENE6轉染試劑(批號:E2691)、pCDNA3.1(批號:E1751)、pCDNA3.1-hPPARα(批號:FXC03156)、pCDNA3.1-CPT1α-luc(批號:C395A)和pGL3-CMV Renilla(批號:E2231),美國Promega公司;PPARαsiRNA(批號:sc-36308)和Control siRNA質粒(批號:sc-37007),美國Santa Cruz Biotechnology公司;甘油三酯(TG)測定試劑盒(批號:A110-1-1),中國南京建成生物工程研究所;總RNA提取試劑盒(批號:200506),中國寶成生物工程(大連)有限公司;逆轉錄試劑盒(批號:20200612),大連寶成TAKARA公司。TaqMan Gene Expression Master Mix的real-time PCR反應液(批號:20200411)、實驗使用的TaqMan探針包括PPARα探針(批號:Hs00947538_m1)、CPT1-α探針(批號:Hs00912671_m1)、ACO探針(Hs01074241_m1)、FAS探針(Hs00188012_m1)、CD36探針(Hs01074241_m1)、FABP1探針(Hs00155026_m1)、FATP2探針(Hs 01587915_m1)和GAPDH探針(批號:Hs02786624_g1),美國ABI公司;PPARα抗體(批號:ab215270),英國Abcam公司。
1.1.2 儀器與設備 StepOne Plus Real-time實時熒光定量PCR儀,美國ABI公司。BDU-700核酸蛋白分析儀,美國Beckman公司。KDC-120HR高速冷凍離心機,中國安徽中科中佳科技儀器有限公司。BT3000全自動生化分析儀,意大利愛康公司。Enspire plus多功能酶標儀,美國PerkinElmer公司。BX53奧林巴斯熒光顯微鏡,日本奧林巴斯公司。
1.2 實驗方法
1.2.1 細胞培養與處理 HepG2細胞培養于37℃含5.0%CO2的孵箱,細胞培養基為含10%FBS、100μg/mL鏈霉素和100 U/mL青霉素的DMEM培養基。HepG2按1×106種于6孔板中,細胞貼壁后,分為對照組(DMSO)、模型組、厚樸酚低、中、高劑量組(2.5,10,40μmol/L)和非諾貝特組(10 μmol/L)。模型組采用OA+PA(2∶1,1 mmol/L)誘導24 h模擬細胞內脂質積蓄模型,對照組給予相應的生理鹽水。各組細胞分別預先給予相應藥物作用24 h后,隨后加入OA+PA誘導24 h。
1.2.2 CPT1α-luc熒光素酶報告基因活性分析在反式激活實驗中,HEK293T細胞按1×104種于96孔板中,貼壁后,細胞采用FuGENE6轉染試劑瞬時轉染pCDNA3.1、pCDNA3.1-hPPARα(100 ng/孔)、pCDNA3.1-CPT1α-luc(200 ng/孔)和pGL3-CMV Renilla熒光素酶質粒(10 ng/孔,對照質粒)12 h,然后分別加入DMSO(對照組)、非諾貝特(終濃度10μmol/L)、廣藿香醇(終濃度10μmol/L)、厚樸酚(終濃度10μmol/L)、琥珀酸(終濃度10μmol/L)、甘油三油酸酯(終濃度10μmol/L)、茯苓酸(終濃度10μmol/L)、苦杏仁苷(終濃度10μmol/L)和乙酰澤瀉醇A(終濃度10μmol/L)作用24 h后,采用Enspire plus多功能酶標儀,按照Promega雙熒光素酶報告檢測系統的方法,測定各組熒光素酶報告基因活性。1.2.3 免疫熒光分析厚樸酚對PPARα核易位的影響 HepG2按1×104種于24孔板中,貼壁后,加入厚樸酚作用24 h后,隨后加入OA+PA誘導24 h。采用PBS沖洗3次,細胞加入10%多聚甲醛固定20 min,PBS沖洗3次,加入0.5%Triton X-100/PBS溶液通透10 min,PBS沖洗3次,加入5%BSA封閉30 min后,加入PPARα1抗(1∶200),4℃搖床孵育過夜。PBS沖洗3次,加入FITC熒光2抗,37℃避光孵育30 min后,PBS沖洗3次,加入0.5μg/mL的DAPI孵育5 min,PBS沖洗3次后,鏡檢。
1.2.4 分子對接實驗 靶標蛋白結構的獲取和預處理:從蛋白質數據庫下載PPARα的三維晶體結構(PDBID:3ET1;網址:https://www.rcsb.org/search),并導入分子對接軟件MOE(2008.10版本),去除不相關的配體和水分子,在pH7和溫度300K下對蛋白質進行Protonate 3D加氫和加電荷處理以及能量最小化操作。
小分子配體構建和預處理:從PubChem數據庫下載厚樸酚三維結構,通過MOE軟件對所有分子進行加氫和能量最小化處理,保存。
分子對接:為了預測受體和配體的結合能力,選擇AMBER10:EHT力場以及R-field隱式溶劑模型進行分子對接。對接過程采用induced fit模式和Triangle Matcher放置函數,其中結合口袋的側鏈可以根據配體構象自動調整,約束側鏈旋轉的重量設置為10,最后通過Londond G和GBVI/WSAdG評分功能進行打分,打分越低,配體與受體結合越穩定,并通過氨基酸殘基結合的數目評價化合物與靶點的結合活性。
1.2.5 厚樸酚對OA+PA誘導HepG2細胞脂質水平的影響 HepG2細胞采用PBS沖洗2次,4%多聚甲醛固定細胞20 min,60%異丙醇分化3 min,加入新鮮配制的油紅O染色液(油紅儲存液-去離子水3∶2)染色20 min,洗去多余染料,蘇木素染核30 s,蒸餾水沖洗數次后置于顯微鏡下觀察并拍照。將各組細胞消化后,收集細胞,按照TG檢測試劑盒說明書測定細胞內TG含量。
1.2.6 Real-time PCR測定細胞中脂質合成、吸收、氧化分解相關的基因mRNA表達水平 HepG2細胞采用PBS沖洗2次,采用Trizol試劑提取、純化細胞總mRNA,并測定其濃度及純度。采用大連寶成TAKARA公司的cDNA逆轉錄試劑盒進行逆轉錄,采用StepOne Plus Real-time實時熒光定量反應,測定細胞中PPARα、CPT1-α、ACO、FAS、CD36、FABP1和FATP2的mRNA相對表達量。Real-time PCR反應體系:cDNA模板5μL,Taq-Man探針1μL,ddH2O 4μL,TaqMan Fast Advanced Master Mix 10μL,總體積20μL。用StepOne Plus熒光定量分析儀進行擴增反應,反應條件:95℃2 min;95℃5 s、60℃30 s讀板,40個循環。記錄各組樣品擴增反應的Ct值,以GAPDH作為內參基因,采用2-△△Ct法計算目的基因的相對表達量。
1.2.7 PPARα敲減實驗研究 HepG2按1×106種于6孔板中,貼壁后,采用FuGENE6試劑瞬時轉染PPARαsiRNA和Control siRNA質粒12 h后,加入厚樸酚作用24 h后,隨后加入OA+PA誘導24 h。按“1.2.3項”和“1.2.6”項進行處理,分別測定細胞脂質蓄積、TG含量以及脂質合成、吸收、氧化分解相關的基因mRNA表達水平。
1.3 統計學方法
2 結果
2.1 藿樸夏苓湯代表性化學成分對PPARα信號的影響
為了找尋激動PPARα的成分,對藿樸夏苓湯中代表性化學成分進行了CPT1α-luc熒光素酶報告基因活性分析。如圖1~4所示,與對照組比較,陽性對照藥非諾貝特和厚樸酚顯著提高CPT1α-luc熒光素酶報告基因活性,提示厚樸酚可激動PPARα信號。分子對接結果顯示厚樸酚通過Cys276、Lys358、Thr279等氫鍵方式與PPARα的LBD進行分子-蛋白質相互作用。

圖1 藿樸夏苓湯代表性化學成分CPT1α-luc熒光素酶報告基因活性分析
此外,與對照組比較,厚樸酚中、高劑量組可顯著提高PPARα及其下游靶基因CPT1-α的mRNA表達水平(P〈0.05,P〈0.01),差異有統計學意義。免疫熒光分析顯示厚樸酚呈現劑量依賴性提高HepG2細胞內PPARα的蛋白水平,并促進PPARα核易位作用。
以上結果提示厚樸酚可激動PPARα信號,可能是藿樸夏苓湯降脂、抗MAFLD作用的關鍵成分。

圖2 厚樸酚與PPARα的LBD分子對接結果

圖3 厚樸酚對PPARα和CPT1α的mRNA表達水平的影響
2.2 厚樸酚對OA+PA誘導HepG2細胞脂質水平的影響
油紅染色實驗顯示,與對照組比較,模型組中HepG2細胞內紅色脂滴聚集和TG水平明顯增加,表明OA+PA誘導的細胞內脂質堆積增加。與模型組比較,厚樸酚中、高劑量組均可明顯降低細胞內紅色脂滴聚集和細胞內TG水平(P〈0.05,P〈0.01),差異有統計學意義。結果表明,厚樸酚可顯著降低OA+PA誘導的HepG2細胞內脂質沉積作用。結果見圖5和圖6。

圖4 免疫熒光分析厚樸酚對PPARα核易位的影響

圖5 厚樸酚對OA+PA誘導細胞內紅色脂滴聚集的影響
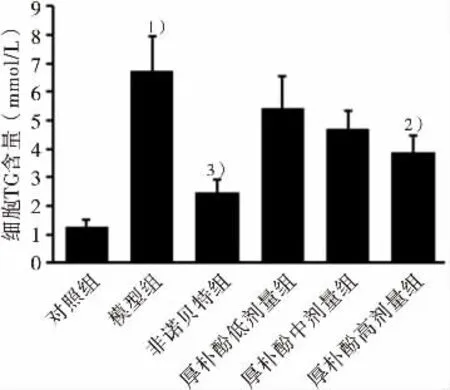
圖6 厚樸酚對OA+PA誘導細胞內TG含量的影響
2.3 厚樸酚對OA+PA誘導HepG2細胞脂質合成、轉運和氧化代謝相關基因的影響
與對照組比較,模型組細胞內主要脂質合成和轉運基因(FAS、CD36、FABP1和FATP2)的mRNA表達水平著升高,而脂質氧化代謝基因(PPARα、CPT1-α和ACO)則顯著降低(P〈0.01),差異有統計學意義。與模型組比較,厚樸酚中、高劑量組可顯著抑制OA+PA誘導的脂質合成和轉運基因FAS、CD36、FABP1和FATP2的基因表達,而提高脂質氧化代謝基因PPARα、CPT1-α和ACO的表達(P〈0.05,P〈0.01),差異有統計學意義。結果見圖7和圖8。結果表明,厚樸酚可以上調PPARα核受體表達水平,導致提高OA+PA誘導的細胞內脂質氧化代謝作用和降低脂質合成和轉運作用。
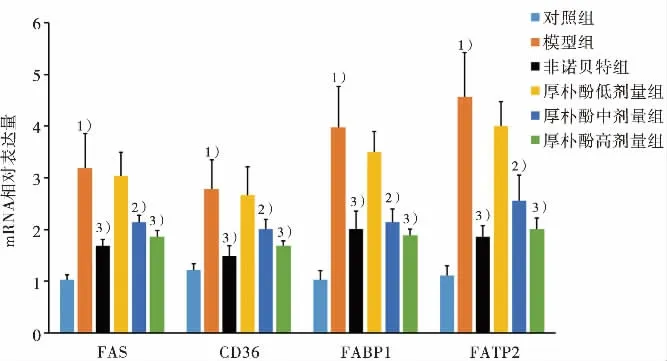
圖7 厚樸酚對OA+PA誘導HepG2細胞內脂質合成和轉運基因的mRNA表達水平的影響
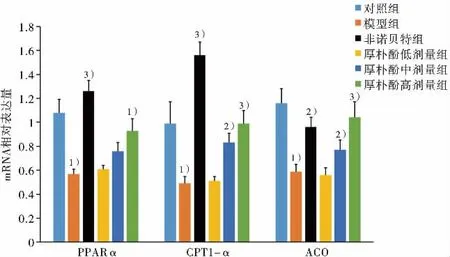
圖8 厚樸酚對OA+PA誘導HepG2細胞內脂質氧化代謝基因的mRNA表達水平的影響
2.4 敲減PPARα后,厚樸酚對OA+PA誘導HepG2細胞內脂質水平積蓄作用的影響
為了驗證PPARα信號在厚樸酚降脂、抗MAFLD作用中的重要性,我們進行了細胞水平的PPARα敲減作用。在Control siRNA(si-Control)組中,與模型組比較,厚樸酚高劑量組明顯降低細胞內紅色脂滴聚集和細胞內TG水平,差異有統計學意義(P〈0.05,P〈0.01)。相反,在PPARαsiRNA(si-PPARα)組中,當敲減HepG2細胞內PPARα,與模型組比較,高劑量組厚樸酚失去了降低細胞內紅色脂滴聚集和細胞內TG水平的作用,差異無統計學意義(P〉0.05)。結果表明,厚樸酚降低OA+PA誘導的HepG2細胞內脂質沉積作用依賴于PPARα的表達。結果見圖9和圖10。

圖9 敲減PPARα后,厚樸酚對OA+PA誘導細胞內紅色脂滴聚集的影響

圖10 敲減PPARα后,厚樸酚對OA+PA誘導細胞內TG含量的影響
2.5 敲減PPARα后,厚樸酚對OA+PA誘導HepG2細胞內脂質合成、轉運和氧化代謝相關基因的影響
在si-Control組中,與模型組比較,厚樸酚高劑量組可明顯抑制OA+PA誘導的脂質合成和轉運基因FAS、CD36、FABP1和FATP2的基因表達,而提高脂質氧化代謝基因PPARα、CPT1-α和ACO的表達(P〈0.05,P〈0.01),差異有統計學意義。相反,在si-PPARα組中,當敲減HepG2細胞內PPARα的表達,與模型組比較,高劑量組厚樸酚失去了對上述脂質合成、轉運和氧化代謝相關基因的調控作用,差異無統計學意義(P〉0.05)。結果見圖11和圖12。結果表明,厚樸酚降低OA+PA誘導的HepG2細胞內脂質合成、轉運和氧化代謝相關基因的調控作用依賴于PPARα的激動作用。

圖11 敲減PPARα后,厚樸酚對OA+PA誘導HepG2細胞內脂質合成和轉運基因的mRNA表達水平的影響

圖12 敲減PPARα后,厚樸酚對OA+PA誘導HepG2細胞內脂質氧化代謝基因的mRNA表達水平的影響
3 討論
代謝相關脂肪性肝病(MAFLD)是一種常見肝臟脂肪代謝異常誘發的代謝類疾病,是一個亟待解決的全球性公共健康問題。其主要表現為甘油三酯(TG)以脂滴的形式在肝細胞中異常積累[11-12],通常而言,肝臟脂肪變性可進一步發展為非酒精性脂肪肝炎、肝硬化,甚至肝癌[11-12]。
MAFLD發生發展的核心是肝臟脂質異常沉積,主要由于脂肪酸β氧化分解不足或脂質合成吸收過度導致[13-14]。該過程主要由于受損肝細胞核受體轉錄因子PPARα失去對下游參與肝細胞脂質的合成、攝取/轉運和脂肪酸氧化等相關基因(合成基因ACC、FAS、SCD1等,攝取/轉運基因CD36、FATP1等,脂肪酸氧化基因CPT1-α、LCAD、MCAD、ACO等)的調控作用[13-15]。臨床研究顯示,與健康志愿者比較,MAFLD患者肝臟組織的PPARα及其氧化代謝基因顯著降低,而脂質合成和吸收基因則升高[16]。相似地,小鼠肝臟缺失PPA-Rα基因導致提高肝臟脂質沉積的敏感性[17]。相反,貝特類藥物藥理性活化PPARα則顯著改善高脂飲食誘導的脂質堆積作用[18],提示了PPARα激動劑在MAFLD治療中的重要作用。然而,盡管非諾貝特作為臨床一線常用PPARα激動劑顯示出較好的改善MAFLD作用,但存在安全性、副作用等問題[19],在一定程度上限制了廣泛應用。因此,找尋、開發低毒、有效的PPARα激動劑在治療MAFLD中意義重大。
藿樸夏苓湯“理氣化濕、疏表和中”,切中MAFLD病機,臨床和實驗研究顯示良好的保肝、降脂、抗炎、抗MAFLD作用[1-10],但抗MAFLD藥理作用機制和物質基礎不明。為了闡釋其抗MAFLD作用,我們首先通過對方中的代表性成分進行篩選,如廣藿香醇(廣藿香的主要成分)、厚樸酚(厚樸的主要成分)、琥珀酸(半夏的主要成分)、甘油三油酸酯(薏苡仁的主要成分)、茯苓酸(茯苓的主要成分)、苦杏仁苷(杏仁的主要成分)、乙酰澤瀉醇A(澤瀉的主要成分),并對這些成分進行反式激活實驗研究,篩選PPARα激動劑。研究結果表明厚樸酚可提高CPT1α-luc熒光素酶報告基因活性,通過氫鍵形式加強厚樸酚與PPARα的LBD域進行互作,促進PPARα核易位,導致提高PPARα及其下游靶基因CPT1-α的表達,并抑制脂質合成和吸收基因的表達,顯著改善OA+PA誘導HepG2細胞內脂質沉積。我們的研究結果與Tian Y等報道相一致[20]。
為了進一步闡述厚樸酚降低細胞內脂質沉積作用依賴于PPARα的激動效應,我們隨后進行了HepG2細胞PPARα敲減實驗。研究顯示PPARα敲減后,厚樸酚對脂質氧化分解基因和脂質合成、吸收等基因無明顯的調控作用,進而損害厚樸酚降低細胞內脂質的作用,證實厚樸酚降脂作用是依賴于與PPARα的參與。
CPT1-α和ACO均是脂質氧化分解過程中的關鍵限速酶,分別催化線粒體和過氧化物酶體β氧化[21]。研究表明,PPARα的激活能誘導線粒體和過氧化物酶體中與脂質氧化相關的一系列基因的轉錄,從而降低肝臟脂質水平[18],通過肝細胞特異性的過氧化物酶體基因敲除或抑制ACO活性會導致肝臟脂質蓄積[22]。本研究顯示,OA+PA誘導顯著降低PPARα、CPT1-α和ACO的表達,這些結果表明,脂質的蓄積可能會導致肝細胞氧化能力受損,進而促進肝細胞脂質積累。經厚樸酚處理后,PPARα、CPT1和ACO的表達均升高,提示厚樸酚可通過PPARα途徑增加肝細胞脂質氧化能力,在一定程度上減輕肝細胞脂肪積蓄。
另一方面,肝臟對循環脂肪酸的吸收/轉運主要依賴于FAS、CD36、FABPs、FATPs,FAS是脂肪酸合成限速酶,其活性或基因表達的增加可以促進脂肪的合成。有研究表明,MAFLD患者肝臟中FAS、CD36、FABP1表達明顯高于正常肝臟組織[23-24]。抑制FAS、CD36和FABP1的表達則顯著降低肝臟脂質沉積,發揮改善MAFLD作用[25-27]。本研究顯示,OA+PA誘導顯著提高FAS、CD36,FABP1和FATP2的表達,表明通過提高細胞內脂質合成和吸收作用進而促進肝細胞脂質積累。然而,經厚樸酚處理后,FAS、CD36、FABP1和FATP2的表達均降低,提示厚樸酚可通過PPARα途徑抑制肝細胞脂質合成、吸收作用,進而減輕肝細胞脂肪堆積。
綜上所述,本研究在細胞水平上顯示藿樸夏苓湯成分厚樸酚通過激動PPARα信號通路,降低脂質合成和吸收,并提高脂質氧化分解作用,進而改善OA+PA誘導的肝細胞脂肪積蓄。

