體外診斷試劑參考區間技術審評常見問題及建議
張莉莉 張蘇琳 唐力 王文娟 戴清 江蘇省食品藥品監督管理局認證審評中心 (江蘇 南京 210002)
內容提要: 參考區間是定量體外診斷試劑的重要參數。從技術審評的角度分析企業在確定參考區間過程中常見的問題并提出幾點建議,旨在提高企業設計開發效率和臨床評價成功率。
近年來我國體外診斷試劑產業快速發展,回顧過去幾年我省體外診斷試劑申報注冊受理量可知,呈逐年遞增之勢,且增速明顯。然而從申報注冊主體的角度講,體外診斷試劑的生產企業普遍規模比較小,產品注冊專員和研發人員的流動性大,整體素質有待于進一步提高,這也制約了體外診斷試劑行業發展。與此同時,生產企業對注冊申報相關的法規、標準以及相關指導原則掌握得還不夠全面,注冊申報資料在合規性性等方面仍存在較多問題。本文主要就二類體外診斷試劑定量產品的參考區間確定資料,從技術審評的角度談一些常見的問題以及建議。
根據我國醫療器械監管法規要求,第二類體外診斷試劑產品在上市前應進行注冊審評審批,注冊申報資料應符合《醫療器械監督管理條例》(國務院令第680號)、《體外診斷試劑注冊管理辦法》(國家食品藥品監督管理總局第5號)、原國家食品藥品監督管理總局《關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》(2014年第44號)等相關配套法規規章文件的要求。其中上述44號公告相關附件對體外診斷試劑產品各注冊類型所需提交的注冊資料,作出了具體要求。其中參考區間確定資料即為重要申報資料之一。然而部分企業在產品設計開發階段過多的重視產品臨床性能評價,而忽視了對產品各性能指標及重要參數做全面而系統的研究評價。定量體外診斷試劑產品的關鍵參數之一即為參考區間。從邏輯的角度來講,準確地建立定量體外診斷試劑產品的參考區間可以大幅度的提高臨床評價結果滿足評價指標的概率,反之可能對臨床評價結果造成不利影響,甚至可能導致整個研發工作重頭再來,這不僅費時費力,也對生產企業帶來巨大資金壓力。
1.參考區間概念及注冊申報基本要求
中華人民共和國衛生部標準WS/T 402-2012中指出:參考區間(Reference interval)兩參考限之間(包括兩參考限)的區間。注1:參考區間是指從參考下限到參考上限的區間,通常是中間95%區間。在某些情況下只有一個參考限具有臨床意義,通常是參考上限,這時的參考區間是0到參考上限。注2:參考區間在我國通常又稱為“參考范圍”“正常范圍”“正常值”等,但“參考區間”是目前國際通用規范術語[1]。
原國家食品藥品監督管理總局《關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》(2014年第44號)中要求企業提供的定量體外診斷試劑參考區間確定資料:應當詳細說明參考區間確定的方法或依據,說明確定參考區間所采用的樣本來源,并提供參考區間確定的詳細試驗資料及總結[2]。
2.參考區間技術審評常見問題及建議
2.1 注冊資料中參考區間確定方法不明確或不合理
很多企業在體外診斷試劑擬注冊產品申報資料中提供的參考區間確定資料沒有明確表述該產品參考區間的確定方法是什么,資料中直接給出試驗方案,實驗數據以及試驗結果。還有部分企業,可能出于研發成本及時效的考慮,在參考區間確定資料中,提供引用文獻或者其他企業同類產品說明書,以表明引用文獻中數據作為該產品參考區間或者轉移其他企業同類產品參考區間作為該產品參考區間。資料中缺少對引用文獻數據或轉移其他企業同類產品參考區間適用性的分析和必要的臨床樣本驗證。
美國臨床實驗室標準化協會(CLSI)的EP28-A3文件中指出,定量體外診斷試劑參考區間確定方法一般有:①建立參考區間,②轉移參考區間,③驗證參考區間[3]。
建立參考區間,包括所有的步驟,從選擇參考個體開始,通過準確的統計學方法分析收集的數據,最終得出結論。適用情況有:①新分析物參考區間的建立;②不同群體參考區間的建立;③靈敏度和特異性提高了的新的分析方法參考區間的建立。
轉移參考區間,使已建立好的參考區間適用于新的檢測系統或新的檢測人群的過程。適用的情況:預先已檢測過的分析物參考區間的建立,即把一個實驗室的參考區間轉移到另一個實驗室。但是需要待測試的群體和分析系統相同或者具有可比性,轉移才能被認可和接受。可接受參考區間轉移的必要條件包括:檢測系統的可比性;檢測人群的可比性。選擇這種方法確定產品參考區間時,需要先對試驗系統與比對系統進行方法學比對試驗和偏差評估,只有相關系數和偏倚在規定的范圍內,才可轉移。
驗證參考區間,即通過相對較少的參考個體,將其他地方建立或轉移的參考區間在當地使用的合理過程。適用于驗證建立的或轉移的參考區間是否可接受。目前,建議三種方法用來評估參考區間轉移的可接受性:①主觀驗證;②使用少量的參考個體驗證(如,n≥20);③使用大樣本量的參考個體驗證(但少于建立參考區間需要的n≥120)。選擇這種方法確定產品參考區間,需要考慮接收實驗室的操作必須和原始參考值研究的分析前和分析中各因素的控制保持一致[4]。
2.2 研究參考區間時樣本的入排標準設立不具體,千篇一律,對分析物無針對性
企業申報資料,經常可以發現一個現象,尤其是同一個生產企業的申報資料,即便是不同檢測指標,其參考區間確定資料中研究樣本的入排標準卻一模一樣,缺乏對分析物或臨床適應癥的針對性,這就對后期參考區間研究結果的準確性造成了隱患。
一般來說,參考區間研究的樣本為表觀健康人群。需要確立統一的,具體的選擇和排除標準,從而選擇“相對健康”的參考個體。因研究臨床檢測分析物不同,所設計的排除標準也各不相同。通常避免直接選用一般意義上的年輕又健康的成年人,可以選用非常類似于患者群的人群。如果分析物對參考個體有分組的必要性,可以建立分組標準,將全部篩選出來的參考個體,按照有意義的分類法進行分組,例如按年齡、性別、月經周期或孕周期等進行分組。此外檢測樣本的具體情況,也應該在研究參考區間時納入考慮,例如不同樣本類型的樣本應分別進行研究,如尿液、血液、腦脊液等。不同采血位置應分別進行研究,如指尖血、靜脈血等。
2.3 參考區間研究樣本量不符合統計學要求
部分企業不清楚參考區間研究樣本量如何確定,沒有從產品自身特性、影響因素出發,直接設定某個數量,從而收集樣本進行分析統計,這樣的研究方法是不科學的,研究結果也會遭到質疑。
研究檢測指標參考區間時,首先要考慮該檢測指標的臨床含義,從而決定參考區間報告結果是單側范圍或雙側范圍。參考區間指的是兩個數(含這兩個數)之間,即最高限和最低限的之間的全部數組成的區間,從參考人群中抽出來的個體檢測值可以用一個特定的百分比(通常是95%)來評估。故雙側區間可取第2.5和第97.5個百分位點;單側上限取95%百分位點;單側下限取5%百分位點[4]。
參考區間研究樣本量一般依據計算參考樣本組的百分位數值的置信區間(CI)來識別和評定,如果待測物屬于雙側指標,按照公式(1)計算確定樣本數量[4]。
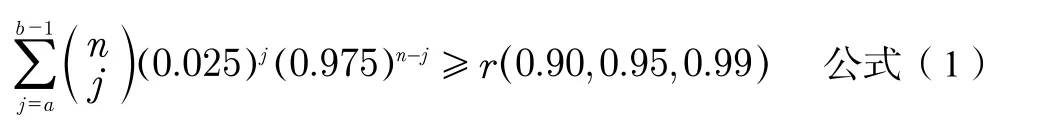
如參考區間取單側下限或單側上限,以5%或95%位置計參考限,按照公式(2)進行計算確定樣本數量[4]。
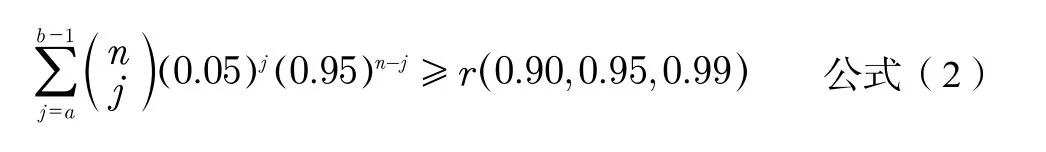
2.4 參考區間研究中統計分析不完善或不合理
企業申報資料中參考區間統計分析常見問題有:①原始數據納入統計的科學性和有效性未保證,部分超出線性范圍或低于線性范圍的數據直接納入統計,未作說明,不能保證統計結果的準確性。②原始數據未作離群值分析,直接進行后續統計計算。③原始數據分布類型未確定,不能保證選擇的計算方法是否科學有效,不能保證研究結果的準確性。
針對上述參考區間確定資料中的幾點統計分析問題,從技術審評的角度,提出幾點建議:①企業研究者應保證參考區間研究中納入統計的原始數據科學有效,對于低于線性范圍的數據不應納入統計,對于超出線性范圍的數據,應做說明,闡述清楚這部分數據如何得來,如稀釋后檢測,回乘稀釋倍數所得等。②無論采用哪種方法建立參考區間,均應進行離群值檢驗。如有離群點被剔除,應補充樣本量至所設置的最少樣本量。③原始數據分布類型不同,運用的參考區間計算方法也不同。根據EP28-A3、WS/T402-2012以及國內的研究資料,可將參考區間的估計方法分為兩種,正態分布法(參數法)和百分位點法(非參數法)。
正態分布法參考區間的計算方法見表1[4]。
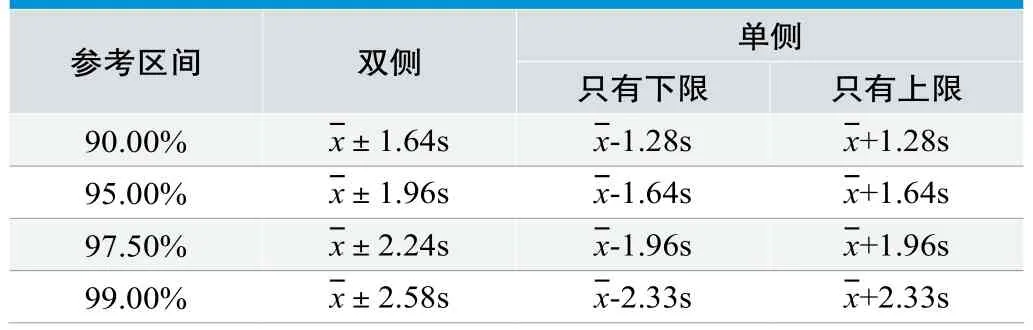
表1. 正態分布參考區間計算方法
百分位數法參考區間的計算方法見表2。
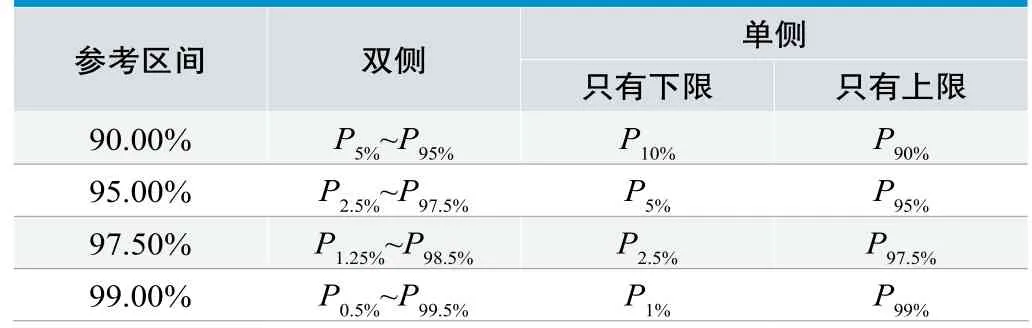
表2. 百分位數法參考區間計算方法
3.小結
本文主要總結和分析了企業產品申報資料中參考區間確定過程中的常見問題,并結合技術審評工作中審查該部分資料關注的要點,給出幾點建議,供行業內相關人員學習、參考、與交流。建議生產企業在設計開發階段,結合產品的臨床預期用途和產品的技術特點,選擇科學的方法,準確建立產品的參考區間,提高產品設計開發的效率以及臨床試驗成功的概率。

