增溫對結皮土壤系統氮轉化速率及微生物生物量碳氮與酶活性的影響*
徐軍山,蘇 雪,賈志鵬,杜梅娜
(西北師范大學生命科學學院,蘭州 730070)
氣候變暖是全球變化的重要方面,也是目前全世界要面臨的巨大挑戰。根據氣候模型預測[1],中國西北沙漠氣溫將會持續上升,預計至2050年可能升高1.5℃。騰格里沙漠地區長期觀測發現該區域呈現出氣溫升高而降水減少的趨勢[2]。在此背景下,增溫對各個生態系統的物質循環和能量轉化過程產生至關重要的影響。因此,闡明荒漠生態系統物質循環過程對氣候變化的響應機制就顯得十分重要。
氮素是土壤的重要養分限制因子之一[3]。土壤氮庫是植物吸收氮素的重要來源,土壤有機氮作為土壤氮庫的核心成分,占土壤全氮的95%左右,但卻不能被植物直接吸收利用,需要通過礦化作用才能轉化成為植物有效利用的氮素。土壤氮礦化作用是指土壤中有機態氮在微生物的作用下轉化為銨態氮和硝態氮形式的無機氮的過程。氮礦化過程是氮循環的關鍵過程,在一定程度上決定了土壤供氮能力水平的高低,是當前國內外研究的熱點[4]。研究土壤氮素礦化特征有利于全面認識和深入了解生態系統生產力和氮循環過程。
眾多研究表明,溫度是限制土壤氮礦化作用最重要的環境因子之一[5]。目前,國內外學者關于室內增溫對土壤氮礦化作用的影響已開展大量研究[6];然而,相較室內增溫研究,野外增溫研究能夠有效模擬氣候變暖,對正確認識生態系統對全球氣候變化的響應和適應機制具有重要意義。關于野外增溫對土壤氮礦化作用的研究主要集中在森林[7]、草地[8]和濕地[9]等生態系統,由于研究區域生態系統的差異,增溫對氮礦化作用的影響表現為促進[10]、抑制[11]和無影響[12]。有關荒漠生態系統,尤其是該生態系統的重要組成部分——生物土壤結皮[13]覆蓋土壤氮循環特征對增溫的響應也有一些研究[14],但從不同水平(功能基因→微生物生物量→酶活性)闡明土壤氮礦化對增溫的響應機制方面的研究涉及較少。
生物土壤結皮廣泛分布于荒漠生態系統中,其繁衍和拓殖對土壤氮循環過程起著重要的調節作用[15]。因此,本研究以該區域蘚類結皮為研究對象,采用開頂式生長室(open-top chamber,OTC)模擬增溫,通過野外培養原狀土柱的方法,探究增溫對蘚類結皮土壤氮轉化特征、微生物生物量、酶活性和功能基因的影響,揭示蘚類結皮土壤氮轉化特征對增溫的響應機制,為進一步認知未來氣候變暖背景下蘚類結皮在土壤氮循環中的生態功能提供理論依據。
1 材料與方法
1.1 研究區概況
研究區位于寧夏中衛市(37°25′N,104°36′E)以西50 km處的一碗泉天然植被區。該區位于騰格里沙漠東南緣,海拔1 339 m,屬于典型的草原化荒漠向荒漠化草原的過渡帶。年均氣溫10.6℃,極端最低氣溫為-25.1℃,極端最高氣溫為38.1℃,最明顯的特征是冬夏季具有較大的晝夜溫差;年降水量和年均潛在蒸發量分別為186 mm和2 900 mm;平均風速2.6 m·s-1,年降塵天數59 d。
該區灌木、半灌木群落主要以檸條(Caragana korshinskii)和油蒿(Artemisia ordosica)為主,優勢草本植物有茵陳蒿(Artemisia capillaries)、小畫眉草(Eragrostis poaeoides)和刺沙蓬(Salsola ruthenica)。稀疏的植被間大量分布著發育良好的蘚類結皮,形成獨特的地表微景觀。具體土壤理化性質見表1。
1.2 土壤樣品采集
以蘚類結皮和無結皮為主的兩個微生境進行采樣,兩個微生境相距5~10 m。采樣時,首先去除地上部分凋落物層,用硬質聚氯乙烯(PVC)管(直徑和高度均為10 cm)在每個微生境中隨機采集30個樣品,樣品間間隔1~3 m,為保證氣體交換,土壤樣品底部用細網狀尼龍密封。共采集了60個土壤樣品(每個微生境30個樣品,2個微生境)。
1.3 模擬增溫試驗
增溫裝置OTC采用1m×1m×1m的透光性極好的玻璃板制成,使用數據記錄器(Mlog5W-rt,德國)記錄了OTC中的空氣溫濕度,研究期間平均氣溫增加0.7℃,平均降水減少10 mm。然后將每個微生境采集的樣品隨機選取5個分別放進3個OTC中(3個重復)進行增溫處理。同時用數據采集器(EM50,UGT,美國)監測土壤表層(0~5 cm)溫濕度。經過3年(2016年1月至2018年12月)增溫處理后,去除表層結皮后,采集表層土壤,為了降低空間異質性,將5個樣品混合成為一個樣品,每種處理設三個重復,然后保存于干冰中,立即帶回實驗室。所有樣品立即過1 mm篩,一部分土樣用于各理化指標、無機氮含量、微生物生物量和酶活性測定,另一部分土樣保存于-80℃冰箱中,用于宏基因組測序。
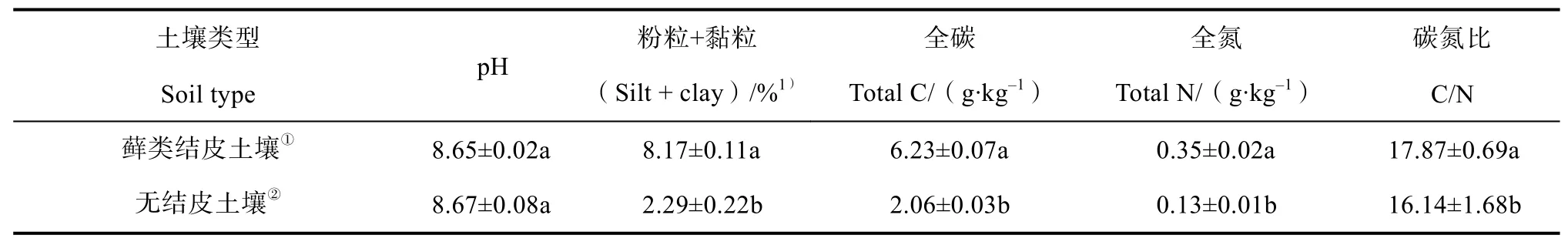
表 1 研究區0~5 cm土壤基本理化性質Table 1 Physical and chemical properties of the top soil(0~5 cm)in the study area
1.4 測定方法
土壤理化指標測定:土壤pH采用玻璃電極法測定(水︰土=5︰1);粒徑采用激光粒度儀法測定;土壤全碳含量采用元素分析儀(Vario EL III型,Elementar,德國)測定;土壤全氮含量采用凱氏定氮法測定,樣品分析在取樣后24 h內完成。
無機氮含量、微生物生物量和酶活性測定:運用2 mol·L-1KCl溶液浸提土壤,采用全自動間斷化學分析儀(SmartChem140,AMS/Westco,意大利),利用靛酚藍比色法和硫酸肼法分別測定銨態氮和硝態氮的含量,計算土壤凈氨化速率、凈硝化速率和凈氮礦化速率。采用氯仿熏蒸法測定土壤微生物生物量碳和氮;N-乙酰-β-D-葡萄糖苷酶和亮氨酸氨基肽酶的活性用黑色聚苯乙烯96孔板進行熒光檢測;測定脲酶活性的方法是使用10%尿素溶液作為基質,在37℃恒溫箱中培養24 h,然后用分光光度計(721型,上海欣茂)測定578 nm波長處的濃度。
宏基因組測序法:1)DNA提取及測序:利用Fast DNA Spin Kit(MP Biomedicals,Santa Ana,CA,美國)試劑盒進行樣品DNA的提取,提取后利用1%瓊脂糖凝膠電泳檢測DNA完整性;后通過Covaris M220(基因公司,中國)將DNA片段化,篩選約300 bp的片段;接著使用NEXTFLEX Rapid DNA-Seq(Bioo Scientific,美國)構建PE文庫;然而進行橋式PCR擴增,擴增后使用Illumina Hiseq(Illumina,美國)測序平臺進行宏基因組測序。2)數據質控和基因豐度的預測:利用軟件Fastp對原始數據進行質控,質控后使用基于succinct de Bruijn graphs原理的拼接軟件MEGAHIT對優化序列進行拼接組裝,拼接組裝后篩選大于等于300 bp的重疊群(contigs);接著使用MetaGene軟件對重疊群(contig)進行開放閱讀框(ORF)預測;然后使用CD-HIT軟件對所有樣品預測出來的基因序列進行聚類,構建非冗余基因集;最后使用SOAPaligner軟件將每個樣品中的高質量序列(reads)與非冗余基因集進行比對(95% identity),統計基因在對應樣品中的豐度信息。
1.5 數據處理
土壤凈氨化速率=(培養后的銨態氮濃度-培養前的銨態氮濃度)/培養時間
土壤凈硝化速率=(培養后的硝態氮濃度-培養前的硝態氮濃度)/培養時間
土壤凈氮礦化速率=(培養后的無機氮濃度-培養前的無機氮濃度)/培養時間
其中,公式中培養時間均為3年。
采用SPSS20.0軟件對數據進行單因素方差分析、雙因素方差分析和配對樣本T檢驗:單因素方差分析(One-way ANOVA)用來比較不同處理之間各個參數的差異顯著性;雙因素方差分析(Two-way ANOVA)用來分析增溫與蘚類結皮及其交互作用對土壤凈氮轉化速率和酶活性等指標的影響;配對樣本T檢驗用來分析土壤凈氮轉化速率、酶活性等參數在對照與增溫處理之間的差異顯著性;利用多重比較(Tukey HSD)法進行差異顯著性檢驗(α=0.05);對基因豐度與凈氮轉化速率的關系做了相關性分析。運用Origin 8.5軟件作圖,圖表中數據為平均值±標準差。
2 結 果
2.1 增溫處理土壤溫度和濕度的動態變化
如圖1所示,增溫處理后蘚類結皮土壤和無結皮土壤溫度均呈現出增加的趨勢,分別較對照增加了3.57℃和3.62℃;而土壤濕度則明顯減少,分別較對照減少了1.26%和2.43%。
2.2 增溫對土壤凈氮轉化速率的影響
增溫和土壤類型均對凈氨化速率、凈硝化速率和凈氮礦化速率具有顯著影響并且兩者之間存在明顯的交互作用(表2)。增溫顯著降低了蘚類結皮土壤凈氮轉化速率:凈氨化速率、凈硝化速率和凈氮礦化速率分別較對照處理降低了49.5%、63.2%和59.7%;而無結皮土壤凈氮轉化速率在增溫與對照處理之間差異不顯著。相同處理下,蘚類結皮土壤凈氮轉化速率明顯高于無結皮土壤(圖2)。
2.3 增溫對土壤酶活性的影響
增溫和土壤類型均對N-乙酰-β-D-葡萄糖苷酶活性和脲酶活性具有顯著影響并存在明顯交互作用(表2)。由圖2可以看出,經增溫處理后,蘚類結皮土壤相關酶活性(N-乙酰-β-D-葡萄糖苷酶活性、亮氨酸氨基肽酶活性和脲酶活性)均顯著下降,分別較對照減少36.4%、21%和19.8%;而對于無結皮土壤,除土壤脲酶活性較對照顯著減少20.6%外,其余酶的活性在增溫前后差異不顯著。此外,蘚類結皮土壤酶的活性均顯著高于無結皮土壤。
2.4 增溫對土壤微生物生物量碳氮的影響
增溫和土壤類型均對微生物生物量碳氮具有顯著影響,增溫與土壤類型對微生物生物量碳的影響存在明顯交互作用,而對微生物生物量氮的影響無明顯交互作用(表2)。由表3可知,增溫處理后,蘚類結皮土壤微生物生物量碳氮含量顯著降低,分別較增溫前降低了28.4%和37.3%;無結皮土壤微生物生物量氮含量在增溫后處理下顯著降低了58.7%,而無結皮土壤微生物生物量碳含量在增溫后與增溫前處理之間差異不顯著。此外,蘚類結皮土壤微生物生物量碳氮含量明顯高于無結皮土壤。
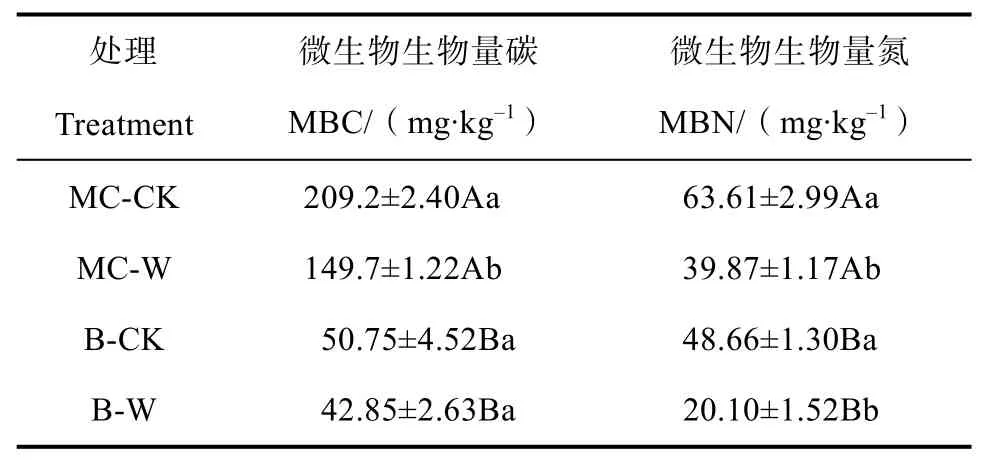
表3 增溫處理下的土壤微生物生物量碳氮Table 3 Effects of warming on soil microbial biomass carbon and nitrogen
2.5 增溫對土壤氮轉化特征相關功能基因的影響
增溫和土壤類型均對基因gdh、hao和amoA具有顯著影響且存在明顯的交互作用(表2)。蘚類結皮土壤基因ureC、hao和amoA豐度在增溫處理后顯著降低,分別為增溫前的70%、68%和49%,而基因gdh豐度則無明顯變化;無結皮土壤基因ureC、gdh和hao豐度在增溫處理后顯著降低,分別為增溫前的61%、71%和49%,而基因amoA豐度則無明顯變化。相同處理下,蘚類結皮土壤中ureC、gdh、hao和amoA基因豐度明顯高于無結皮土壤(圖3)。基因ureC豐度和gdh豐度與凈氨化速率呈顯著正相關,基因hao豐度和amoA豐度與凈硝化速率呈顯著正相關(表4)。
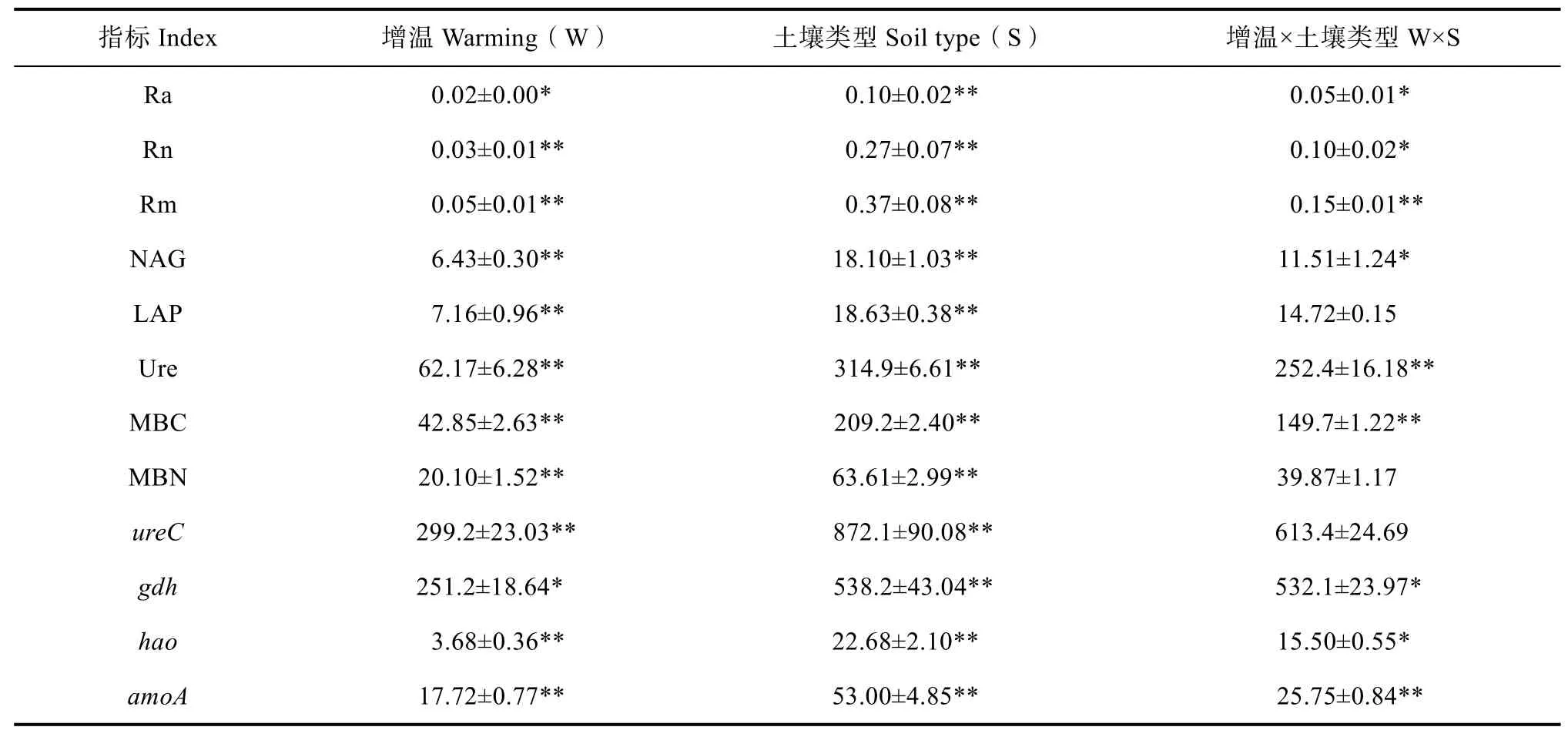
表2 增溫(W)和土壤類型(S)對土壤凈氮轉化速率、酶活性、微生物生物量和氮轉化相關基因豐度影響的雙因素分析Table 2 Two-way analysis of the effects of warming(W)and soil type(S)on soil net nitrogen transformation rate,enzyme activity,microbial biomass and nitrogen transformation related gene abundances
3 討 論
3.1 增溫對土壤氮轉化特征的影響
溫度是影響土壤氮轉化過程的關鍵因子之一。本研究結果表明,增溫抑制了蘚類結皮土壤氮轉化過程。這與武丹丹等[11]在青藏高原高寒草甸土壤的研究結果一致。然而,對增溫后草地[16]和森林生態系統[10]土壤氮轉化過程的研究則發現,溫度升高對土壤氮轉化過程具有明顯促進作用。造成研究結果不一致的原因可能是以下三點:1)生態系統的差異;2)增溫會導致土壤濕度顯著降低(圖1),土壤水分的喪失限制了土壤微生物活性,進而抑制土壤氮轉化過程;3)增溫會引起結皮特別是蘚類結皮生物量及蓋度的減少[17],結皮的退化破壞了其維持土壤微環境的能力,溫度和水分的變化改變了微生物的活性,從而影響土壤氮素轉化過程。此外,相比較無結皮土壤而言,蘚類結皮土壤具有較高的凈氮轉化速率,這與結皮下較高的養分含量密切相關(表1),這些有機物質為酶促反應提供豐富基底物質的同時也為微生物生長提供了養分[18]。可以看出,生物結皮參與并且調節了增溫對氮轉化速率的影響。
3.2 增溫對土壤微生物生物量、酶活性和功能基因的影響
土壤微生物生物量是土壤有機質組分中最具活力的部分,在土壤氮轉化過程中發揮著主要作用[19]。溫度是影響土壤微生物生物量的主要環境因子[20]。本研究中,增溫顯著減少蘚類結皮土壤微生物生物量碳氮。Fu等[21]在青藏高原高寒草甸開展的研究得到的結論也支持該結果。然而,Zhang等[22]在青藏高原高寒草甸生態系統利用紅外線加熱器進行增溫(0.8~1.1℃)試驗,發現土壤溫度升高可增加土壤微生物生物量碳氮;Schmidt等[23]在濕地苔原土壤使用塑料大棚進行增溫處理(1~2℃),結果表明土壤微生物生物量碳對增溫無響應。研究結果具有差異的原因可能是由于增溫方式的不同所造成的,本研究所采用的OTC不僅能夠增溫而且具有減雨的效果,進而改變了土壤濕度(圖1)。此外,由于蘚類結皮土壤具有較高的土壤濕度(圖1)和養分含量(表1),這些土壤特性有助于土壤微生物的活動和繁殖[24-25],因此,微生物生物量碳氮相比無結皮土壤會出現明顯增加,之前的研究也證實了這一結果[26]。因此,增溫下蘚類結皮對土壤濕度和養分含量的調節會顯著影響微生物生物量碳氮,進而對土壤氮轉化過程產生影響。
在酶活性水平上,土壤酶推動著地下生態系統氮循環,并且酶活性是衡量微生物群落功能的一個重要指示參量,也是研究對環境變化響應的有用指標[27-29]。N-乙酰-β-D-葡萄糖苷酶、亮氨酸氨基肽酶和脲酶是參與氮轉化過程的主要酶類,其中N-乙酰-β-D-葡萄糖苷酶和亮氨酸氨基肽酶參與了幾丁質和蛋白質中氮的礦化作用,脲酶能將尿素水解成氨[30-31]。本研究中,蘚類結皮土壤酶活性在增溫條件下顯著下降,可能是由于增溫會導致土壤變干,使土壤濕度明顯降低(圖1),限制了土壤微生物活性,進而抑制酶活性。陳曉麗等[32]在貢嘎山暗針葉林土壤進行研究時也得到相同的結果。然而,Zhou等[30]和王學娟等[33]在半干旱溫帶草原和長白山苔原生態系統的研究也表明溫度升高增加了N-乙酰-β-D-葡萄糖苷酶活性和亮氨酸氨基肽酶活性以及脲酶活性。可以看出,土壤酶對土壤溫濕度變化的敏感性不同。此外,隨著溫度的升高,土壤微生物會減少酶的合成和分泌[34]。與無結皮土壤相比,蘚類結皮土壤呈現較高的酶活性,這與蘚類結皮較高的養分含量有關(表1),蘚類結皮可為土壤微生物提供更高的有機質含量,從而為微生物創造更有利的環境[35],本結論得到Liu等[36]研究結果的支持。因此,土壤酶活性的顯著變化主要是由于氣候變暖下蘚類結皮調節的土壤養分含量的影響,進而調節氮轉化過程。
對于功能基因水平而言,氮轉化功能基因豐度在增溫條件下顯著改變,進而會影響氮轉化過程[37]。本研究結果顯示,功能基因豐度與氮轉化過程密切相關(表4),增溫顯著降低蘚類結皮土壤氨化基因(ureC)和硝化基因(hao和amoA)豐度,進一步抑制氨化作用和硝化作用。編碼蘚類結皮土壤脲酶、羥胺氧化酶和氨單加氧酶基因的豐度在增溫后顯著降低。ureC基因將尿素轉化為氨,amoA基因催化氨氧化,得到羥胺,hao基因進一步氧化得到亞硝酸。導致基因豐度下降的原因可能歸因于幾種主要細菌類群的豐度降低。Yang等[38]在高寒草原的研究也發現功能基因豐度與氮轉化過程密切相關,然而增溫后氨化基因ureC和硝化基因amoA豐度增加,促進了氨化作用和硝化作用。造成研究結果差異的主要原因是本研究運用的OTC模擬增溫裝置,其裝置本身具有增溫減雨的作用,因而造成土壤濕度存在差異。此外,研究還發現增溫會引起蘚類結皮的退化[17],進而改變土壤微環境,最終加速了這種抑制作用。
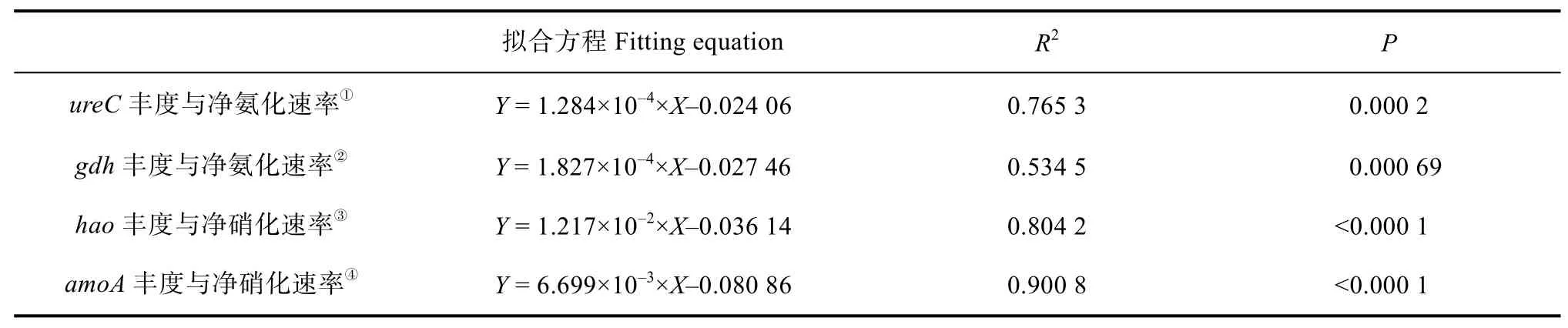
表4 功能基因與凈氮轉化速率的相關性Table 4 Correlations between functional genes and net nitrogen transformation rate
4 結 論
在增溫條件下,土壤變干的間接影響和蘚類結皮的退化喪失了對土壤微環境的調節作用,土壤微生物生物量碳氮和氮轉化功能基因豐度(ureC、hao和amoA)顯著降低,土壤酶活性受到明顯抑制,進而影響土壤氮轉化過程。

