混合菌種發酵大豆黃漿水的工藝優化
于 冰,高芫超,張 妍,呂佳璐,張莉力,許云賀?
(錦州醫科大學 食品科學與工程學院,遼寧 錦州 121000)
我國是大豆的發源地,從古至今,豆制品的種類多種多樣,而豆腐是最受歡迎的一種豆制品。在豆腐擠壓成型過程中所產生的、組織狀態為棕黃色膠體混合物的廢水,即為大豆黃漿水。隨著我國豆腐產業的快速發展,大豆黃漿水產量也逐漸增加。研究表明,大豆中的生理活性物質會在豆腐生產過程中隨著黃漿水而流失,大豆黃漿水中蛋白質、碳水化合物、脂類、色素以及鹽類物質含量豐富[1-4],但其化學需氧量和生物需氧量均較高,直接排放到環境中不僅浪費資源,而且會造成環境的污染[5]。大豆黃漿水中含有大量的微生物生長所需的營養基質[6],黃莉等[7]利用木醋桿菌對黃漿水進行發酵,生產細菌纖維素。劉平[8]利用大豆黃漿水發酵生產維生素 B12。伊靜等[9]以黃漿水和山楂為主要原料,經調配和乳酸菌發酵技術制備功能性飲品。因而將黃漿水作為微生物發酵基質,以甘蔗糖蜜作為碳源,既降低發酵成本,又有效解決大豆黃漿水污染問題,實現資源的再利用。
本實驗利用乳酸菌和酵母菌對黃漿水進行發酵,以甘蔗糖蜜為碳源,考察糖蜜添加量和初始pH以及不同培養條件對發酵后大豆黃漿水中乳酸菌及酵母菌活菌數的影響,并為后續開發動物微生態制劑打下基礎,為制備動物微生態制劑提供廉價的原料以及生產工藝,為大豆黃漿水的綜合利用提供新的途徑和理論依據。
1 材料與方法
1.1 實驗材料
大豆黃漿水:錦州市氣象臺豆腐廠生產;干酪乳桿菌、發酵乳桿菌、釀酒酵母:由實驗室保存;乳酸細菌培養基(MRS培養基)、孟加拉紅培養基:天津市科密歐化學試劑;其他試劑均為國產分析純。
1.2 儀器與設備
DHP-9082型恒溫培養箱:金壇市鑫鑫實驗儀器廠;SW-CJ-1C超凈工作臺:蘇州凈化;M4-AL204電子分析天平:蘭州中西儀器;YXQ-LS型立式壓力蒸汽滅菌器:上海博訊實業有限公司;DHG-9245A型高低溫恒溫振蕩培養箱:上海一恒科技有限公司。
1.3 方法
1.3.1 菌種種子液制備
黃漿水中加入5%的糖蜜微熱混合均勻,121 ℃滅菌15 min,冷卻至室溫后,從斜面接一環乳酸菌到黃漿水培養基,37 ℃培養24 h;將酵母菌接入上述黃漿水培養基中,28 ℃培養72 h,進行活化培養。
1.3.2 發酵液的制備方法
在添加5%糖蜜、初始pH菌種為6.0的黃漿水培養基中,按接種量為 5%,接種菌種比例為V(發酵乳桿菌):V(干酪乳桿菌)∶V(釀酒酵母)= 1∶1∶1,轉速為120 r/min[10],37 ℃振搖培養 72 h。
1.3.3 單因素實驗
1.3.3.1 糖蜜添加量對活菌數的影響 在黃漿水培養基中調整添加1%、3%、5%、7%、9%糖蜜,培養條件同 1.3.2,考察糖蜜添加量對活菌數的影響。
1.3.3.2 初始 pH對活菌數的影響 依據 1.3.3.1的研究結果,確定糖蜜的最佳添加量后,調整初始pH為5.2、5.6、6.0、6.4、6.8,其它培養條件同1.3.2,考察初始pH對活菌數的影響。
1.3.3.3 接種量對活菌數的影響 依據1.3.3.2的研究結果,調整接種量為1%、3%、5%、7%、9%,其它培養條件同 1.3.2,考察接種量對活菌數的影響。
1.3.3.4 接種比例對活菌數的影響 依據 1.3.3.3的研究結果,調整接種比例為1∶1∶2、1∶2∶1、1∶1∶1、2∶1∶1、2∶2∶1,轉速為 120 r/min,37 ℃振搖培養72 h,考察接種比例對活菌數的影響。
1.3.3.5 轉速對活菌數的影響 依據1.3.3.4的研究結果,調整轉速為 80、100、120、140、160 r/min,37 ℃振搖培養72 h,考察培養轉速對活菌數的影響。
1.3.3.6 培養溫度對活菌數的影響 依據 1.3.3.5的研究結果,調整培養溫度為31、33、35、37、39 ℃,振搖培養72 h,考察培養溫度對活菌數的影響。
1.3.3.7 培養時間對活菌數的影響 依據 1.3.3.6的研究結果,調整培養時間為24、48、72、96、120 h,考察培養時間對活菌數的影響。
1.3.4 乳酸菌總數的測定
采用 GB4789.35—2016《食品安全國家標準食品微生物學檢驗乳酸菌檢驗的方法》測定乳酸菌總數。
1.3.5 酵母菌總數的測定
采用 GB4789.15—2016《食品安全國家標準食品微生物學檢驗霉菌酵母計數檢驗的方法》測定酵母菌總數。
1.3.6 響應面實驗
在單因素實驗的基礎上,以乳酸菌活菌數(Y)為指標,以糖蜜添加量(A)、發酵溫度(B)、初始pH(C)為自變量,根據Box-Behnken實驗設計原理,采用軟件Design-Expert V8.0.6.1設計三因素三水平的響應面分析實驗,實驗因素與水平設計表1所示。

表1 響應面優化實驗因素與水平Table 1 Factors and levels of response surface optimization test
1.3.7 數據處理
實驗數據用Microsoft Excel 2010進行初步整理,每組實驗重復3次,實驗結果以平均值±標準偏差的形式表示;采用SPSS 22.0軟件對單因素數據進行方差分析,并采用LSD法進行多重比較,P>0.05為差異不顯著,P<0.05為差異顯著。
2 結果與分析
2.1 單因素實驗
2.1.1 糖蜜添加量對活菌數影響
甘蔗糖蜜呈深棕色、黏稠狀和半流動的液態,含多種活性物質,可作為微生物的碳源或基料[11]。由圖1可知酵母菌菌數隨著糖蜜添加量的增加呈先降低后升高的趨勢,在糖蜜添加量為3%時,菌數達到最低值。隨著糖蜜添加量的增加乳酸菌菌數先升高后降低,在糖蜜添加量為 5%時菌數最高,達到 1.72×109CFU/mL,顯著高于其他糖蜜添加量(P<0.05),所以綜合考慮本實驗以糖蜜添加量5%為宜。

圖1 糖蜜添加量對活菌數的影響Fig.1 The effect of molasses addition on the number of viable bacteria
2.1.2 初始pH對活菌數影響
由圖2可知,酵母菌菌數在初始pH為5.6時最高為3.61×107CFU/mL,初始pH為6.4時菌數次之。隨著初始 pH的逐漸升高,乳酸菌菌數先降低后升高,在初始pH為6.8時最高,活菌數為2.03×109CFU/mL,顯著高于其他pH(P<0.05),該因素影響到細菌的分裂程度,可能與細胞分裂誘導機制有關[12],綜合分析確定本實驗初始 pH為6.8。
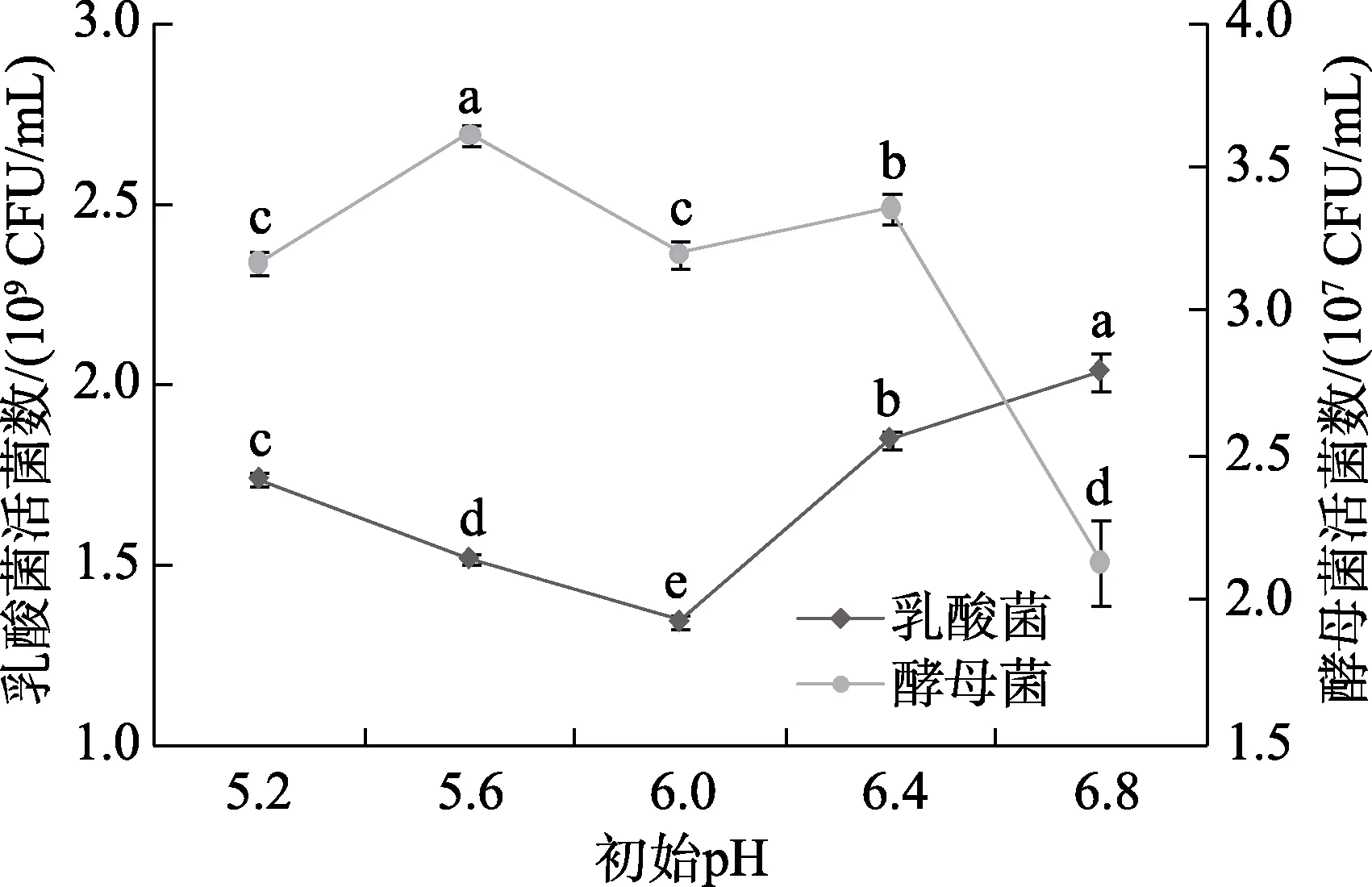
圖2 初始pH對活菌數的影響Fig.2 The effect of initial pH on the number of viable bacteria
2.1.3 接種量對活菌數的影響
由圖3可知,在接種量為6%時,乳酸菌菌數最高為 2.16×109CFU/mL,顯著高于其他接種量(P<0.05),接種量為 7%時菌數下降。這可能因為隨著接種量增多,乳酸菌因群體感應可以更快的適應環境,并快速生長,但當接種量超過一定限度,乳酸菌間會因為競爭營養和生存空間導致乳酸菌的活菌數反而下降[13]。酵母菌菌數在接種量為7%時最高為5.5×107CFU/mL,但是接種量為6%與7%差異不顯著(P>0.05),因此確定最佳接種量為6%。
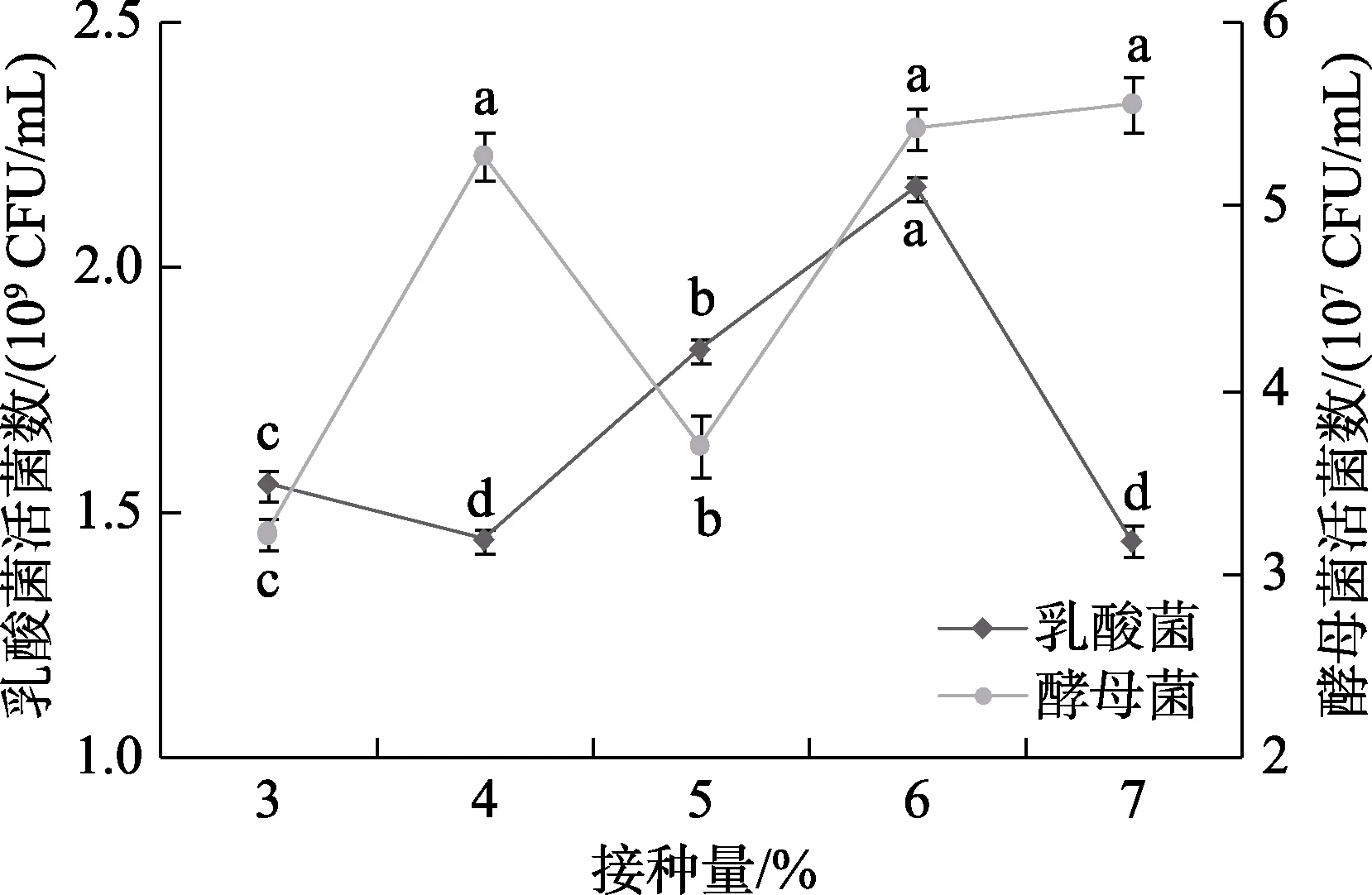
圖3 接種量對活菌數的影響Fig.3 The influence of inoculation amount on the number of viable bacteria
2.1.4 接種比例對活菌數的影響
由圖4可知,當接種比例為1∶1∶1時,乳酸菌和酵母菌的活菌數都達到最高,乳酸菌菌數2.34×109CFU/mL,酵母菌菌數為5.7×107CFU/mL,二者菌數均顯著高于其他接種比例(P<0.05)。這可能是因為在接種比例為1∶1∶1時,共生促進生長作用大于起始菌數的影響[14],所以確定此接種比例對于混合發酵較為合適。

圖4 接種比例對活菌數的影響Fig.4 The effect of inoculation ratio on the number of viable bacteria
2.1.5 培養轉速對活菌數的影響
由圖5可知,隨著轉速的增大,乳酸菌和酵母菌活菌數均呈先增高后降低的趨勢。當轉速為120 r/min時,乳酸菌活菌數為2.35×109CFU/mL,顯著高于其他培養轉速(P<0.05),酵母菌活菌數為6.1×107CFU/mL。這可能因為轉速適當時,將新增的菌體均勻的分散,與培養基充分接觸,更加有利于菌體的生長。然而當轉速超過一定限度時,菌體數量反而降低,這可能是因為當轉速過高時,剪切力過大,使菌體受到損傷,影響其正常生長[15],所以確定培養轉速為120 r/min。
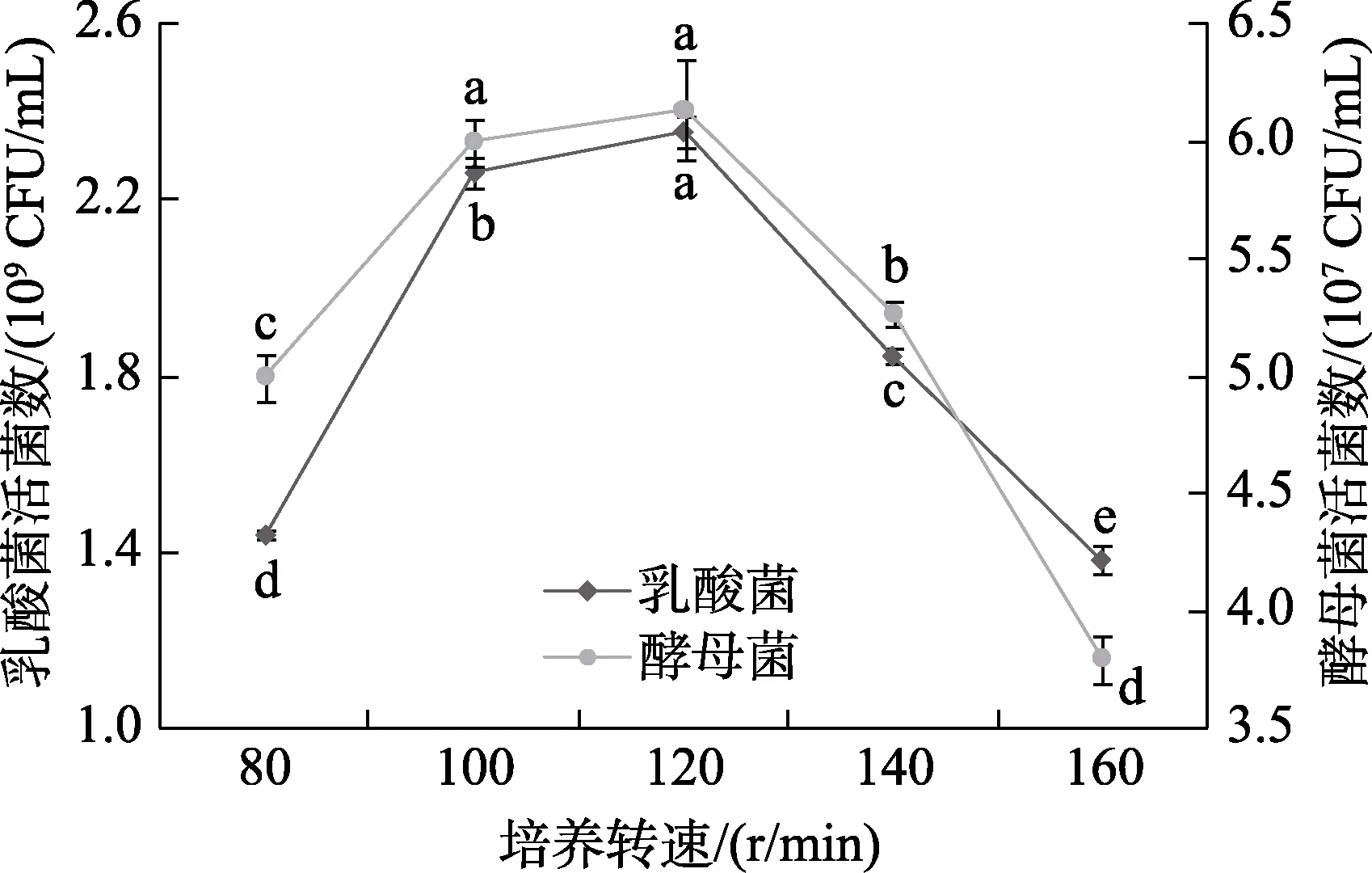
圖5 培養轉速對活菌數的影響Fig.5 The influence of culture speed on the number of viable bacteria
2.1.6 培養溫度對活菌數的影響
由圖 6可知,當培養溫度為 31 ℃,乳酸菌和酵母菌活菌數均顯著高于其他溫度(P<0.05),酵母菌菌數為3.5×108CFU/mL,隨著溫度升高,超過適合酵母菌生存的溫度,活菌數逐漸下降,當溫度為 39 ℃時,沒有酵母菌存活。而乳酸菌在31 ℃時菌數最高達到3.0×109CFU/mL,這可能因為乳酸菌為厭氧菌、酵母菌為兼性好氧菌,二者都具有耐酸性,且酵母菌主要在早期生長并產生大量的菌體及代謝產物,而乳酸菌在該溫度可以存活,并且能夠利用酵母菌的代謝產物進行生長[16],因此最佳培養溫度為31 ℃。

圖6 培養溫度對活菌數的影響Fig.6 The influence of culture temperature on the number of viable bacteria
2.1.7 培養時間對活菌數的影響
從圖7可知,酵母菌在培養時間為72 h時活菌數最高,這是因為酵母的生長周期長于乳酸菌,乳酸菌在培養時間為 48 h時,活菌數最高為3.18×109CFU/mL,顯著高于其他培養時間(P<0.05),培養72 h菌數顯著下降,乳酸菌單獨培養到24 h大致進入衰亡期,但乳酸菌48 h時菌數最高,可能是由于添加了酵母菌混合發酵,乳酸菌的衰亡期推后[17],綜合考慮培養時間以 48 h為宜。

圖7 培養時間對活菌數的影響Fig.7 The influence of culture time on the number of viable bacteria
2.2 響應面法優化培養條件
2.2.1 響應面優化實驗結果與分析
依據單因素實驗結果,固定接種量為6%、接種比例為1∶1∶1、轉速為120 r/min、培養時間為 48 h,選擇糖蜜添加量(A)、初始 pH(B)、培養溫度(C)3個因素為自變量,因乳酸菌對多種腸道疾病有潛在的抑制作用,是制備微生態制劑的主要菌種,所以將大豆黃漿水發酵液中乳酸菌的活菌數(Y)作為響應值,根據 BoxBehnken設計原理進行響應面實驗,實驗共17個實驗點,其中14個為析因點,5個為中心點,實驗設計方案和結果如表2所示。
2.2.2 模型的建立與顯著性分析
利用Design-Expert V8.0.6.1軟件對表2中的數據進行二次多元回歸擬合分析,得到綜合評分Y對響應面因素的二次多項回歸方程:

表2 響應面分析實驗設計及結果Table 2 Test design and results of response surface analysis
Y=+3.18+0.16A+8.750E–003B–0.046C+5.000E–003AB+0.040AC–0.062BC–0.66A2–0.68B2–0.73C2。在該二次多元回歸方程中,各項系數的絕對值大小反映了其所對應因子對乳酸菌活菌數的影響程度[18],對該回歸方程進行分析可知,3個因子對乳酸菌活菌數的影響程度為:糖蜜添加量>培養溫度>初始pH。
由表3可知,回歸模型的P值<0.000 1,說明模型高度顯著;決定系數R2為0.997 7,校正系數Radj2為0.994 7,決定系數R2高于0.90,說明回歸模型的擬合程度高,實驗誤差較小。失擬項P>0.05為不顯著,進一步說明回歸模型與實際情況擬合程度較高[19],可用該模型來分析和預測大豆黃漿水發酵的工藝參數。
從表 3回歸方程系數顯著性檢驗可知,一次項糖蜜添加量(A),二次項糖蜜添加量(A2)、初始pH值(B2)、培養溫度(C2)對乳酸菌活菌數影響極顯著(P<0.01),一次項培養溫度(C)、初始pH和培養溫度的交互項(BC)對乳酸菌活菌數影響顯著(P<0.05),其他項影響不顯著。

表3 方差分析結果Table 3 ANOVA results
2.2.3 響應面交互作用分析
圖 8~10是依據回歸方程所繪制出各因素交互作用的響應面圖及等高線圖,等高線圖的形狀即反映交互作用的強弱,圓形表示兩因素交互作用不顯著,而橢圓形表示兩因素交互作用顯著[20-21]。由8至10響應面圖可以看出,乳酸菌活菌數隨著糖蜜添加量、初始pH、培養溫度的變化出現先升高后降低的趨勢。由圖8和圖9等高線圖可知,等高線圖趨近于圓形,表示糖蜜添加量和初始pH、培養溫度對乳酸菌活菌數的交互作用不顯著。而圖 10等高線圖呈橢圓形,表示初始pH與培養溫度對乳酸菌活菌數的交互作用顯著。
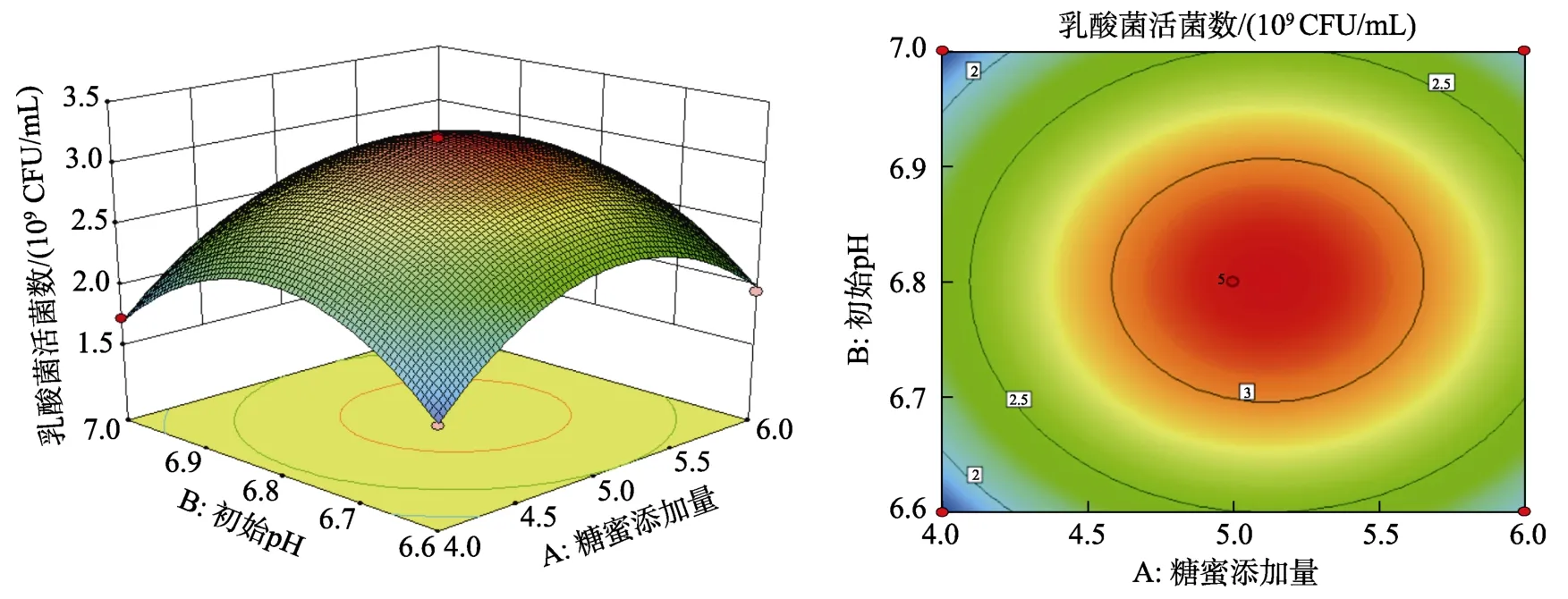
圖8 糖蜜添加量(A)與初始pH(B)對乳酸菌活菌數的曲面圖和等高線圖Fig.8 Curved surface and contour plots of molasses addition (A) and initial pH (B) on the number of viable lactic acid bacteria
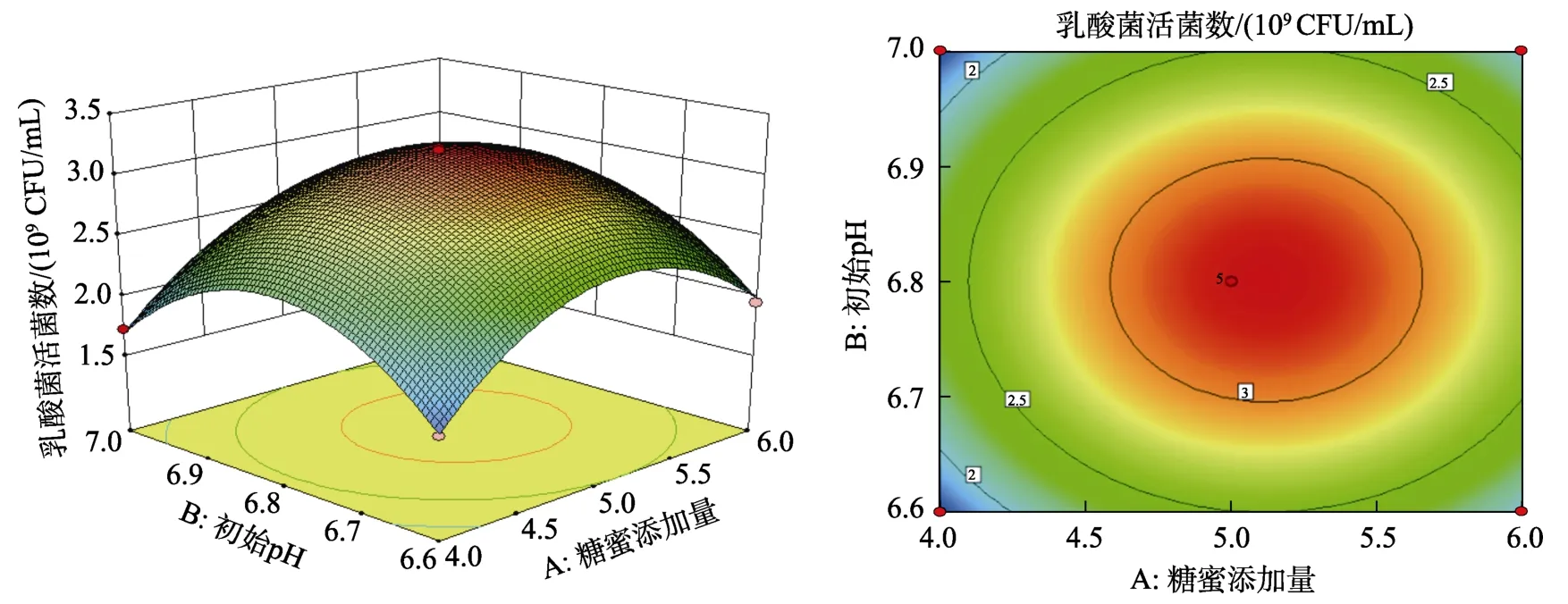
圖9 糖蜜添加量(A)培養溫度(C)對乳酸菌活菌數的曲面圖和等高線圖Fig.9 Curved surface and contour plot of molasses addition amount (A) culture temperature(C) on the number of viable lactic acid bacteria
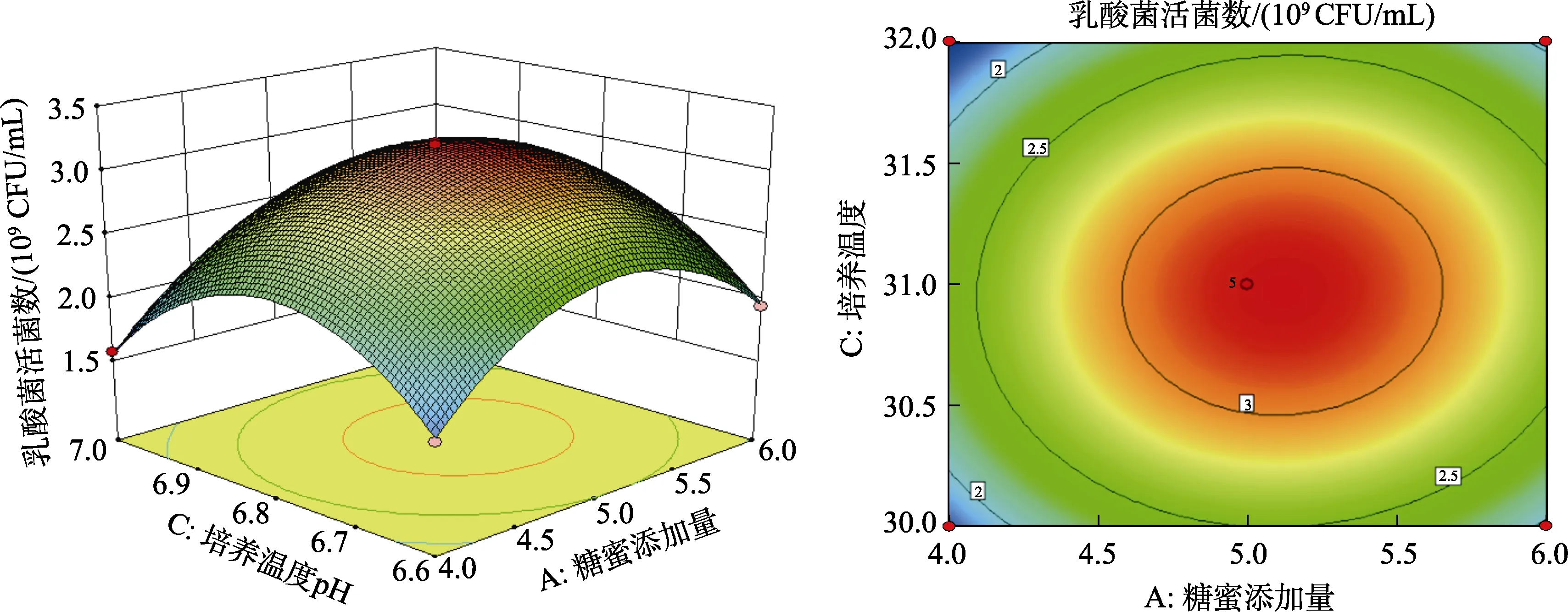
圖10 初始pH(B)與培養溫度(C)對乳酸菌活菌數的曲面圖和等高線圖Fig.10 Curved surface plot and contour plot of initial pH (B) and culture temperature(C) on the number of viable lactic acid bacteria
經統計分析優化得到最佳培養條件為:糖蜜添加量5.12%,初始pH6.80,培養溫度30.97 ℃,此時發酵液中乳酸菌的活菌數的理論值達到3.19×109CFU/mL。
2.2.4 最佳培養條件驗證
按照實驗得出的培養條件校正為:糖蜜添加量5%,初始pH 6.80,培養溫度31 ℃進行3次重復實驗得到實際的發酵液中乳酸菌的活菌數為(3.18±0.05)× 109CFU/mL,與預測值接近,酵母菌菌數為(4.1±0.10)× 108CFU/mL。由此可見響應面分析法優化的大豆黃漿水發酵工藝條件可行,參數較為可靠,具有一定的實用價值。
3 結論
本研究在單因素實驗的基礎上,利用響應面法優化乳酸菌和酵母菌混合發酵大豆黃漿水的工藝參數,結果表明最佳的工藝參數為:接種量6%、接種比例1∶1∶1、培養轉速120 r/min、培養時間48 h、糖蜜添加量5%、初始pH 6.80,培養溫度31 ℃,在此條件下大豆黃漿水發酵液中乳酸菌活菌數為 3.18×109CFU/mL,酵母菌菌數為 4.1×108CFU/mL,乳酸菌和酵母菌的活菌數相比優化前顯著提高,降低了微生態制劑的制作成本,為進一步利用大豆黃漿水提供技術參考。
備注:本文的彩色圖表可從本刊官網(http://lyspkj.ijournal.cn)、中國知網、萬方、維普、超星等數據庫下載獲取。

