茯苓酸抑制H2O2誘導的腦微血管內皮細胞凋亡及促進細胞存活
苗樹船 夏勛 張列
(成都醫學院第一附屬醫院神經外科,四川 成都 610500)
腦微血管內皮細胞凋亡可促使缺血性腦疾病的發生,而氧化應激可加重血管內皮細胞損傷[1-3]。既往研究顯示部分中藥可抑制氧化應激及炎癥反應從而減輕過氧化氫(H2O2)誘導的腦微血管內皮細胞損傷[4-5]。茯苓酸(pachymic acid,PA)屬于中醫傳統用藥,其主要是從茯苓中提取的主要活性成分,并可抑制氧化應激反應從而減輕腦缺血再灌注損傷[6]。但茯苓酸對H2O2誘導的腦微血管內皮細胞損傷尚未闡明。因此,本研究采用H2O2處理腦微血管內皮細胞建立細胞損傷模型,探討茯苓酸對H2O2誘導的腦微血管內皮細胞凋亡及增殖的影響,為茯苓酸治療缺血性腦血管疾病提供實驗依據。
1 材料與方法
1.1 材料與試劑 茯苓酸購自四川健騰生物技術有限公司,小鼠腦微血管內皮細胞株bEnd.3購自美國ATCC公司,過氧化氫購自國藥集團化學試劑有限公司,甲基噻唑基四唑(MTT)購自美國Sigma公司,細胞凋亡檢測試劑盒購自北京博邁斯科技發展有限公司,乳酸脫氫酶(LDH)、丙二醛(MDA)、過氧化氫酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH-Px)檢測試劑盒購自南京建成生物工程研究所,DMEM培養基購自美國Thermo Fisher公司,SDS凝膠制備試劑盒購自北京索萊寶科技有限公司,RIPA裂解液、BCA試劑盒購自上海碧云天生物技術有限公司,活性氧(ROS)檢測試劑盒購自上海翊圣生物科技有限公司,兔抗鼠活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved caspase-3)抗體購自美國CST公司,辣根過氧化物酶(HRP)標記的山羊抗兔IgG二抗購自北京中杉金橋生物技術有限公司。
1.2 方法
1.2.1 實驗處理與分組 腦微血管內皮細胞接種于96孔板(5×103個/孔),分別加入含有濃度為100 μmol/L的H2O2處理24 h[7],記作H2O2組。同時將正常培養的細胞作為NC組。取對數生長期腦微血管內皮細胞,分別加入含有濃度為10、20、40 μmol/L的茯苓酸與濃度為100 μmol/L的H2O2處理24 h[8],分別記作H2O2+PA 10 μmol/L組、H2O2+PA 20 μmol/L組、H2O2+PA 40 μmol/L組。
1.2.2 MTT檢測細胞存活率 收集對數生長期腦微血管內皮細胞接種于96孔板(3×104個/孔),分別加入濃度為10 μmol/L、20 μmol/L、40 μmol/L的茯苓酸與濃度為100 μmol/L的H2O2處理,于處理24、48、72 h時向各孔加入20 μL的MTT溶液,室溫孵育4 h,棄上清,加入DMSO(150 μL/孔),室溫振蕩孵育10 min,應用酶標儀檢測波長為490 nm處各孔吸光度值(OD)。計算細胞存活率(%)=(各實驗組OD值-空白對照組OD值)/(正常對照組OD值-空白對照組OD值)×100%。
1.2.3 檢測LDH活性與MDA的水平 收集各組細胞培養上清液,參照試劑盒說明書檢測LDH的活性。收集各組細胞,加入RIPA裂解液,4 ℃條件下經3000 r/min離心5 min,收集上清液,檢測MDA的水平,嚴格按照試劑盒說明書進行操作。
1.2.4 流式細胞術檢測細胞凋亡率 收集各組細胞,加入預冷PBS,4 ℃條件下經3000 r/min離心6 min,棄上清,收集細胞沉淀,加入500 μL結合緩沖液重懸細胞,依次分別加入5 μL Annexin V-FITC與5 μL PI,充分混勻,室溫孵育10 min,應用FACS Calibur流式細胞儀檢測細胞凋亡率。
1.2.5 檢測ROS、CAT、SOD、GSH-Px的水平 收集各組細胞,加入RIPA裂解液,4 ℃條件下經3000 r/min離心5 min,收集上清液,參照試劑盒說明書檢測ROS、CAT、SOD、GSH-Px的水平,嚴格按照試劑盒說明書進行操作。
1.2.6 蛋白免疫印跡(Western blot)檢測Cleaved caspase-3蛋白表達 收集各組細胞加入RIPA裂解液,冰上孵育30 min,4 ℃條件下經3000 r/min離心10 min,提取細胞蛋白,檢測蛋白濃度后進行變性,SDS-PAGE反應分離蛋白,轉移至PVDF膜,5%脫脂牛奶封閉2 h,分別加入一抗稀釋液(1∶1000),4 ℃孵育(24 h)后加入二抗稀釋液(1∶2000),TBST洗滌,室溫孵育1 h,暗室內曝光顯影,應用ImageJ軟件分析各條帶灰度值。
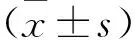
2 結果
2.1 不同濃度茯苓酸促進過氧化氫處理對腦微血管內皮細胞存活 不同時間、組別及交互作用下細胞存活率比較,差異均有統計學意義(P<0.05);與NC組比較,H2O2組細胞存活率顯著降低(P<0.05);與H2O2組比較,H2O2+PA 20 μmol/L組、H2O2+PA 40 μmol/L組細胞存活率顯著升高(P<0.05),且不同劑量組間比較差異有統計學意義(P<0.05),見表1。
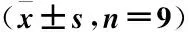
表1 不同濃度茯苓酸促進過氧化氫處理對腦微血管內皮細胞存活
2.2 不同濃度茯苓酸抑制過氧化氫處理對腦微血管內皮細胞損傷的影響 與NC組比較,H2O2組LDH、MDA的水平顯著升高(P<0.05);與H2O2組比較,H2O2+PA 20 μmol/L組、H2O2+PA 40 μmol/L組LDH、MDA的水平顯著降低(P<0.05),且不同劑量組間比較差異有統計學意義(P<0.05),見表2。
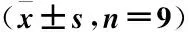
表2 不同濃度茯苓酸抑制過氧化氫處理對腦微血管內皮細胞損傷的影響
2.3 不同濃度茯苓酸對過氧化氫處理對腦微血管內皮細胞凋亡率的影響 與NC組比較,H2O2組細胞凋亡率顯著升高(P<0.05),Cleaved caspase-3蛋白水平顯著升高(P<0.05);與H2O2組比較,H2O2+PA 20 μmol/L組、H2O2+PA 40 μmol/L組細胞凋亡率顯著降低(P<0.05),Cleaved caspase-3蛋白水平顯著降低(P<0.05),且不同劑量組間比較差異有統計學意義(P<0.05),見圖1、2,表3。
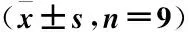
表3 不同濃度茯苓酸對過氧化氫處理腦微血管內皮細胞影響Cleaved caspase-3、Bcl-2和Bax蛋白表達

圖1 流式細胞術檢測腦微血管內皮細胞凋亡

圖2 檢測腦微血管內皮細胞中Cleaved caspase-3蛋白表達
2.4 不同濃度的茯苓酸對過氧化氫腦微血管內皮細胞活性氧產生的影響 與NC組比較,H2O2組ROS的水平顯著升高(P<0.05);與H2O2組比較,H2O2+PA 20 μmol/L組、H2O2+PA 40 μmol/L組ROS的水平顯著降低(P<0.05),且不同劑量組間比較差異有統計學意義(P<0.05),見表4。
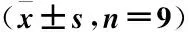
表4 不同濃度茯苓酸抑制過氧化氫處理腦微血管內皮細胞ROS產生
2.5 不同濃度的茯苓酸促進過氧化氫腦微血管內皮細胞CAT、SOD和GSH-Px產生 與NC組比較,H2O2組CAT、SOD、GSH-Px的水平顯著降低(P<0.05);與H2O2組比較,H2O2+PA 20 μmol/L組、H2O2+PA 40 μmol/L組CAT、SOD、GSH-Px的水平顯著升高(P<0.05),且不同劑量組間比較差異有統計學意義(P<0.05),見表5。
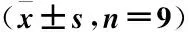
表5 不同濃度的茯苓酸對過氧化氫腦微血管內皮細胞CAT、SOD和GSH-Px的影響
3 討論
腦微血管內皮細胞增殖與凋亡失衡可能促使缺血性腦血管疾病的發生,因此如何調節微血管內皮細胞增殖及凋亡成為研究重點[9-10]。研究表明茯苓酸可抑制膿毒癥大鼠炎癥反應從而減輕其急性肺損傷[11]。茯苓酸可通過抑制炎癥反應從而改善敗血癥誘導的急性腎損傷[12]。茯苓酸可抑制脂多糖誘導的炎癥反應及細胞凋亡從而保護心肌細胞[13]。茯苓酸還可通過調控細胞凋亡蛋白表達從而參與腫瘤發生及增加細胞放射敏感性[14]。本研究結果提示茯苓酸可促進H2O2誘導的腦微血管內皮細胞存活。LDH、MDA的水平升高可反應炎癥反應,并可加重氧化應激反應的發生[15-16]。H2O2處理后腦微血管內皮細胞LDH、MDA的水平顯著升高,而茯苓酸處理后LDH、MDA的水平顯著降低,提示茯苓酸可減輕H2O2誘導的腦微血管內皮細胞氧化損傷。
細胞接收到凋亡信號時,線粒體釋放細胞色素C進入細胞質,并可激活capase級聯反應而形成Cleaved caspase-3從而誘導細胞凋亡[17-19]。本研究結果顯示,H2O2處理后腦微血管內皮細胞存活率顯著降低,而茯苓酸處理后細胞存活率顯著升高;H2O2處理后腦微血管內皮細胞凋亡率升高,Cleaved caspase-3表達下調,茯苓酸處理后可抑制細胞凋亡,并可抑制Cleaved caspase-3表達,提示茯苓酸可抑制H2O2誘導的腦微血管內皮細胞凋亡。
ROS生成量增多可促進細胞內蛋白質、脂類等發生氧化而造成氧化損傷,ROS還可激活相關信號通路從而誘導細胞凋亡[20]。CAT、SOD、GSH-Px屬于抗氧化酶類,并可抑制細胞內ROS的作用從而減輕細胞氧化應激損傷[21-22]。本研究結果顯示H2O2處理后腦微血管內皮細胞ROS的水平顯著升高,而茯苓酸處理后ROS的水平顯著降低,進一步研究顯示H2O2處理后腦微血管內皮細胞CAT、SOD、GSH-Px的水平顯著降低,而茯苓酸處理后CAT、SOD、GSH-Px的水平顯著升高,提示茯苓酸具有抗H2O2誘導的腦微血管內皮細胞氧化損傷的作用,還可抗細胞凋亡及促進細胞增殖。但關于茯苓酸減輕H2O2誘導的腦微血管內皮細胞損傷的分子機制尚需進一步探究。
4 結論
茯苓酸可抑制H2O2誘導的腦微血管內皮細胞氧化應激及凋亡,并可促進細胞增殖從而發揮抗腦微血管內皮細胞氧化損傷的作用,可為進一步揭示茯苓酸治療缺血性腦血管疾病的分子機制奠定了實驗基礎。

