山楂葉金絲桃苷對LPS誘導的RAW264.7巨噬細胞炎癥反應的抑制作用?
楊 鶯, 姚新月, 李海波
(1.遼寧中醫藥大學附屬醫院, 沈陽 110032; 2.遼寧中醫藥大學研究生部, 沈陽 110847;3.遼寧中醫藥大學基礎醫學院, 沈陽 110847)
炎癥是指機體受到外界刺激時所產生的防御反應,正常情況下炎癥有利于清除致病炎癥因子。但過度的炎癥反應可導致機體組織損傷使病情加重,如神經退行性疾病、動脈粥樣硬化、關節炎等[1-2]。迄今在臨床使用的抗炎藥主要包括甾體抗炎藥(如地塞米松)和非甾體抗炎藥(如阿司匹林)。但因為其諸多不良反應(如引起類腎上腺皮質功能亢進癥、嚴重的胃腸道反應等),限制了其在臨床的應用[3-4],因此研發高效、低毒的抗炎藥物是目前研究的重點。
山楂又稱山里紅,來源于薔薇科植物山里紅或山楂的干燥成熟果實,具有消食健胃、行氣散瘀之功效[5]。山楂葉富含黃酮類化合物,其中金絲桃苷(hyperoside, Hyp)是其主要活性成之一,具有廣泛的藥理活性,主要包括抗氧化、抗腫瘤、抗缺血性腦卒中等[6-9]。但是Hyp能否通過激活Sirt6抗炎作用未見報道。因此,本研究擬采用脂多糖(lipopolysaccharides, LPS)誘導巨噬細胞RAW264.7炎癥損傷,探索山楂葉提取物金絲桃苷是否通過調控Sirt 6發揮抗炎作用,為其臨床用于抗炎癥相關疾病提供藥理學依據。
1 材料
1.1 藥物
圖1示,山楂葉提取物金絲桃苷(Hyp)由遵義醫科大學高建美教授贈予,純度 ≥98%。采用二甲基亞砜溶解Hyp后配成10 mmol.L-1母液,在超凈臺內采用0.22 μmol/L微孔濾器過濾除菌,-20 ℃凍存備用。

圖1 Hyp高效液相色譜圖
1.2 細胞培養
RAW264.7細胞購自中國科學院上海細胞研究所,采用含10%胎牛血清RPMI1640培養基,置于37 ℃、5% CO2培養箱中培養。
1.3 試劑與儀器
RPMI1640培養液(#8116408),Gibco公司;LPS(#L2630)、MTT(#M2128),Sigma公司;腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)(#20171015)、白細胞介素-1β(interleukin-1β, IL-1β)(#20171015)、白細胞介素-6(interleukin-6, IL-6)(#20171123)、誘導型一氧化氮合酶(induciblenitric oxide synthase, iNOS)(#20171123)、酶聯免疫吸附實驗(enzyme linked immunosorbent assay, ELISA)試劑盒,上海江萊上海江萊生物科技有限公司;TNF-α、IL-1β、IL-6 和iNOS及 β-actin引物合成、Trizol和DEPC,上海生工生物工程股份有限公司;anti-p-p38 (#ab47363) 多克隆抗體、anti-p38(#ab170099)多克隆抗體、anti-p-核轉錄因子κB p65(nuclear factor-κB, NF-κB p65)(#ab86299)多克隆抗體、anti- NF-κB p65多克隆抗體(#ab16502)、沉默信息調節因子6(sirtuin 6, Sirt6, #ab88494),Abcam公司。
二氧化碳培養箱(Thermo Fisher Scientific公司);CFX96型RT-PCR儀 (Bio-Rad公司);DDY-10型三恒電泳儀(Bio-Rad公司);半干轉印槽(Bio-Rad公司);全自動電泳凝膠成像分析系統(Bio-Rad公司)。
1.4 方法
1.4.1 Hyp對RAW264.7細胞活力的影響 將處于對數生長期的RAW264.7細胞以1×105個/ml接種于96孔培養板中,加入不同濃度的Hyp(0 μmol/L, 1.563 μmol/L, 3.125 μmol/L, 6.25 μmol/L, 12.5 μmol/L, 25 μmol/L, 50 μmol/L, 100 μmol/L, 200 μmol/L, 400 μmol/L)作用24 h確定Hyp的安全濃度范圍;將RAW264.7細胞隨機分為正常對照組、模型組、模型組+ Hyp低濃度組、模型組+ Hyp中濃度組、模型組+ Hyp高濃度組、模型組+ 地塞米松組。LPS(1 μg/ml)和不同濃度(25 μmol/L, 50 μmol/L, 100 μmol/L)的Hyp或地塞米松(20 μmol/L)作用24 h后,加入MTT(5 mg/L)繼續培養24 h后棄上清,每孔加入DMSO(150 μL),振搖10 min,于570 nm波長處測定吸光度值。
1.4.2 Hyp對LPS誘導的RAW264.7細胞內NO含量的影響 RAW264.7細胞按照1.4.1項方法處理后取上清,采用Griess法檢測細胞內NO含量,取50 μL上清液與等體積的Griess試劑混合,在室溫下培養15 min。在540 nm波長的條件下檢測吸光度,并利用已知濃度的亞硝酸鈉作為標準,計算各組對應的實際濃度值。
1.4.3 Hyp對LPS誘導的RAW264.7細胞炎癥因子釋放的影響 RAW264.7細胞按照1.4.1項方法處理后取上清,采用ELISA法測定NO和TNF-α、IL-1β、IL-6和iNOS含量,嚴格按照試劑盒說明操作。取40 μL稀釋液與10 μL上清液混合,置于37 ℃條件下反應 30 min后,將濃縮液稀釋按照要求稀釋用于洗滌各孔;移取50 μL酶標液加入各孔充分反應30 min(37 ℃條件下);移取50 μL A、B顯色劑,37 ℃環境下反應20 min(盡量避光);移取50 μL終止液加入反應;在波長為450 nm條件下測定樣本的OD值。
1.4.4 Hyp對LPS誘導的RAW264.7細胞炎癥因子mRNA水平的影響 RAW264.7細胞按照1.5.1項方法處理后,收集細胞提取RNA,逆轉錄合成cDNA,通過RT-PCR檢測TNF-α、IL-1β、IL-6和iNOS mRNA表達,引物序列如表1所示。RT-PCR反應條件如下:95 ℃變性5 min、60 ℃變性30 s、72 ℃延伸20 s條件擴增40次。以β-actin為內參,采用2-ΔΔCt法計算炎癥因子mRNA水平。

表1 炎癥相關因子的基因引物序列
1.4.5 Hyp對LPS誘導的RAW264.7細胞Sirt 6表達和NF-κB p65磷酸化水平的影響 RAW264.7細胞按照1.5.1項方法處理,收集細胞后采用BCA試劑盒進行蛋白定量。蛋白變性后,上樣20 μg蛋白,采用10% SDS-聚丙烯酰胺凝膠電泳分離蛋白,轉膜后用5%脫脂奶粉封閉1 h,加入一抗p38(1∶1000)、Sirt6 (1∶1000)、p-NF-κB p65(1∶1000)和NF-κB p65(1∶1000)4 ℃孵育過夜,TBST洗膜3次后,加入二抗(1∶5000)封閉1 h后,采用ECL顯影,以Image J統計灰度值。
1.4.6 計算機虛擬分子對接檢測Hyp與p38的親和力 采用Autodock 4.2以及AutodockTools軟件進行分子虛擬對接,觀察Hyp及p38的親和力情況。從Protein Data Bank (http://www.rcsb.org) 數據庫獲取p38蛋白的pdb格式文件,其PDB ID為1ZZL。采用Autodock 4.2分別對Hyp與p38蛋白進行分子對接。
1.4.7 流式細胞術檢測細胞周期和凋亡變化 將細胞按照1.4.1描述的方法處理后,收集細胞加入70%預冷的乙醇溶液4 ℃條件下孵育過夜后,加入50 mg/ml的碘化丙啶染色液及100 mg/ml RNase A,在室溫條件下避光孵育15 min后,用流式細胞儀檢測各組細胞周期和凋亡改變。
1.5 統計學方法
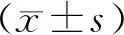
2 結果
2.1 Hyp對RAW264.7細胞活力的影響
圖2示,Hyp(0 μmol/L, 1.563 μmol/L, 3.125 μmol/L, 6.25 μmol/L, 12.5 μmol/L, 25 μmol/L, 50 μmol/L, 100 μmol/L)單獨處理或與LPS共同作用均對RAW264.7細胞活力無影響;而Hyp(200 μmol/L, 400 μmol/L)單獨處理或與LPS共同作用均明顯抑制細胞活力;表2、3示,各組細胞形態無明顯改變,與MTT研究結果一致,表明Hyp在濃度100 μmol/L以下為其安全范圍(P<0.05)。

注:不同濃度Hyp作用24 h后,采用MTT法檢測細胞活力。 A.正常對照組;B. LPS組;C. Hyp (25 μmol/L);D. Hyp (50 μmol/L);E. Hyp (100 μmol/L);F. 地塞米松(放大400×)
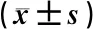
表2 Hyp對RAW264.7細胞活力的影響
2.2 Hyp對LPS誘導的RAW264.7細胞炎癥因子釋放的影響
表4示,LPS(1 μg/ml)刺激RAW264.7細胞后,NO、TNF-α、IL-1β和IL-6 的含量較正常對照組明顯升高。Hyp(25、50、100 μmol/L)和陽性藥地塞米松組能夠明顯降低NO、TNF-α、IL-1β和IL-6 的含量,并呈濃度依賴性(P<0.05)。
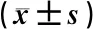
表3 Hyp和LPS共同作用對RAW264.7細胞活力的影響

表4 Hyp對 LPS 誘導RAW264.7細胞炎癥因子NO、TNF-α、IL-1β、IL-6和iNOS的影響
2.3 Hyp對LPS誘導的RAW264.7細胞炎癥因子mRNA水平的影響
表5示,研究結果表明,LPS(1 μg/ml)刺激RAW264.7細胞后,TNF-α、IL-1β、IL-6和 iNOS的mRNA水平較正常對照組明顯升高。Hyp(25、50、100 μmol/L)和陽性藥地塞米松組能夠顯著降低TNF-α、IL-1β、IL-6和 iNOS的mRNA水平,并呈濃度依賴性(P<0.05)。

表5 Hyp對LPS 誘導RAW264.7細胞炎癥因子TNF-α、IL-1β、IL-6和iNOS mRNA水平的影響
2.4 Hyp對LPS誘導的RAW264.7細胞Sirt 6表達和NF-κB p65磷酸化水平的影響
圖3表6示,LPS明顯增加p-NF-κB p65水平,降低Sirt6的蛋白表達。而Hyp顯著降低p-NF-κB p65水平,增加Sirt6的蛋白表達(P<0.05)。
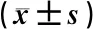
表6 Hyp對LPS誘導RAW264.7細胞Sirt 6表達與NF-κB p65磷酸化水平的影響量化比較

注:1:正常對照組;2. LPS組;3. Hyp (25 μmol/L);4. Hyp (50 μmol/L);5. Hyp (100 μmol/L);6. 地塞米松
2.5 Hyp結合并抑制p38蛋白
圖4示,采用模擬分子對接方法評價Hyp與p38蛋白結合情況的對接結果顯示,Hyp能夠與p38結合,兩者的結合能為-6.05 kcal/mol。Hyp與p38蛋白對接具有豐富的氨基酸殘基,主要包括Asp168、Lys53、His107、Tyr35、Leu167等,提示Hyp可能直接作用于p38發揮抗炎作用。

注:A.Hyp與p38結合表面的可視化結果;B-C.Hyp與p38結合位點的可視化結果;D.Hyp與p38對接的氨基酸殘基位點可視化結果
2.6 Hyp對LPS誘導的RAW264.7細胞周期和凋亡的影響
圖5示,與空白組比較,LPS明顯誘導RAW264.7細胞凋亡,且S期細胞顯著增加;與模型組比較,Hyp可顯著抑制LPS誘導RAW264.7細胞凋亡,且S期細胞明顯減少,提示Hyp能夠明顯抑制LPS誘導RAW264.7細胞凋亡。

注:A.正常對照組;B. LPS組;C. Hyp (25 μmol/L);D. Hyp(50 μmol/L);E. Hyp (100 μmol/L);F. 地塞米松
3 討論
巨噬細胞是參與炎癥反應的重要免疫細胞,在外界因素(如LPS)刺激的情況下可產生炎癥因子[10-11]。LPS為革蘭陰性細菌細胞壁的主要成分,能夠刺激巨噬細胞釋放炎癥因子(如NO、TNF-α等)[12-13]。其中,NO廣泛存在于生物體內,過度的炎癥反應可產生iNOS,進而合成大量NO而導致細胞損傷。TNF-α、IL-1β、IL-6為炎癥反應中的主要炎癥因子,是反應炎癥水平的重要指標。本研究結果表明,LPS明顯增加RAW264.7細胞NO、TNF-α、IL-1β、IL-6釋放量,與文獻報道一致[14]。而山楂葉提取物Hyp能夠明顯減少RAW264.7細胞NO、TNF-α、IL-1β、IL-6釋放量,表明山楂葉提取物Hyp具有明顯的抗炎作用,但其作用機制有待于進一步探討。
絲裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)家族在炎癥反應過程中發揮著重要作用,p38 MAPK是其家族重要成員之一。據文獻報道,p38 MAPK在炎癥刺激下被磷酸化后激活其下游基因NF-κB發揮作用[15]。NF-κB是炎癥反應過程中重要的基因轉錄調控因子,其家族成員主要包括p65和p50。正常生理情況下,NF-κB(p50/p65)以異二聚體形式存在于細胞質中;在炎癥(如LPS)刺激條件下,NF-κB信號通路被激活后NF-κB-p65由細胞質移位至細胞核,進而促進TNF-α、IL-6 、IL-1β、iNOS等炎性因子的釋放。本研究結果顯示,LPS能夠通過磷酸化使磷酸化p38 MAPK,繼而激活其下游的NF-κB p65,進而上調TNF-α、IL-1β、IL-6、iNOS的mRNA水平,與文獻報道一致[16]。而山楂葉提取物Hyp能夠明顯抑制p38 MAPK和NF-κB p65的磷酸化水平,并顯著下調TNF-α、IL-1β、IL-6、iNOS的mRNA水平。沉默信息調節因子6(silent information regulator 6,Sirt 6)是SIR2家族的重要成員之一。最近文獻報道,Sirt 6不僅具有抗氧化作用,還可調控NF-信號轉錄,進而抑制炎癥因子的釋放[17]。本研究結果顯示,LPS能夠明顯降低Sirt6的蛋白表達,與文獻報道一致[18]。而山楂葉提取物Hyp可明顯增加Sirt6的蛋白表達,提示山楂葉提取物Hyp可以通過抑制p38 MAPK磷酸化,激活Sirt6進而調控NF-κB炎癥通路發揮作用。值得注意的是,分子對接結果表明,山楂葉提取物Hyp能夠與p38 MAPK結合并通過氨基酸殘基Asp168、Lys53、His107等發生相互作用,提示p38 MAPK可能為山楂葉提取物Hyp作用的潛在靶點。值得注意的是,Hyp能夠顯著抑制LPS誘導的細胞凋亡,并使其阻滯在S期,但其抗凋亡的作用機制有待于進一步探索。此外,本研究只是初步探討了在體外實驗中Hyp的抗炎作用可能與抑制p38 MAPK磷酸化和激活Sirt6進而抑制NF-κB p65的磷酸化,從而抑制炎癥因子的釋放有關,其具體的作用機制還有待于在體內動物實驗中進一步驗證。
綜上,在本實驗條件下,Hyp具有抗LPS誘導RAW264.7細胞炎癥反應的作用,其作用可能與調控p38 MAPK/Sirt6/NF-κB信號通路相關。本研究旨在為將Hyp研發為抗炎藥物應用于臨床治療炎癥相關疾病提供重要參考。

