CodY在單核細胞增生李斯特菌抗氧化脅迫中的作用
楊詩怡,林 巍,楊麗玉,左 成,羅 勤
(華中師范大學生命科學學院,湖北 武漢 430079)
單核細胞增生李斯特菌(Listeria monocytogenes,Lm)是一種食源性致病菌,在自然界中廣泛存在,對環境有極強的耐受能力,能在冷藏溫度(2~4 ℃)、酸性環境(pH 4.5)以及高鹽(10% NaCl)條件下生長,因此Lm能夠克服食品儲存過程中的各種不利因素影響,造成食品污染進而危害到人類健康,由Lm引起的李斯特菌病可導致孕婦流產,新生兒、老年人以及免疫缺陷或低下病人罹患腦膜炎、敗血癥等[1-2]。Lm黏附在器具表面所形成的生物被膜有助于其耐受惡劣環境以及抗菌處理手段[3-4]。合理的消毒方法對防控Lm污染至關重要,而所使用的消毒劑需要具有無毒、無害、無殘留等特性[5]。
食品加工過程中,常用到H2O2、NaClO等氧化類消毒劑,強氧化環境會導致細菌內活性氧(reactive oxygen species,ROS)大量積累,從而激發細菌氧化應激反應[6-7]。H2O2因其在使用后能分解成無毒產物(H2O和O2),不會造成有害物殘留,被越來越多地應用于醫療、食品和工業生產中[6,8]。一定濃度的H2O2能激發細菌的抗氧化應激反應,誘導超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)和谷胱甘肽(glutathione,GSH)等相關基因表達[9]。多種外部環境脅迫(如饑餓、氧化應激、抗生素處理等)也會導致細菌DNA受到損傷,此時其內部的DNA修復機制被激活,如DNA損傷誘導反應(SOS反應),以抵御外部環境脅迫引起的DNA損傷[10]。Lm中參與SOS反應的基因主要有recA(SOS反應誘導物)、lexA(SOS反應阻礙物)、recR(SOS反應激活因子)、lmo1302(LexA家族調節子)和lmo1975(DNA聚合酶IV)等[10-11]。
CodY是一種全局轉錄調控因子,普遍存在于低G+C含量的革蘭氏陽性菌中,參與多種代謝途徑以及生理過程的調控[12]。研究表明,在乳酸鏈球菌(Lactococcus lactis)[13]、枯草芽孢桿菌(Bacillus subtilis)[14]和金黃色葡萄球菌(Staphylococcus aureus)[15]中,CodY可以通過直接與靶基因啟動子區保守序列CodY-box(即AATTTTCWGAAAATT)結合,或通過其他方式直接或間接地調控基因表達,Lm中也存在類似的保守序列[16]。已有研究發現某些細菌中CodY參與了抗氧化應激過程的調控,如:Wang Yue等[17]證明了在嗜熱鏈球菌(Streptococcus thermophilus)中CodY能結合到GSH的編碼基因ghsF啟動子區域,調控GSH的合成,清除過量H2O2;Hajaj等[18]發現肺炎鏈球菌(Streptococcus pneumoniae)中雖不存在常見的CAT,但卻有一種被稱為“硫醇過氧化物酶(TpxD)”的關鍵酶用以清除多余的過氧化物,其編碼基因tpxD具有CodY-box,當細菌受到H2O2脅迫時,CodY能夠激活tpxD使其表達上調。Lm中CodY在細菌毒力、鞭毛運動等方面具有重要作用[19-21],但CodY是否直接或間接參與Lm抗氧化應激調控還鮮有研究。
本研究通過比較野生株EGDe和CodY(由codY編碼)缺失株EGDeΔcodY的抗氧化應激能力以及SOS反應等基因表達差異,探尋CodY在LmH2O2氧化脅迫中的調控作用及其機制,以期為醫療、食品和工業生產中H2O2的合理使用策略,以及預防和治療李斯特菌病提供理論依據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
實驗中所用菌株EGDe(血清型1/2a,全基因組序列已知[22])為德國維爾茨堡大學Werner Goebel教授惠贈,EGDeΔcodY為本實驗室構建和保存[19]。如無特殊說明,菌株均在腦心浸液(brain heart infusion,BHI)培養基中37 ℃過夜活化并200 r/min振蕩培養至對數中期(OD600nm=0.65)。
1.1.2 試劑
BHI培養基 美國B&D公司;30% H2O2(分析純)國藥集團化學試劑有限公司;CAT、SOD及GSH檢測試劑盒 南京建成生物工程研究所有限公司;十六烷基三甲基溴化銨(hexadecyl trimethyl ammonium bromide,CTAB) 北京索萊寶生物科技有限公司;PrimeScriptTMRT reagent反轉錄試劑盒 寶生物工程(大連)有限公司;熒光定量SYBR Green Master Mix 中國US Everbright公司。
1.1.3 引物
根據NCBI中已公布的EGDe全基因組序列,利用Primer5設計基因引物,所有引物均由生工生物工程(上海)股份有限公司合成,引物見表1。

表1 實驗引物信息Table 1 Primers used in this study
1.2 儀器與設備
VCX800超聲波細胞破碎 美國Sonics公司;DYY-6D電泳儀 北京市六一儀器廠;Veriti PCR儀 美國Applied Biosystems公司;ZF-258凝膠成像系統 上海嘉鵬科技有限公司;CFX96 real-time PCR儀 美國Bio-Rad公司。
1.3 方法
1.3.1 H2O2對細菌最低抑菌濃度(minimum inhibitory concentration,MIC)和最低殺菌濃度(minimum bactericidal concentration,MBC)的測定
將10 μL對數中期的新鮮菌液(濃度約為9×1011CFU/mL)分別加入到200 μL含有不同濃度的H2O2(5、10、15、20、25、30、35、40、45、50 mmol/L)的無菌BHI培養基中,每組設3 個重復。另設一組不添加H2O2的菌液作為對照。此時各組菌液較為清亮。37 ℃靜置培養22 h后,肉眼觀察,無細菌生長(即菌液保持清亮,無明顯渾濁)的最低H2O2濃度即為該菌的MIC值。在MIC結果的基礎上,取200 μL肉眼觀察無菌生長的培養液進行BHI平板涂布,37 ℃培養22 h后,平板上無細菌生長的最低H2O2濃度,即為該菌的MBC值。
1.3.2 抑菌圈檢測
采用紙片瓊脂擴散法。調節對數中期菌液濃度近似為9×1011CFU/mL,稀釋107倍,取100 μL菌液進行平板涂布。用無菌鑷子夾取無菌圓形濾紙片(直徑6 mm),平貼于培養基表面。每個平板上均勻放4 張濾紙片,分別滴加10 μL含0(對照)、10、20、30 mmol/L H2O2的BHI于其上,37 ℃過夜培養,游標卡尺測量抑菌圈直徑。
1.3.3 細菌在不同濃度H2O2中的生長曲線測定
向100 mL對數中期菌液中分別加入一定量(0.05~2.04 mL)30% H2O2溶液(市售H2O2初始濃度9 790 mmol/L),使菌液中H2O2終濃度分別為5、20、50、100、200 mmol/L,37 ℃、200 r/min振蕩培養。每隔0.5 h檢測菌液OD600nm的變化,連續測定至第3小時。
1.3.4 細菌CAT、SOD活力和GSH含量檢測
菌株培養至對數中期后,加入200 mmol/L H2O2分別脅迫0(對照)、10、20、40 min,磷酸鹽緩沖液洗滌并重懸菌體。超聲波細胞破碎儀破碎菌體,破碎時將菌體置于冰水混合環境,工作總時間5 min(超聲3 s、間歇5 s)。破碎后的細胞經6 000 r/min、4 ℃離心10 min,取上清液,依照CAT、SOD及GSH檢測試劑盒的步驟檢測細菌的CAT、SOD活力和GSH含量。
1.3.5 H2O2脅迫對細菌DNA損傷程度的檢測
本實驗采用RAPD技術[23]研究H2O2對細菌DNA的損傷。DNA損傷程度通過菌株基因組模板穩定性(genomic template stability,GTS)進行評估。利用CTAB法提取對數中期細菌總DNA,進行RAPD分析,所使用的隨機引物見表1。反應體系為:TaqMix 12.5 μL、隨機引物2 μL、DNA 3 μL、ddH2O 7.5 μL。反應條件:95 ℃預變性5 min;94 ℃變性45 s,40~30 ℃梯度退火30 s,72 ℃延伸1 min,循環20 次;94 ℃變性45 s,35 ℃退火45 s,72 ℃延伸1 min,循環10 次;72 ℃充分延伸10 min。PCR產物進行1%瓊脂糖凝膠電泳,EB染色后,利用凝膠成像系統成像觀察并統計多態性條帶數。GTS計算公式如下:
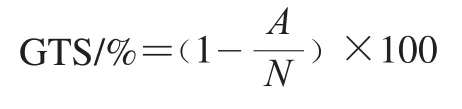
式中:A為H2O2脅迫后細菌DNA的RAPD條帶數,即新出現和消失的PCR條帶數之和;N為未經H2O2脅迫的細菌DNA PCR后的總條帶數。
1.3.6 細菌real-time PCR分析
對細菌抗氧化應激物CAT、SOD和GSH的編碼基因kat、sod、gshF,SOS反應重要基因recA、lexA、recR、lmo1302、lmo1975進行real-time PCR,定量分析H2O2脅迫對其轉錄表達的影響。用200 mmol/L H2O2脅迫EGDe和EGDeΔcodY菌株0(對照)、10、20、40 min后,分別提取細菌總RNA,利用反轉錄試劑盒,1 μL RNA/10 μL體系得到細菌不同脅迫條件下的cDNA,以其為模板進行real-time PCR,每組設置4 個平行。反應體系(15 μL)為:SYBRTaq7.5 μL、上下游引物各0.3 μL、cDNA 3 μL、ddH2O 3.9 μL。反應條件:95 ℃預變性3 min;95 ℃變性10 s,62 ℃退火及延伸30 s,循環39 次;65~95 ℃,每5 s增加0.5 ℃,生成熔解曲線。以細菌16S rRNA為內參基因,采用2-ΔΔCt法 處理數據。
1.4 數據統計與分析
各實驗均進行3 次生物學重復,實驗結果取其平均值,利用SPSS 22.0軟件進行數據的統計與分析,P≤0.05,差異顯著,Origin 8.0軟件作圖。
2 結果與分析
2.1 EGDe和EGDeΔcodY對H2O2耐受能力的比較
為了比較野生株EGDe和CodY缺失株EGDeΔcodY抗氧化脅迫的差異,首先檢測了H2O2對兩株細菌的MIC和MBC。H2O2對EGDe的MIC為25 mmol/L,MBC為30 mmol/L,對EGDeΔcodY的MIC為10 mmol/L,MBC為15 mmol/L,H2O2對EGDe的MIC和MBC大約是EGDeΔcodY的2 倍,表明缺失CodY會導致Lm對H2O2的耐受能力減弱。同時,也進行了抑菌圈實驗,如表2所示,當濾紙片中H2O2濃度為10 mmol/L時,EGDe和EGDeΔcodY形成的抑菌圈直徑分別為(0.97±0.16)cm和(1.30±0.45)cm,H2O2對EGDeΔcodY的抑制略高于EGDe,但差異不顯著(P>0.05);當H2O2濃度達到20 mmol/L后,EGDe和EGDeΔcodY形成的抑菌圈直徑分別為(1.01±0.15)cm和(1.57±0.34)cm,二者之間差異極顯著(P≤0.01);當H2O2濃度達到30 mmol/L時,EGDeΔcodY形成的抑菌圈直徑極顯著大于EGDe(P≤0.01),約為EGDe的1.7 倍。以上結果表明,CodY的缺失降低了Lm對H2O2的耐受能力,并且隨著H2O2濃度的升高,CodY缺失的影響越顯著。
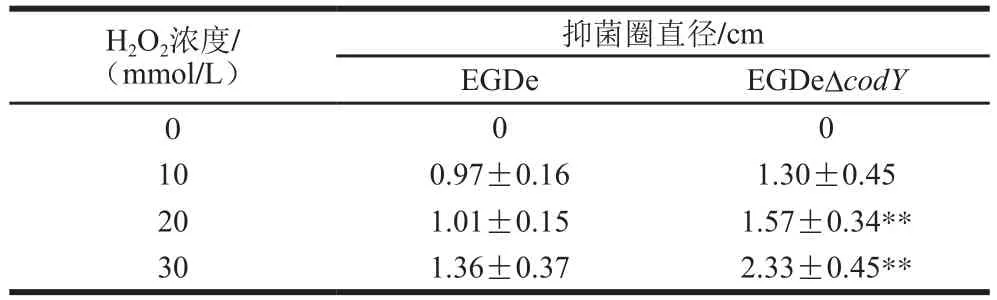
表2 EGDe和EGDeΔcodY在不同濃度H2O2脅迫下抑菌圈大小Table 2 Diameter of inhibition zone of EGDe and EGDeΔcodY when exposed to different concentrations of H2O2
2.2 EGDe和EGDeΔcodY在不同濃度H2O2脅迫下的生長曲線
相比MIC(或MBC)以及抑菌圈實驗中所涉及的較低細菌初始濃度(類似實際生產中受Lm污染初期),為了檢測較高細菌初始濃度下(如在Lm污染嚴重時),加入不同濃度H2O2對EGDe和EGDeΔcodY生長繁殖的影響,并為后續實驗中比較兩株細菌中氧化應激物相關基因轉錄表達和酶活力差異確定適宜的脅迫濃度,向培養至對數中期的菌液(濃度約為9×1011CFU/mL,體積為100 mL)中分別加入一定量(0.05~2.04 mL)30% H2O2溶液,使菌液中H2O2終濃度分別為5、20、50、100、200 mmol/L,置于37 ℃、200 r/min培養。如圖1所示,當H2O2脅迫濃度等于或低于100 mmol/L時,雖然隨著H2O2濃度升高,EGDe和EGDeΔcodY生長趨勢有所下降,但二者之間并無明顯差異。但當H2O2濃度達到200 mmol/L時,EGDe的生長仍呈上升趨勢,只是生長速率較之前明顯減慢,而EGDeΔcodY生長則受到非常顯著的抑制,兩菌株的生長曲線存在顯著差異,因此選擇該脅迫濃度進行后續實驗。
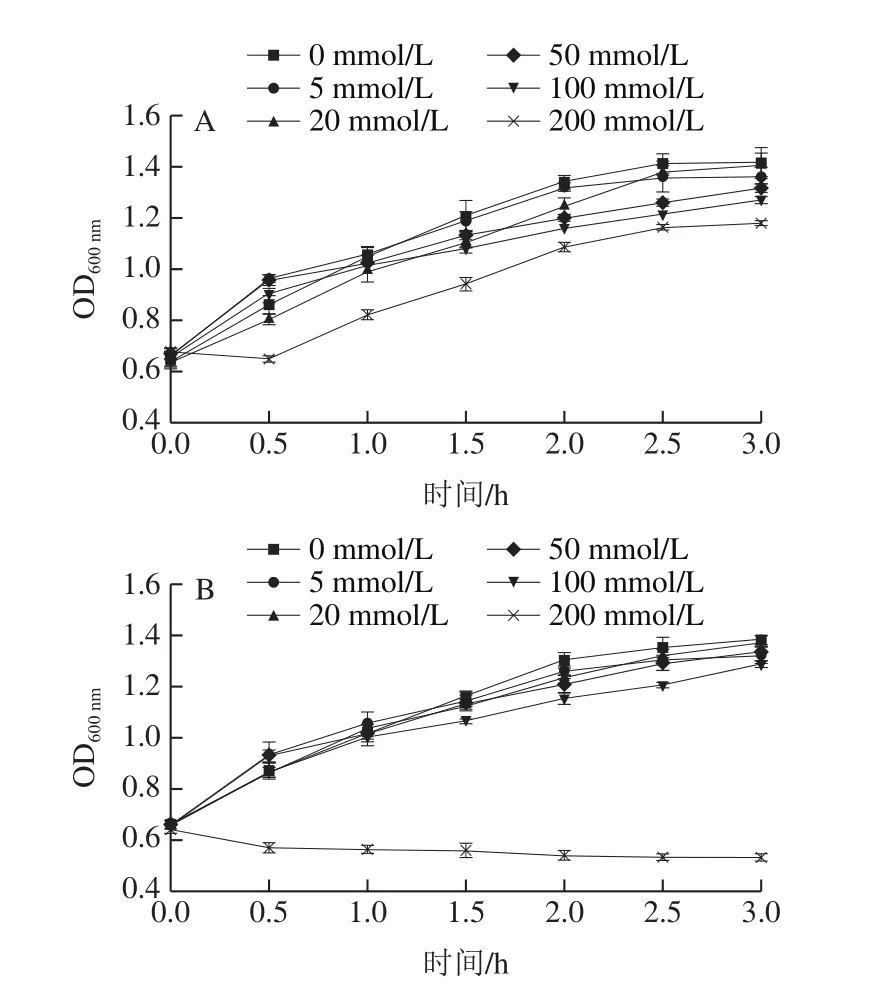
圖1 EGDe(A)和EGDeΔcodY(B)在不同濃度H2O2脅迫下的生長曲線Fig.1 Growth curves of EGDe (A) and EGDeΔcodY (B) at different concentrations of H2O2
2.3 H2O2脅迫下EGDe和EGDeΔcodY中CAT、SOD活力和GSH含量
如圖2A所示,當CodY缺失后,細菌中催化H2O2分解成氧和水的CAT活力明顯比野生株EGDe低(P≤0.05)。H2O2脅迫10 min后,野生株EGDe CAT活力開始急劇下降,而EGDeΔcodY中CAT雖有所下降,但并不如EGDe顯著。而SOD活力在EGDe和EGDeΔcodY中始終未表現出顯著差異,即使是受到H2O2脅迫處理長達40 min(圖2B)。細菌體內GSH含量隨著H2O2脅迫時間延長總體呈現先下降后上升的趨勢,但EGDe內GSH含量始終高于EGDeΔcodY(圖2C)。

圖2 EGDe和EGDeΔcodY在200 mmol/L H2O2不同脅迫時間下抗氧化應激物酶活和GSH含量的比較Fig.2 Antioxidant parameters in EGDe and EGDeΔcodY after different durations of exposure to 200 mmol/L H2O2
2.4 H2O2脅迫下EGDe和EGDeΔcodY中CAT、SOD和GSH編碼基因的轉錄表達變化
為了進一步研究CAT、SOD和GSH編碼基因在EGDe和EGDeΔcodY中的轉錄表達,以未經H2O2脅迫的EGDe為參照,進行了real-time PCR檢測。如圖3所示,編碼CAT的基因kat以及編碼SOD的基因sod的轉錄表達趨勢與其酶活力結果并不完全一致。如圖3A所示,kat在兩菌株內的相對轉錄表達水平幾乎沒有差異,且并不受H2O2脅迫的影響;sod轉錄水平在EGDe中隨著H2O2脅迫時間延長而顯著上升,而EGDeΔcodY中sod的轉錄表達幾乎沒有變化,因此,sod在兩個菌株中的表達差異逐漸增加,當H2O2脅迫40 min時差異達到高度顯著(P≤0.001)(圖3B)。只有GSH合成酶基因gshF在兩株細菌中的相對轉錄表達趨勢基本與其含量變化一致,且更加明顯和穩定。如圖3C所示,缺失CodY后,細菌體內的gshF的表達顯著降低,在H2O2脅迫10 min和20 min時差異極顯著(P≤0.01),但隨著脅迫時間延長,野生株中gshF的表達下降,差異不再顯著。
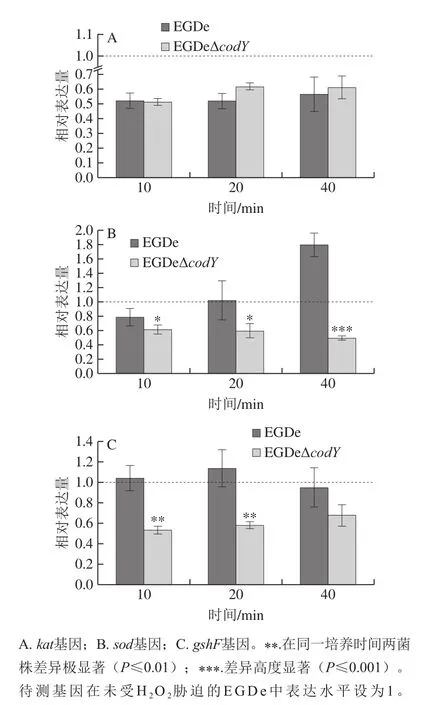
圖3 CAT、SOD和GSH編碼基因受到200 mmol/L H2O2不同時間脅迫后在EGDe和EGDeΔcodY中的相對表達水平Fig.3 Relative transcriptional expression of kat (A), sod (B) and gshF (C)in EGDe and EGDeΔcodY after different durations of exposure to 200 mmol/L H2O2
2.5 H2O2脅迫對EGDe和EGDeΔcodY基因組DNA穩定性的影響
氧化脅迫會造成細菌DNA受損,但細菌能夠通過激活DNA修復機制維持DNA穩定性(GTS)。為了深入研究CodY在細菌受到氧化脅迫后對維持細菌基因組DNA穩定性的作用,利用RAPD技術檢測并統計電泳后EGDe和EGDeΔcodY多態性條帶數,計算和分析H2O2脅迫對細菌基因組DNA穩定性的影響。如表3所示,經200 mmol/L H2O2脅迫20 min后,EGDe基因組DNA的GTS降為未受脅迫時的93.1%,而EGDeΔcodY的GTS下降更低,為未受脅迫時的80.0%。表明在H2O2脅迫下,CodY缺失顯著影響了Lm基因組的穩定性,細菌DNA受到氧化脅迫后損傷更嚴重。
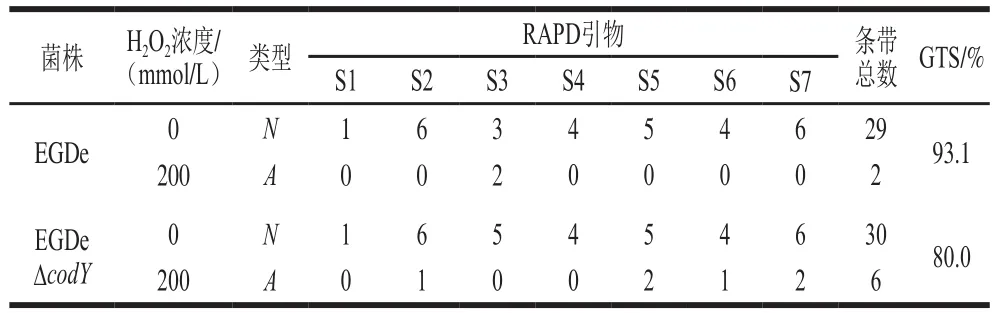
表3 H2O2脅迫下EGDe和EGDeΔcodY GTS比較Table 3 Comparison of genomic DNA template stability of EGDe and EGDeΔcodY under H2O2 stress
Lm能夠通過激活SOS反應進行DNA損傷修復,參與SOS反應的重要基因包括recA、lexA、recR、lmo1302和lmo1975等。為進一步探究CodY在DNA損傷修復中的作用,利用real-time PCR技術,檢測EGDe和EGDeΔcodY中參與SOS反應的上述基因在H2O2脅迫前后的轉錄表達水平。如圖4所示,與未受H2O2脅迫的EGDe(即脅迫0 min)相比,H2O2脅迫20 min后,SOS反應誘導物編碼基因recA與DNA聚合酶IV的編碼基因lmo1975在EGDe中的轉錄表達水平呈現高度顯著提高(P≤0.001),而在EGDeΔcodY中的表達則正好相反,呈現高度顯著降低(P≤0.001)。同時,SOS反應阻礙物編碼基因lexA及其基因家族調節子編碼基因lmo1302以及SOS反應激活因子編碼基因recR的轉錄表達水平在EGDe中沒有明顯變化,但在EGDeΔcodY中表現出高度顯著降低(P≤0.001)。以上結果表明,在H2O2脅迫下,CodY會快速激活Lm中recA和lmo1975的轉錄表達,參與修復損傷的基因組DNA;而CodY的缺失會造成上述Lm中參與SOS反應的所有重要基因(recA、lexA、recR、lmo1302、lmo1975)的轉錄表達顯著下調,從而顯著影響細菌的DNA損傷修復能力,造成細菌基因組DNA的穩定性下降。

圖4 200 mmol/L H2O2脅迫下EGDe和EGDeΔcodY中基因相對表達水平Fig.4 Relative transcriptional expression of recA, lexA, recR, lmo1302,lmo1975 in EGDe and EGDeΔcodY after different durations of exposure to 200 mmol/L H2O2
3 討 論
作為普遍存在于低G+C含量革蘭氏陽性菌中的全局轉錄調控因子,CodY參與了細菌多種代謝途徑以及生理過程的調控。本研究通過實驗證實CodY可能通過調節Lm中氧化應激物的轉錄表達或者酶活力水平以及SOS反應中重要基因的表達,直接或者間接幫助細菌抵抗環境中氧化脅迫而生存下來。
CodY缺失后,即使在正常條件下(沒有氧化脅迫),EGDeΔcodY中GSH含量低于野生菌株EGDe;當受到H2O2脅迫后,GSH的轉錄表達水平在EGDeΔcodY中下降更為明顯,極顯著低于在EGDe中的水平,表明CodY對細胞中谷胱甘肽含量具有重要的調控作用。通過生物信息學分析,發現Lm中編碼合成GSH的基因gshF的啟動子區存在CodY結合位點,即CodY-box(AATTGGTAGAAATT)[14],因此認為CodY可能直接與gshF啟動子結合,調控GSH在細菌受到氧化脅迫后的表達水平,幫助細菌抵御氧化損傷。而CAT和SOD的編碼基因kat和sod啟動子區沒有發現合適的CodY-box,而且在H2O2脅迫前后,盡管CAT活力呈現下降趨勢,但其轉錄表達在EGDe和EGDeΔcodY中并沒有顯著變化,說明CodY對其并沒有調控作用,或者作用很弱。氧化脅迫下SOD活力在EGDe和EGDeΔcodY中始終未表現出顯著差異,但編碼基因sod的轉錄表達在EGDe和EGDeΔcodY中差異高度顯著(P≤0.001)。該結果的產生,一方面是可能存在的轉錄后修飾或者翻譯水平的修飾使得RNA和蛋白質的表達并不能一一對應[24]。例如,Archambaud等[25]報道Lm中的SOD活性可通過改變其絲氨酸和蘇氨酸殘基的磷酸化修飾進行調控。另外,SOD活力與H2O2濃度之間也存在較為復雜的關系:氧化環境使細菌內過量富集ROS,SOD能夠催化超氧根陰離子(O2-)發生歧化反應,進而生成H2O2和O2:2O2-+2H+→H2O2+O2,產物H2O2隨后被CAT還原為H2O和O2[26],然而過量的H2O2又會抑制SOD活力[27]。而本研究直接使用H2O2作為氧化脅迫物,這樣便使得菌體內富集過量H2O2,因此EGDe中其sod轉錄水平呈上升趨勢,轉錄后階段又會受到過量的H2O2的抑制。
H2O2脅迫還會導致細菌DNA受到損傷。SOS反應是細菌重要的應激機制,在DNA損傷修復方面有重要作用,作為調節SOS反應的兩種關鍵酶,RecA和LexA分別起誘導和抑制SOS反應的作用[10]。DNA未受損傷的情況下,LexA結合到SOS-box并抑制SOS誘導的蛋白轉錄;DNA受到損傷后,RecA與ssDNA(單鏈DNA)結合并形成活性核蛋白,導致LexA蛋白水解并激活SOS調控的基因表達。同時,部分細菌中存在Com系統(competence system)能夠促進外源DNA的攝取,在DNA修復過程中有著重要作用[28]。對于枯草芽孢桿菌Com系統已有較多研究,其中,該細菌Com系統中的ComK與CodY能夠競爭性結合comK啟動子,當CodY結合時抑制轉錄,進一步抑制recA的表達,阻止SOS反應;當CodY解除對comK的抑制作用時,recA轉錄表達被激活,從而激發SOS反應[29]。Lm中也存在Com系統,且與枯草芽孢桿菌的com基因有相似的表達機制[28]。因此,可能類似于枯草芽孢桿菌,當Lm受氧化脅迫后,其CodY對comK抑制作用消除,從而誘導DNA修復基因recA表達,同時DNA聚合酶IV等多種酶協助啟動因受損停滯的DNA復制叉[30],激活SOS反應通路。值得注意的是,受氧化脅迫后,EGDeΔcodY中SOS反應重要基因recA、lexA、recR、lmo1302、lmo1975并沒有因為CodY的缺失而表現出上調,反而受到極顯著抑制。出現這種現象的原因可能與CodY在Lm中起到的全局性調控作用有關,此前研究已證明CodY的缺失會造成Lm生長緩慢、毒力減弱以及運動能力降低[19],說明CodY對維持細菌正常生命活動以及侵染宿主具有重要作用,而EGDeΔcodY由于完全失去了CodY的調控,細菌在自身生理活性減弱的同時又受到H2O2的脅迫,生命活動處于嚴重失衡狀態,極可能影響氧化脅迫下SOS反應中基因的表達,導致recA、lexA、recR、lmo1302、lmo1975基因表達下調。
綜上所述,氧化環境中EGDe相比于EGDeΔcodY有更強的耐受能力。CodY幫助Lm提高GSH等抗氧化應激物水平來直接清除菌體內的ROS,以及調控SOS反應通路直接或者間接抵御氧化脅迫造成的DNA損傷。本研究探究了CodY在Lm中抗氧化應激作用方式,為深入理解革蘭氏陽性菌抵抗氧化脅迫而生存的復雜調控機制提供依據。

