患者小腸中細菌過度生長與NAFLD的關系研究
鄭巖,周子博,于雅麗
(鄭州市骨科醫院檢驗科,河南 鄭州 450001)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是由一系列因素導致肝細胞脂質大量聚集引發的疾病[1]。現在肥胖人數與糖尿病患者數量龐大,再加上當機體出現遺傳易感性和胰島素抵抗,NAFLD的發病率越來越高[2]。一些炎癥因子與自由基的異常釋放將導致肝細胞壞死,進而出現慢性肝炎、肝纖維化,發展到NAFLD。血清透明質酸(hyaluronic acid,HA)、層黏蛋白(Laminin,LN)、III型前膠原(typeⅢsticking layer before collagenⅢ,PCIII)、IV型 膠原(collagen typeⅣ,IV-4))能作為肝纖維化的診斷指標[3-5]。已有研究證明,在NAFLD的發展過程中,患者小腸中細菌的過度生長扮演了重要的角色[6]。
肝硬化失代償期時,腸道的淤血水腫,蠕動減慢,延遲,腸壁局部神經體液因素的異常以及腸黏膜通透性增高等因素為腸道內細菌的繁殖提供了適宜的環境,進而導致患者小腸中細菌過度生長,又可進一步加重肝損害,進而形成患者小腸中細菌過度生長與肝損害的惡性循環[7,8]。近年來,患者小腸中細菌過度生長與肝硬化發作之間的關系引起了廣泛關注。在這項研究中,葡萄糖氫呼氣試驗用于檢測小腸中細菌的過度生長,分析患者小腸中細菌過度生長在NAFLD中的作用。
1 資料與方法
1.1 一般資料 選取2018年1月-2019年12月在我院治療的NAFLD患者110例(NAFLD組),其中輕度、中重度脂肪變患者分別為72例和38例;其中男性65例,女性45例;年齡32~72歲,平均年齡(54.40±9.28)歲。納入標準:⑴診斷符合中華醫學會肝病學分會脂肪肝和酒精性肝病學組制定的標準[9];⑵年齡18歲以上;⑶患者及家屬知情同意。排除標準:⑴既往有腹部手術史;⑵合并有惡性腫瘤、內分泌疾病、腸梗阻及腸易激綜合征等疾病;⑶入選前1個月有抗生素、美托洛爾等藥物使用史。同時選取健康志愿者100例作為對照組,其中男性60例,男性40例;年齡30~69歲,平均年齡(55.10±10.11)歲。兩組一般資料比較無統計學意義(P>0.05)。
1.2 患者小腸中細菌過度生長檢測2組患者均空腹12 h以上進行檢測。檢測前囑患者刷牙漱口,避免吸煙和劇烈運動。采用Breath Tracker TM Digital MicroLyzer SC呼氣儀(美國QuinTron公司)進行小腸中細菌過度生長檢測。檢測方法嚴格按檢測儀操作說明進行,診斷標準[10]:⑴基礎呼氣氫值>20×10-6,且隔半小時重復測定>20×10-6;⑵喝完乳果糖后1.5 h內呼氣氫值增加>20×10-6。以上2項任意1項陽性即診斷為SIB0。
1.3 患者HA、LN、PCⅢP及Ⅳ-C水平檢測 空腹抽取患者肘靜脈血4ml,3 000 r/min離心離心15 min,分離上層血清液,HA、LN、PCⅢP及Ⅳ-C水平采用放射免疫分析法檢測,試劑盒購于北京北方生物技術研究所,所用儀器為雅培i2000時間分辨熒光免疫分析儀。
1.3 統計學處理 數據分析采用SPSS22.0軟件,年齡、HA、LN、PCⅢ和Ⅳ-C等資料采用表示,組間比較使用t檢驗,性別、患者小腸中細菌過度生長發生率等資料采用n(%)表示,組間比較使用χ2檢驗。檢驗水準:α=0.05。
2 結果
2.1 小腸細菌過度生長發生率情況NAFLD組小腸細菌過度生長發生率為51.82%(57/110),明顯高于對照組的9.00%(9/100),差異比較有統計學意義(χ2=44.562,P=0.000<0.05);NAFLD組中,中重度脂肪變患者小腸細菌過度生長發生率為71.05(27/38),明顯高于輕度脂肪變患者的41.67%(30/72),差異比較有統計學意義 (χ2=8.603,P=0.003<0.05)。
2.2 NAFLD組小腸細菌過度生長陽性和陰性患者血清HA等比較NAFLD組小腸細菌過度生長陽性者血清HA、LN、PCⅢ和Ⅳ-C分別為(134.40±21.10)ng/ml、(176.61±30.22)ng/ml、(130.22±21.13)ng/ml和(74.40±13.32)ng/ml,明顯高于小腸細菌過度生長陰性者(P<0.05)。見表1。
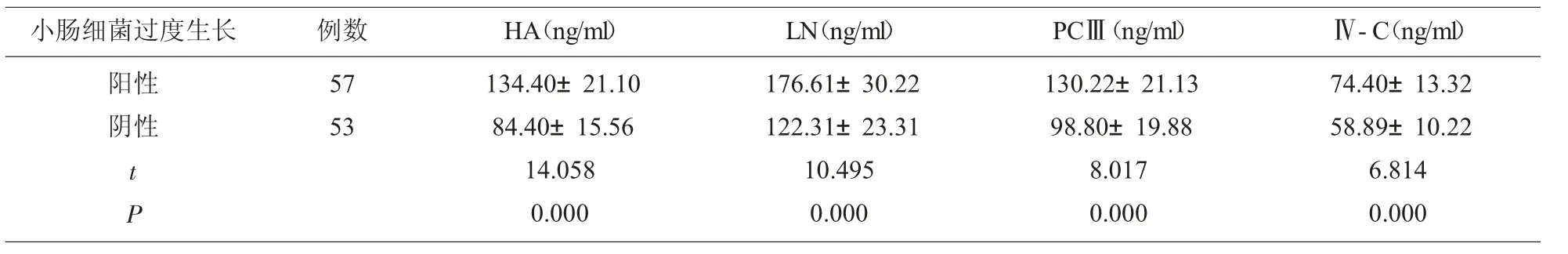
表1 NAFLD組小腸細菌過度生長陽性和陰性患者血清HA等比較
3 討論
NAFLD是指排除過量飲酒等因素,以肝細胞脂肪病變為主要病理表現的綜合征。肝纖維化是NAFLD的重要原因,研究表明[11],有50%的NAFLD患者腸道中細菌過度生長。腸道細菌的過度生長在NAFLD的發生和發展中起重要作用。臨床實踐證明[12],在對非酒精性脂肪肝肝纖維化患者的診斷中,一些血清學指標可以在一定程度上反映肝纖維化的進程,并且有很好的診斷價值,這就啟示我們在對NAFLD的診斷與鑒別中,血清學指標可被納入到檢測項目中來。
HA,LN,PCⅢP和IV-C的合成與分泌主要發生在肝星狀細胞內,HA是一種多糖,當肝臟遭到損傷時其合成加快,但肝臟的降解功能下降,至患者血清中HA呈現高水平,不能恢復到正常水平,因此,HA能夠在一定程度上反應肝臟受損的程度[13,14]。在肝脂肪與內皮細胞中均有LN的存在,但是當肝臟內由于一些因素導致炎癥細胞激活時,炎癥因子會大量聚集,LN合成過程加速,顯示出基底膜的轉化[15]。PCⅢ反映了III型膠原蛋白的合成水平,肝硬化嚴重時,PCⅢ水平顯著升高[16]。當Ⅳ-C大量聚集時,與LN共同形成基底膜,HA和PCⅢP不能被正常吸收與代謝,水平大幅度升高[17,18]。NAFLD患者有不同程度的肝損傷。不僅發生肝脂肪變性,而且肝纖維化趨向于發展為肝硬化。
本研究結果顯示,在NAFLD患者中,患者小腸中細菌過度生長且血清HA、LN、PCⅢ和Ⅳ-C水平顯著升高。分析原因是當腸道菌群失調時,腸粘膜受到一定程度的損害,導致其通透性增加,使大量內毒素通過門脈系統,導致腸道內大量毒素積聚,這些毒素到達肝臟,損害肝細胞,激活肝星狀細胞的活性,使HA、PCⅢ、Ⅳ-C、LN因子大量產生,使其在肝細胞外基質的過度沉積,導致肝臟纖維化,能夠在一定程度上呈現肝纖維化進程,引起脂肪性肝炎,同時還通過降低肝臟對體內毒素清除能力。小腸細菌的過度生長通過影響肝細胞生長環境,引發炎癥與細胞壞死,使肝纖維化與肝損傷程度有關,進一步增加NAFLD的發生率,是引發NAFLD的原因之一。
本研究結果還顯示,NAFLD組患者小腸中細菌過度生長發生率顯著較對照組升高,重度脂肪變患者小腸中細菌過度生長發生率顯著較輕度患者高。患者小腸中細菌過度生長會損傷腸道粘膜,使其對外的屏障作用遭受影響,進一步引發而至腸粘膜缺血、萎縮,造成腸道菌群失調。肝臟清除毒素的能力降低,并且大量毒素直接進入人體而不在肝臟中解毒,造成大量有害因子的釋放,引起肝細胞損傷與壞死,抑制正常的凋亡過程。患者小腸中細菌還可以損傷肝竇內皮細胞,激發施瓦特曼反應,使肝內微循環發生障礙,這是引起NAFLD的原因之一。患者小腸中細菌過度生長使得小腸微絨毛發生異常,微絨毛的屏障與保護的作用受到抑制,免疫防御機制受損,NAFLD患者肝臟對內毒素的清除功能變得微弱,腸道中細菌的過度生長與NAFLD形成惡性循環,故需糾正患者腸道中細菌的過度生長,以便減少NAFLD的發生。
有研究發現[19,20],在小鼠發生NAFLD的環境影響因素中,腸源性內毒血癥的作用尤為突出,小腸細菌過度生長加劇了體內毒素的產生,而小腸細菌過度生長在NAFLD的具體發生機制還沒有明確結論,本研究通過檢測HA、LN、PCⅢP、Ⅳ-C水平來探討患者腸道中細菌過度生長在NAFLD中的作用,NAFLD患者發生小腸中細菌過度生長的幾率顯著增加,小腸中細菌過度生長可作為NAFLD的危險因素,從腸道微生態學的角度來說,防治患者腸道細菌產生的有毒物質損傷肝臟,將有助于預防NAFLD的惡化。
綜上所述,NAFLD患者小腸中細菌過度生長發生率高,可能在疾病發生發展中有一定作用。

