豌豆寡肽對飲食誘導的高血壓大鼠血管緊張素轉化酶活性及腸道菌群調節效果評價
陳炫宏,嵇 威,董雷超,南希駿,王 猛,孫婉婷,王 賽,周泉城,*
(1.山東理工大學農業工程與食品科學學院,山東 淄博 255000;2.山東省食品快速分析技術工程實驗室,山東 淄博 255049)
高血壓(hypertension,HTN)是一種以體循環動脈血壓增高為主要特征的臨床綜合征[1]。1958—2015年間全國HTN抽樣調查結果顯示,我國成年人HTN總患病率逐年升高趨勢明顯[2]。并且HTN還可引發其他并發癥,其中以腦卒中和心肌梗死最為常見,嚴重威脅著我國居民的健康[3]。隨著對HTN研究的不斷深入,已有研究證明血管緊張素轉化酶(angiotensin converting enzyme,ACE)與HTN的形成有重要聯系[4],ACE的主要作用是催化血管緊張素I(angiotensin I,Ang I)轉化為具有強收縮血管作用的Ang II,從而使心肌收縮力增強,造成血壓升高[5]。此外,HTN還可能與腸道微生物有關[6],多項對HTN大鼠腸道菌群的研究表明,HTN組大鼠腸道菌群的混亂度、豐富度和多樣性等與正常大鼠相比均會發生顯著變化[7-9]。
近年來,越來越多的研究表明可食用的植物源蛋白酶解液對HTN具有一定的治療效果,朱玲[10]研究發現豌豆蛋白酶解液具有抑制ACE活性的作用,其中含有2~4 個氨基酸的寡肽效果最好,但未指明其抑制ACE的寡肽組成及與ACE的作用方式。為探明豌豆寡肽(Val-Glu-Pro-Gln,VGPG)對HTN的調節效果及作用方式,本研究在VGPG與ACE分子對接作用機制研究的基礎上,對其調節HTN大鼠的血壓、血液中血脂、ACE含量以及腸道菌群相關指標進行測定,分析VGPG在HTN調節過程中與ACE活性、腸道菌群之間的關系,旨在闡明VGPG對飲食引起的HTN的作用規律和機制。
1 材料與方法
1.1 動物、材料與試劑
雄性Wistar大鼠(8 周齡、體質量(200±20)g)由濟南金豐實驗動物有限公司提供,生產許可證號:SCXK(魯)2014-0007。配套標準飼料與墊料由濟南金豐實驗動物有限公司提供。
VGPG 杭州肽佳生物科技有限公司;非洛地平緩釋片 合肥立方制藥股份有限公司;馬尿酰組胺酰亮氨酸(N-hippuryl-His-Leu hydrate,HHL)、ACE美國Sigma公司;食用鹽 湖北長舟鹽化有限公司;總膽固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL-C)、游離脂肪酸(free fatty acid,FFA)、脂蛋白a(lipoprotein(a),Lp(a))、ACE免疫分析試劑盒 上海酶聯生物科技有限公司;乙酸乙酯、D-果糖 上海愛純生物科技有限公司。
1.2 儀器與設備
ZH-HX-Z型無創尾動脈血壓測量分析系統 安徽正華生物儀器設備有限公司;精密分析天平 梅特勒-托利多儀器(上海)有限公司;MULtiskan型酶標儀 北京澎昆博遠科貿發展有限公司。
1.3 方法
1.3.1 分子對接
1.3.1.1 受體結構準備
ACE蛋白結構從蛋白質數據庫(protein data bank,PDB)中獲取,PDB代碼為1O8A[11]。對蛋白結構進行加氫處理,并將處理后的結構作為分子對接的初始模型,采用AutoDockTools 1.5.6軟件進行處理,保存蛋白原有電荷,并生成pdbqt文件用于對接。
1.3.1.2 配體結構準備
構建多肽分子VGPG的三維結構,多肽N端為纈氨酸,C端為谷氨酰胺。由于實驗條件pH值為7.4,因此VGPG的N端被質子化,采用MOPAC程序[12]優化分子結構,計算PM3原子電荷[13],采用AutoDock Tools 1.5.6軟件處理配體結構,生成相應的pdbqt文件用于后續對接。
1.3.1.3 分子對接
分子對接采用AutoDock 4.2.6軟件包[14]實現,設定1O8A晶體結構中Zn2+所在的位置為活性位點,將多肽VGPG對接到活性位點,對接盒子的中心坐標設為(36.99,41.25,43.45),XYZ各方向的格點數設為80×60×60 個,格點間距為0.375 ?,對接次數為100 次,其余參數采用默認值。
1.3.1.4 分子對接結果優化
分子對接的結果在空間結構上可能存在不合理的原子接觸,可以采用能量優化的方法對這些作用力進行釋放,使其更趨于穩定結構。能量優化采用Amber14力場[15],優化過程分兩步進行:先進行5 000 步的最陡下降法優化,再用5 000 步的共軛梯度法對結構進一步優化,將最終的結果作為后續分析的模型。
1.3.2 體外ACE抑制率及酶促動力學分析
體外ACE抑制率實驗參考吳建平等[16]的方法并稍作修改,樣品采用不同純度(70%、85%、98%)、不同質量濃度(0.85、1.7、3.4、6.8、12.8 mg/mL)的VGPG。實驗在1.5 mL的離心管中進行,每次測定體系的總體積為0.2 mL:含50 mmol/L pH 8.3磷酸鹽緩沖液、300 mmol/L NaCl、5 mmol/L HHL、20 μL 0.2 mg/mL的樣品。在37 ℃恒溫水浴保溫5 min,然后加入酶液(0.1 U溶于1 mL相同緩沖液中)啟動反應,恒溫保持30 min后,加入0.2 mL 1 mol/L HCl溶液終止反應,再加入1.0 mL冷凍后的乙酸乙酯,均勻混合15 s,3 500 r/min離心5 min,取出0.8 mL乙酸乙酯層轉入另一試管中,在90 ℃的烘箱中烘干1 h,再將其重新溶于0.8 mL去離子水中,在228 nm波長處測定光密度值。單位酶活力定義為在37 ℃、1 min內催化HHL形成1 μmol馬尿酸所用酶量。抑制率按公式(1)進行計算。

式中:OD1為不存在抑制劑時的光密度值;OD2為抑制劑與酶共同存在時的光密度值;OD0為抑制劑與酶都不存在時的光密度值。
酶促動力學實驗參考Chen Jiali等[17]的實驗方法并稍作修改,固定ACE質量濃度(0.5 mg/mL)不變,分別以不同濃度(0.81、1.62、2.44、3.24、6.48 mmol/L)HHL為底物,并分別添加質量濃度為0.85、3.4、12.8 mg/mL的VGPG(純度均為98%),同時設空白對照組(不添加VGPG),37 ℃保溫準確反應10 min。測定ACE的酶促反應速率(V),平行測定3 次,通過Lineweaver-Burk雙倒數法,以1/V-1/[S]作圖,并按米氏雙倒數方程(公式(2))計算最大酶促反應速率(Vmax)和米氏常數(Km),根據其結果判斷VGPG對ACE的抑制作用類型。
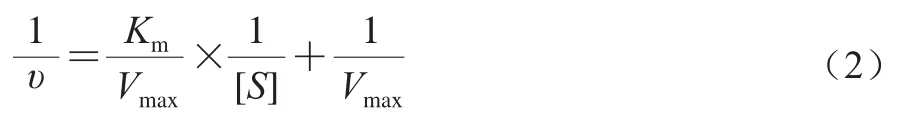
式中:υ為產物生成速率/(μg/min);Km為米氏常數/(mmol/L);[S]為底物濃度/(mmol/L);Vmax為最大反應速率/(μg/min)。
1.3.3 高鹽、高糖誘導Wistar大鼠HTN模型的建立與分組
本研究模擬自然人群HTN形成過程[18-19],對大鼠給予含質量分數5% NaCl的高鹽飲食和含質量分數20%果糖的高糖飲水。采用大鼠血壓心率測定儀每天測壓,并進行持續1 周的尾部預溫和環境適應訓練(將大鼠固定好后等待20 min,使大鼠心率穩定后進行測定),至連續3 d血壓收縮壓大于140 mmHg并穩定,則視為建模成功。
對建模成功HTN大鼠進行分組,分別為模型組(標記M,生理鹽水質量濃度9 g/L)、對照組(標記C,非洛地平緩釋片質量濃度0.5 mg/mL)、VGPG高劑量組(質量濃度50 mg/mL)、VGPG中劑量組(質量濃度25 mg/mL)、VGPG低劑量組(質量濃度12.5 mg/mL),同時設立正常組(標記Z,生理鹽水質量濃度9 g/L),每組6 只,灌胃劑量5 mL/kgmb,每隔3 d測血壓、稱質量,灌胃實驗持續3 周。
1.3.4 大鼠血清中ACE活性、血脂指標濃度以及臟器指數的測定
血清中ACE活力、血脂指標濃度測定:各組經3 周灌胃實驗后,采用眼眶取血法采血,室溫靜置1 h自然凝固,平衡后3 000 r/min離心10 min,取上清液參照試劑盒說明書測定ACE活力及其他血脂指標(TC、TG、LDL-C、HDL-C、LP(a)、FFA)濃度。
臟器指數測定:灌胃實驗結束后解剖大鼠,取出脾臟、腎臟,用濾紙吸干殘血后,分別稱其質量作為相應臟器指數。
1.3.5 大鼠腸道菌群相關指標測定
3 周灌胃實驗結束后處死大鼠并將其解剖,之后在無菌環境下取大鼠腸道糞便貯于滅菌EP管中并密封保存,置于液氮中備用。后將樣品送至上海美吉生物醫藥科技有限公司進行腸道菌群α-多樣性分析、菌群群落分析、Heatmap分析。
1.4 數據處理與分析
采用SPSS 17.0軟件進行數據分析,Origin 2018軟件作圖,實驗數據用平均值±標準差表示,顯著性分析采用單因素方差分析法,差異性顯著水平P<0.05。
2 結果與分析
2.1 VGPG與ACE的結合模式分析
通過將VGPG對接到ACE的活性位點,可以深入研究二者的結合模式。分子對接得到的結合能為-26.03 kJ/mol,對接結果如圖1所示,可以看出多肽分子VGPG能夠結合在ACE的活性位點,并且由于VGPG結構中具有較多的氫鍵供體和受體,與ACE活性位點的氨基酸殘基形成了較強的親水相互作用。因此,分子對接結果初步表明,VGPG能夠與ACE結合并具有較強的親和力,其中氫鍵相互作用可能對于二者的結合具有重要的貢獻。
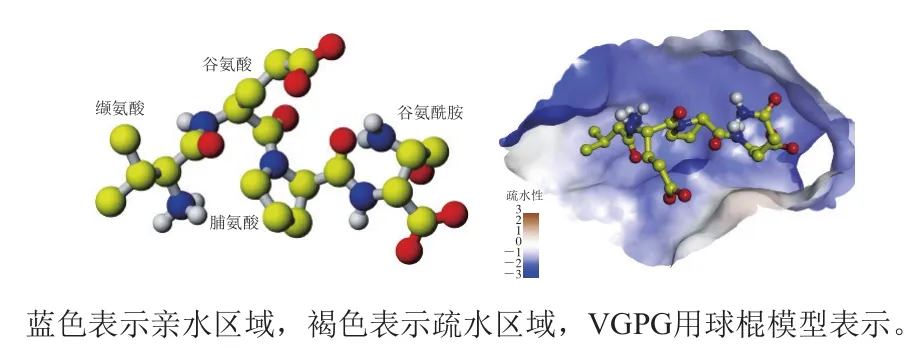
圖1 VGPG分子結構(A)及VGPG與ACE活性位點的結合(B)Fig. 1 Molecular structure of VGPG (A) and binding of VGPG to the active site of ACE (B)
VGPG與ACE結合模式如圖2所示。參與二者結合的氨基酸殘基主要有Ala356、Pro407、Val518、Arg522、Tyr523以及Zn2+,其中VGPG與Ala356和Arg522能夠形成氫鍵,而VGPG的C末端羧基與Zn2+形成了金屬配位鍵,從而起到抑制ACE作用,這與Cheung等[20]的研究結果一致。表明VGPG主要通過氫鍵作用以及與Zn2+的配位作用與ACE的活性位點結合,對ACE起競爭性抑制作用,從而抑制ACE的活性。
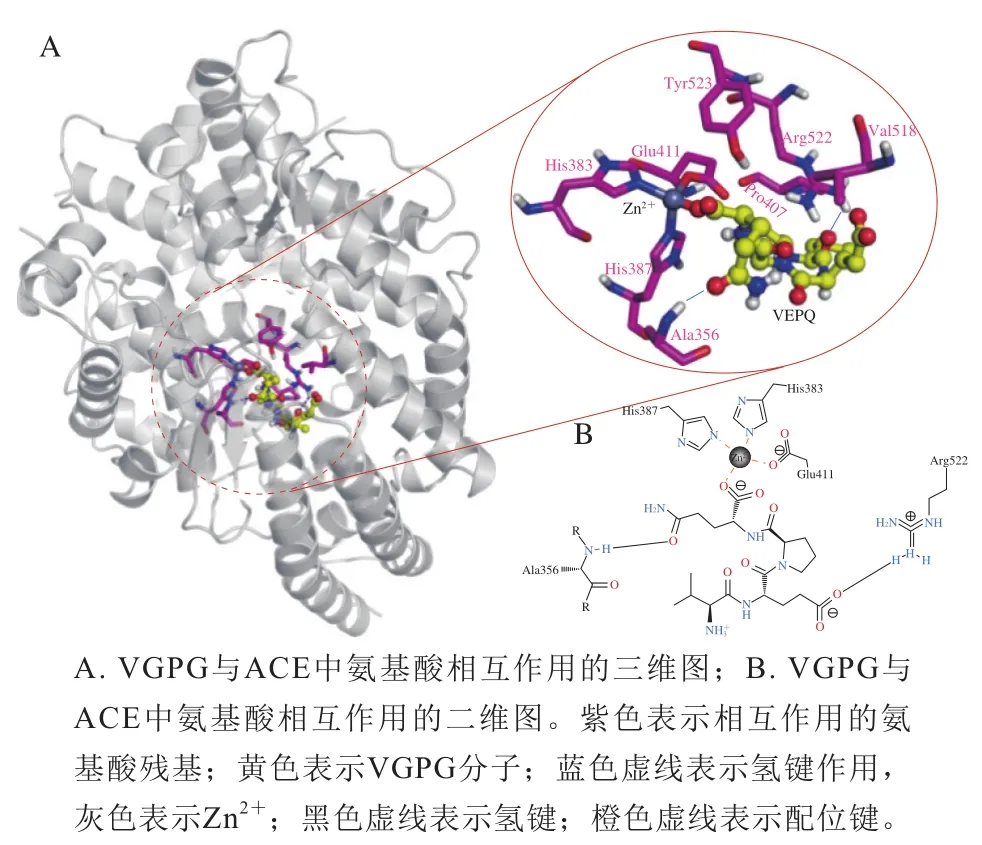
圖2 VGPG與ACE的結合模式Fig. 2 Binding pattern of VGPG to ACE
2.2 VGPG對ACE抑制率及酶促動力學分析結果
由圖3A及表1可知,VGPG在不同質量濃度下的Lineweaver-Burk倒數圖為近似相交于Y軸的一組直線,其中截距1/Vmax約為1.58 min/μg,Km隨著VGPG質量濃度的增大而增大,表明其對ACE的抑制模式為競爭性抑制。
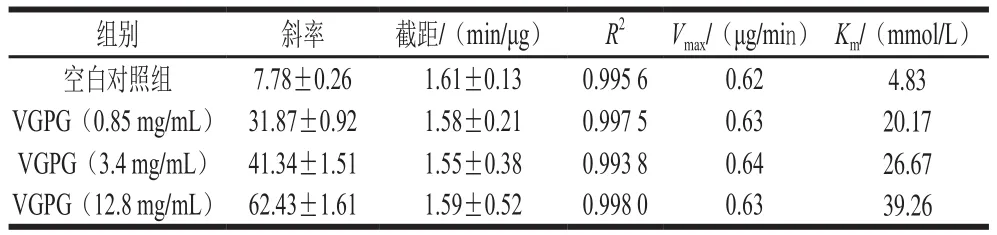
表1 VGPG對ACE抑制作用的Lineweaver-Burk曲線方程Table 1 Lineweaver-Burk curve equations of VGPG at different concentrations for ACE inhibition
由圖3B VGPG對ACE體外抑制實驗結果可知,不同純度VGPG對ACE的抑制率具有明顯差異。VGPG純度70%、85%、98%的半抑制質量濃度分別為2.30、1.15、0.75 mg/mL,表明VGPG的純度越高對ACE的抑制效果越好,兩者呈正相關關系。此外,在相同純度下,隨著VGPG質量濃度的增加,其對ACE的抑制率呈現先上升后下降的趨勢,且當VGPG純度為98%、質量濃度為3.4 mg/mL時抑制率最大,達到77.4%,與Nawaz等[21]所制備的酶解豌豆肽研究結果相似。這是由于當VGPG質量濃度較低時,隨著濃度升高,VGPG競爭結合ACE活性位點能力提高,從而對ACE抑制效果顯著提升;而當VGPG質量濃度較高時,由于ACE活性位點處結合的VGPG達到飽和,VGPG的競爭結合ACE活性位點能力降低,并且由于VGPG的結構中含有較多的氫鍵供體和受體,其在高質量濃度下會通過靜電作用相互影響,從而表現出對ACE抑制效果增長緩慢甚至是下降現象。這與前文VGPG對ACE分子結合模式為競爭性抑制作用的結論一致。

圖3 VGPG的酶促動力學(A)和不同純度VGPG對ACE抑制率(B)Fig. 3 Enzymatic kinetics of VGPG (A) and inhibitory rates of ACE by VGPG of different purities (B)
2.3 VGPG對HTN大鼠血壓和體質量的影響
如圖4所示,在HTN模型建立期間,Z組大鼠血壓維持在100~120 mm Hg之間,其余實驗組大鼠的血壓明顯上升并維持在140 mm Hg以上,證明HTN模型建造成功。同時,Z組大鼠在持續灌胃期間血壓穩定,表明實驗室飼養環境對大鼠血壓無明顯影響。藥物干預后,灌胃實驗結束時C組大鼠血壓明顯降低,與治療前相比血壓降低了19.0%;VGPG各劑量組血壓也有不同程度的下降,其中VGPG中劑量組下降程度最大,達到15.8%,低劑量組與高劑量組分別下降11.6%和9.3%。說明中劑量的VGPG降壓效果最好,與圖3B體外模擬抑制實驗結果相印證,表明降壓效果不是單純地隨著VGPG質量濃度的提高而提升,間接證明VGPG是通過競爭性抑制ACE活性的方式來降低血壓。
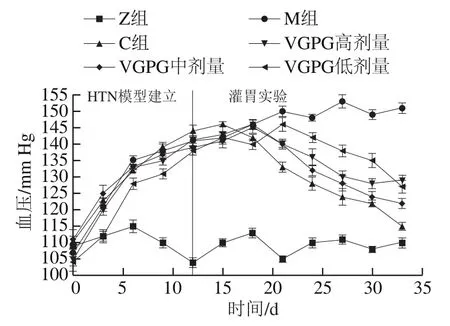
圖4 VGPG對HTN大鼠血壓的影響Fig. 4 Effect of VGPG on blood pressure of HTN rats
由圖5可知,在整個持續灌胃期間M組大鼠體質量持續增加,并且顯著高于Z組,C組與VGPG各劑量組同樣顯著上升,符合高鹽高糖飲食所致HTN患者的生理特征[22],間接證明了實驗建模成功。在給予非洛地平緩釋片與VGPG后,與灌胃實驗開始時相比,C組與VGPG各劑量組大鼠體質量在灌胃期間均呈現不同程度的下降,灌胃結束時下降幅度為VGPG中劑量組最高,達到10.3%;C組次之,達到5.4%。這與對應各組大鼠血壓變化趨勢相似,表明HTN對體質量具有一定的影響,且VGPG有助于緩解由于高鹽高糖飲食所導致的肥胖,對降低血壓具有積極作用。
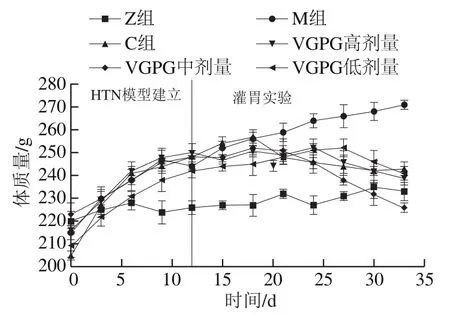
圖5 VGPG對HTN大鼠體質量的影響Fig. 5 Effect of VGPG on body mass of HTN rats
2.4 VGPG對HTN大鼠血清ACE活力的影響
如圖6所示,M組HTN大鼠血清中ACE活力最高,達到897 mU/mg,而Z組大鼠血清中ACE活力為511 mU/mg,兩者之間具有顯著差異(P<0.05),表明血清中ACE活力顯著增加是誘發HTN的一個重要因素[23]。與Z組相比,C組大鼠血清中ACE活力無顯著差異(P>0.05),同時VGPG各劑量組大鼠血清中ACE活力與Z、M組相比具有顯著差異(P<0.05),其中VGPG中劑量組與正常大鼠ACE活力最為接近,證明通過抑制大鼠血清中ACE活力是VGPG降壓的一條途徑,且中劑量的VGPG抑制效果最好。
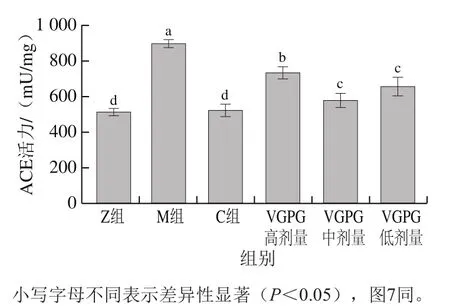
圖6 VGPG對HTN大鼠血清ACE活力的影響Fig. 6 Effect of VGPG on ACE activity in serum of HTN rats
2.5 VGPG對HTN大鼠血清中血脂的影響
由表2可知,M組較Z組血脂中各項指標均發生不同程度的變化,6 項血脂濃度均低于Z組;C組大鼠血脂中HDL-C、LP(a)、LDL-C濃度與Z組之間無顯著差異(P>0.05),TG濃度顯著低于Z組而高于M組,TC、FFA濃度高于Z組(P<0.05),表明藥物對血脂變化有積極作用,這與文獻[24]報道一致;與Z組相比,VGPG中、低劑量組大鼠血脂中TG、FFA濃度具有顯著差異(P<0.05),VGPG中劑量組大鼠血脂中其余成分與Z組相比無顯著差異(P>0.05),其變化趨勢與C組相似,表明VGPG與HTN藥物對血脂成分的影響作用效果相似。值得注意的是,VGPG各劑量組中VGPG中劑量組的血脂各項指標濃度相較于其他兩組與Z組更為接近,因此,中劑量的VGPG對大鼠HTN調節具有更好的效果,而且VGPG對于大鼠HTN的作用效果并不是單純隨著濃度的升高而增加,這與前文的研究結果相同。

表2 HTN大鼠血脂組成成分濃度Table 2 Blood lipid levels in HTN rats
2.6 VGPG對HTN大鼠臟器指數的影響
由表3可知,M組HTN大鼠的脾臟指數顯著高于Z組(P<0.05),VGPG低、高劑量組脾臟指數與M組無顯著差異,C組、VGPG中劑量組脾臟指數與Z組無顯著差異(P>0.05);對腎臟指數而言,各組相對Z組均顯著降低(P<0.05),但其中VGPG中劑量組腎臟指數與Z組最為接近。結果表明,HTN會對腎臟、脾臟器官產生一定的影響,而VGPG對此具有一定的治療和調節作用,且中劑量的VGPG效果最好,與文獻[25]報道一致。
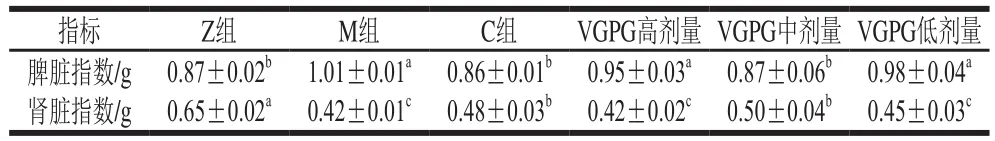
表3 VGPG對HTN大鼠臟器指數的影響Table 3 Effect of VGPG on spleen and kidney indices in HTN rats
2.7 VGPG對大鼠腸道菌群的影響
2.7.1α-多樣性分析結果
對大鼠腸道菌群進行物種α-多樣性分析,結果如圖7所示。M組Sobs指數較Z組顯著降低,表明由高鹽高糖引發的HTN會降低腸道菌群的多樣性,這與文獻[26]研究結果一致;對大鼠給予非洛地平緩釋片與VGPG治療后,C組菌群豐富度有顯著提升,說明藥物對腸道菌群的多樣性具有顯著影響;VGPG低、中劑量組菌群豐富度顯著高于M組,分別高出122.7%、51.1%,且菌群豐富度隨著VGPG質量濃度的增加而呈現明顯下降趨勢,說明較低質量濃度的VGPG有利于菌群生長,但質量濃度太高則會選擇性地導致某些腸道菌群減少或消失,且這種作用隨VGPG質量濃度增加而增強。需要注意的是,盡管VGPG低劑量組糞便菌群豐富度最高,但VGPG中劑量組豐富度與Z組最為接近,表明中劑量的VGPG具有改善因HTN而造成的菌群豐富度與多樣性下降的能力,從而使腸道菌群微環境維持在正常范圍之內,進而起到降壓的效果。
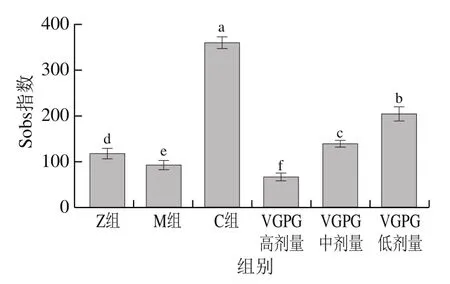
圖7 大鼠腸道菌群Sobs指數Fig. 7 Sobs index of intestinal flora in rats
如圖8A所示,Sobs稀釋曲線趨于平緩,說明測序數據達到飽和,能夠覆蓋大鼠腸道微生物組群落的絕大部分物種。且Sobs指數中C組最高,之后依次為VGPG低劑量組、VGPG中劑量組、Z組,M組與VGPG高劑量組Sob指數均低于正常大鼠,VGPG中劑量組與Z組最接近,表明其與正常大鼠的菌群豐富度最相似。

圖8 大鼠腸道菌群稀釋曲線(A)和Shannon曲線(B)Fig. 8 Rarefaction curve (A) and Shannon (B) curves of intestinal flora in rats
Shannon指數能夠反映菌群的多樣性[27],由圖8B可知,M組相較于Z組,多樣指數明顯降低,說明HTN會降低腸道菌群的多樣性;C組與Z組相近,說明藥物基本不會影響腸道菌群的多樣性;VGPG低劑量組與中劑量組HTN大鼠腸道菌群的多樣性與Z組接近,而高劑量組明顯低于Z組。表明由高鹽高糖所引發的HTN會明顯改變生物腸道中菌群的豐富度與多樣性,低、中劑量的VGPG對HTN患者腸道菌群有一定的改善作用。
2.7.2 門水平上大鼠腸道菌群群落分析結果
目前已有研究表明厚壁菌門(Firmicutes)和擬桿菌門(Bacteroidetes)之比(F/B)可以反映腸道菌群紊亂程度[8]。由圖9可知,Z組、M組、C組、VGPG高劑量組、VGPG中劑量組、VGPG低劑量組F/B分別為3.27、0.65、5.89、4.54、4.88、6.24。M組腸道菌群的紊亂程度最低,而VGPG低劑量組最高。其原因可能是由于通過高糖高鹽飲食所引發的HTN會使腸道中菌群的豐富度降低,從而使HTN大鼠腸道菌群的紊亂程度相對降低,同時也表明藥物會增加腸道菌群的紊亂程度,對其造成不良影響。結合Heatmap圖(圖10)進行樣本聚類分析,在門水平上大鼠腸道各菌群分布M組與Z組差別最大,VGPG劑量組中1組與Z組最為接近,證明VGPG對HTN大鼠腸道菌群具有改善效果。

圖9 門水平大鼠腸道菌群群落分析Fig. 9 Intestinal flora community analysis of rats at the phylum level

圖10 門水平大鼠腸道菌群Heatmap圖Fig. 10 Heatmap of the intestinal flora of rats at the phylum level
2.7.3 科水平上大鼠腸道菌群群落分析結果
如圖11、12所示,在科水平上,與Z組相比,M組中產短鏈脂肪酸菌科(Prevotellaceae)所占比例明顯上升,產乙酸、丁酸等菌科(Lachnospiraceae)所占比例明顯下降,存在腸道菌群失衡現象。表明HTN大鼠腸道菌群中產短鏈脂肪酸細菌數量增加,而產乙酸、丁酸細菌數量減少,這與文獻[8]的研究結果相同。腸道菌群與血脂成分分析結果表明,腸道微生物影響血壓的機制之一可能是通過其分泌物(如短鏈脂肪酸等)影響大鼠血脂成分,進而對血壓產生一定的影響,這與Felizardo等[28]的研究結果一致。使用非洛地平緩釋片和VGPG干預后,C組與VGPG各劑量組Prevotellaceae與Lachnospiraceae占比接近正常大鼠,但C組中螺旋體科(Spirochaetaceae)比例上升,其所屬菌屬(如密螺旋體屬、疏螺旋體屬以及鉤端螺旋體屬等)均具有較強的致病性,并且已有多項研究表明,Spirochaetaceae會導致疾病的發生和傳播[29-30]。本實驗中C組的Spirochaetaceae比例上升,盡管未表現出明顯的疾病癥狀,但仍增加了大鼠患病的潛在風險;VGPG各劑量組中Lactobacillaceae比例明顯上升,此菌類與糖類物質代謝分解有關,其所屬絕大多數菌屬(如乳酸菌、植物乳桿菌等)均具有較強的分解糖類物質的能力,可以將葡萄糖、果糖等物質分解為乳酸,屬益生菌[31]。因此,VGPG各劑量組中Lactobacillaceae比例明顯上升,使得大鼠腸道對誘發HTN病因之一——果糖的分解能力大大提高,從而對緩解、治療HTN疾病產生良好的作用。大鼠腸道菌群分析結果表明,對照組藥物可能在治療HTN的過程中對腸道菌群產生一定的副作用,而VGPG對菌群無明顯副作用,并且對改善腸道菌群具有積極作用。

圖11 科水平大鼠腸道菌群群落分析Fig. 11 Intestinal flora community analysis of rats at the family level

圖12 科水平大鼠腸道菌群Heatmap圖Fig. 12 Heatmap of the intestinal flora of rats at the family level
3 結 論
本研究表明VGPG對HTN疾病具有顯著的治療效果,在21 d的HTN大鼠灌胃干預實驗中,純度為98%、質量濃度為25 mg/mL的VGPG具有最好的降壓效果,并且VGPG還可緩解由HTN所引起的肥胖;與常規降壓藥物相比,VGPG對腎臟、脾臟器官以及腸胃微生態環境無明顯副作用。VGPG在體內存在兩種降壓機制:1)通過與ACE活性位點相結合,對其活性產生競爭性抑制從而達到降壓的作用;2)通過調節腸道微環境,使菌群豐富度和多樣性維持在正常范圍以內,同時提高菌群對糖類物質的分解能力,減少因腸道微生物紊亂而對大鼠血壓造成的不良影響。這兩種調節方式之間是否存在關系還有待進一步研究。綜上所述,本研究從分子對接、體外、體內3 個層面,探索性地研究了VGPG對大鼠HTN的抑制效果和機制,揭示腸道菌群、ACE活性與HTN的關系,結果表明VGPG可被用作治療HTN的功能性因子,可用于相關功能性食品的制備。

