商品海參溯源分析技術研究進展
蔣冰雪,張曉梅,何曉霞,張九凱,張鴻偉,*,李兆杰,薛長湖,,馮婷玉,姜曉明,,*
(1.中國海洋大學食品科學與工程學院,山東 青島 266003;2.青島海關技術中心,山東 青島 266002;3.即墨海關,山東 青島 266200;4.中國檢驗檢疫科學研究院,北京 100176;5.青島海洋食品營養與健康創新研究院,山東 青島 266000)
由于食品安全問題、產品欺詐性貼標行為層出以及消費者獲知產地和生產方法的意愿逐漸增強[1],食品產品的溯源正成為全球消費者、海參行業從事者和監管機構的主要關注點。自1950年以來,水產養殖產量一直在穩步增長,其中海參作為重要的海產品,全球產量近22萬 t,總產值超過70億 美元[2]。海參含有多種生物活性化合物,具有抗氧化[3]、抗癌[4]、抗炎[5]、抗血栓[6]、抗糖尿病[7]、抗肥胖[8]等作用,并可以提高學習能力和記憶力[9],因而深受消費者喜愛。在貿易產品中,海參通常會經過干制、切片、粉碎等處理,使得消費者、經銷商和監管部門難以從外觀形態上對其種類、產地和生產方式進行溯源。參種、產地、生產方式(如野生和養殖)不同會導致市面上不同的海參產品價格相差數十倍。為了牟取暴利,不誠信的商家會故意給海參產品貼上錯誤的標簽,如以低值海參冒充高值海參、偽造產地、養殖海參偽裝野生海參等[10]。這些欺詐行為除了影響海參行業的公信度之外,還易引發消費者對海參產品安全、衛生和真實性的擔憂,也對整體行業及消費者利益造成不可挽回的損害[11]。因此,明確商品海參參種、產地和生產方式信息是保證消費者對海參產品信任的必要條件。
當前,產品溯源體系建設分為監管、控制和檢測分析三大部分。溯源監管主要體現在法律法規、政策層面。《中華人民共和國產品質量法》(2018修正)第五條規定禁止偽造或者冒用認證標志等質量標志;禁止偽造產品的產地,偽造或者冒用他人的廠名、廠址;禁止在生產、銷售的產品中摻雜、摻假,以假充真,以次充好,并對相應違法行為列有明確的懲罰措施。溯源控制主要體現在流程追溯層面,即采用適當的技術和方法以追蹤從原料供應、生產加工到流通消費的全過程,保證這些過程中的環節需要符合相關質量管理體系標準,包括ISO9000認證、危險分析和關鍵點控制(hazard analysis critical control point,HACCP)、衛生標準操作程序(sanitation standard operation procedures,SSOP)、良好操作規范(good manufacturing practice,GMP)等。在溯源控制過程中,盡管射頻識別(radio frequency identification,RFID)[12]和新近的區塊鏈[13-14]技術對流程信息記錄和留存提供了高可控性的技術保障,但對于產品的內在本質特征則無法提供相關的數據信息。溯源分析作為監管和控制的技術支撐,為監管和控制提供技術驗證,是溯源體系鏈條中不可或缺的重要部分,溯源分析不僅可以通過技術證據改進和完善監管與控制環節,而且還可以作為監管和控制環節的有效補充和驗證,甚至在某些情況下起到推動另外兩個環節發展的作用,更為重要的是,溯源分析技術可以在不同水平呈現產品的內在本質特征,可有效補充溯源控制環節的信息溝壑,在相應數據庫的構建、積累和完善中與溯源控制技術聯合實現全流程、多維度、高容量的產品溯源信息采集體系的建立。
近年來,隨著現代生物技術不斷發展,目前DNA分析、元素分析、穩定同位素分析和組學分析等技術方法在商品的溯源分析中已經得到了實際應用。本文針對商品海參的摻假現狀,綜述了相關技術在商品海參溯源分析中的應用情況及最新進展,以期為這一領域的研究提供參考。
1 商品化食用海參的分類分布及生產方式
目前,全球已知的海參種類達到1 200多種,其中大約40 種為食用海參[15]。熱帶海域海參產量約占總產量的86%,溫帶海域海參主要分布在太平洋沿岸,主要以加州擬刺參(Parastichopus californicus)和仿刺參(Apostichopus japanicus)為主[16]。我國海參種類超過140 種,具有食用價值的約20 種,具有較高的商品價值的有10多種,其中刺參的營養價值和經濟價值被視為最高[17]。目前,主要食用商品海參的生物學分類及地理分布見表1。

表1 主要食用商品海參生物學分類及地理分布[18-20]Table 1 Main commercial edible sea cucumber species and their geographical distribution[18-20]
在海參的生產方式上,早期的商品海參主要源自海捕的方式,但由于野生資源的有限性和消費者對商品選擇的趨向性,人工養殖已成為食用海參供應的主要生產方式,自20世紀90年代以來,在我國山東牟平和遼寧大連開始逐漸規模化養殖刺參,刺參養殖已經突破傳統海域的限制,實現了“北參南養”和“東參西養”。北方主要養殖模式有池塘養殖、圍堰養殖、底播增殖、海底網箱養殖和大棚工廠化養殖等,南方則以浮筏吊籠養殖技術為主。此外,為了實現生態和經濟效益的最大化,出現了參魚、參蝦、參貝藻混養等多種養殖模式[21]。
2 商品海參溯源分析技術及研究進展
2.1 DNA分析
由于DNA分析表現出諸多優勢,近10 年來其發展迅速,被廣泛應用于食品產品溯源分析[22]。利用DNA圖譜鑒定食物中的動物物種是理想的技術手段,因為DNA的穩定性強,不受季節、環境和生物體狀態影響且相對耐高溫。隨著現代化儀器和商品化試劑盒的使用,大大縮短了DNA分析的檢測時間,使得分子標記方法更加簡便快捷,同時,自動化檢測能夠提高操作的精準度和重復性,防止交叉污染,使檢測過程更安全可靠。常見的DNA分析有基于核酸雜交和聚合酶鏈式反應(polymerase chain reaction,PCR)兩種標記技術,其中PCR被認為更快、更準確。DNA分析相關技術的原理和優缺點比較見表2。盡管DNA分析作為物種溯源分析技術應用相當普遍,但如果沒有一個集中的公共數據庫,很難使用DNA分析作為檢測食品替代和判定標簽合規性的公認標準方法[23]。
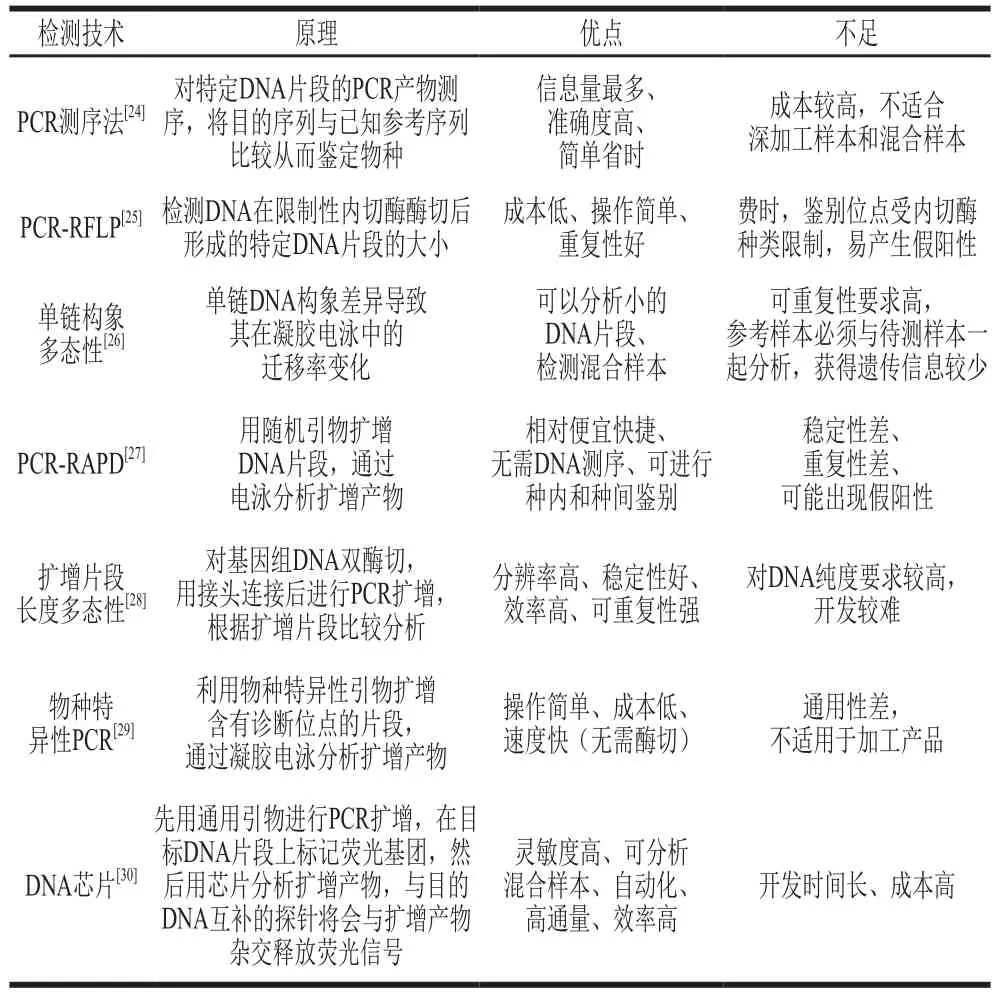
表2 DNA檢測技術比較Table 2 Comparison of DNA analysis techniques
用于物種溯源的PCR測序法通常稱為法醫信息核酸測序,常用的目標片段包括Cytb、COI、16S rRNA等基因[31]。Wen Jing等[32]通過基于COI基因和16S rRNA基因的DNA條形碼技術對市售商品海參科樣品進行鑒定,發現有7 個樣品存在標簽錯誤現象(63.6%)。Wen Jing等[33]建立了一種物種特異性PCR方法來鑒定11 種海參,設計位于16S rRNA基因區大小為269~406 bp的11 個種特異性引物,其中使用引物16Sar和16Sbr,即使從每個參種的冷凍和干燥產品中也可以很容易地擴增出線粒體16S rRNA基因的570 bp片段,最終檢測出兩種冷凍海參存在參種欺詐情況。之后又使用該技術設計了10 個種特異性PCR引物用以鑒定10 種干制商品海參參種[34]。Lü Yingchun等[35]在692 bp的COI片段中找到限制性酶BamH I、KpnI、PstI、XbaI和Eco31 I的酶切位點,采用PCR-限制性片段長度多態性(PCR-restriction fragment length polymorphism,PCR-RFLP)技術成功鑒別出仿刺參、梅花參、加州擬刺參、大西洋瓜參和子安福岡參5 種商品海參,并在10 種海參混合物中同時檢測到兩種海參。Zeng Ling等[36]用限制性內切酶DdeI、HaeIII和StyI對16S rRNA線粒體基因的570 bp區域進行酶切,通過所開發的PCR-RFLP方法成功鑒定了冷凍和干燥共19 種的海參產品,其中48%的產品標簽有誤。線粒體DNA的高豐度使得其與核DNA相比可以進行更有效的PCR擴增,深加工產品中線粒體DNA會比核DNA存活時間長,使擴增變得容易。然而,每個細胞的拷貝數在相同物種中,甚至同一個樣本體內的組織之間都會發生變化,這使得線粒體基因不適合量化[37]。因此,在需要定量分析確保溯源分析正確性的情況下,核基因更為適合[38]。
除了區分不同的參種,DNA分析還被應用于海參的產地溯源。Yun Zhenyu等[39]采用PCR-RAPD技術和基因片段測序技術對來自遼寧大連、山東煙臺和山東威海3 個產地的仿刺參進行遺傳關系和DNA多態性分析,結果表明,不同海域海參的基因差異特征明顯,由于威海和煙臺的地理位置相近,兩地的樣本親緣關系比大連更為密切。利用PCR-RAPD技術進行遺傳多樣性分析可作為一種快速產地溯源的方法,但同一物種之間遺傳變異的確切原因尚未得到詳盡的研究,一些研究認為這種變異是適應當地條件造成的,而另一些研究則認為是遺傳漂變造成的[40]。
盡管諸如生命條形碼數據系統和美國國立生物技術信息中心等數據庫不斷改進完善以解決一些普遍性問題,可是標準化方法缺失的問題仍然存在[41]。不過,DNA分析仍然是海參參種溯源時最值得推薦的分析方法之一。然而,由于基于DNA的分析技術無法區分來自同一地點海參的養殖樣本和野生捕獲樣本,因此使用DNA分析很難進行海參的生產方式溯源。最近,新興的基于基因組學的技術被應用于食品溯源分析研究,研究人員試圖從特異性、靈敏性和重復性等方面改善傳統DNA技術的性能。這些方法包括下一代測序(next-generation sequencing,NGS)[42]、高分辨熔解(high-resolution melt,HRM)[43]、液滴數字PCR(droplet digital PCR,ddPCR)[44]和環介導等溫擴增[45]。NGS技術徹底改變了分析DNA的方式,極大地提高了通量,對于未知食品或者深加工食品的溯源有著重要意義[46],已經應用于肉類食品物種溯源[47]。DNA條形碼本質上依賴于測序,為了克服這一缺點,另一項研究將實時PCR與HRM分析結合起來,對對蝦的物種進行了成功的溯源[48]。具有物種特異性寡核苷酸探針的DNA微陣列可快速進行多物種溯源,這也將是海參DNA溯源分析技術的發展方向之一[49]。目前的研究還傾向于開發便于攜帶和現場檢測的DNA分析技術,結合納米技術和DNA條形碼技術研發的納米示蹤劑簡化了DNA分析步驟,不依賴專業實驗室的測序就可以實現物種溯源[50],對未來海參溯源分析技術的開發具有一定的啟發。
2.2 元素分析
電感耦合等離子體質譜(inductively coupled plasma mass spectrometry,ICP-MS)是一種檢測微量元素濃度的高精度分析技術,具有精密度高、分析速度快、能夠多元素同時檢測等優點[51]。ICP-MS已用于食品溯源分析領域,并可區分海參的產地來源[52-53]。海參“沉積食性”的特點決定了其更加容易受到生長環境中水體和海底底泥的影響,對環境中各種無機元素進行富集使得海參體內微量元素呈現地域性差異。Liu Xiaofang等[54]采用ICP-MS技術對來自我國3 個海域(渤海、黃海、東海)的39 個海參樣品中15 種元素(Al、V、Cr、Mn、Fe、Co、Ni、Cu、Zn、As、Se、Mo、Cd、Hg和Pb)進行定量分析,并結合主成分分析(principal component analysis,PCA)、聚類分析和線性判別分析建立了分類模型,使用交叉驗證程序評估該模型,顯示交叉驗證率為100%,證實多元素分析用于海參產地溯源分析具有較高可行性。高岳等[55]收集了大連、青島、煙臺、福建4 個產地不同養殖方式(圈養、深海)的仿刺參,采用ICP-MS和原子吸收法測定刺參體壁中6 種元素(Mn、Cr、Cu、Al、P、Zn)含量,發現大連刺參Zn、Mn含量最高,煙臺刺參B、Cu含量最高,福建刺參Al、Cr含量最高,并且深海刺參體壁B、Cr和Cu含量均高于圈養刺參。
為了使ICP-MS法成為區分海參產地和生產方式的標準方法,需要確定區分所依賴的元素。雖然ICP-MS技術可以測定大多數元素濃度,但一些研究還在不影響產地溯源分析的前提下盡量減少分析的元素數量,ICP-MS的樣品前處理費時費力,因此測定每個樣品中元素數目越多,需要的分析時長就越長。此外,還需要構建一個海參產地區域的基本概況數據庫,以便對樣本進行精細比較,確定食品欺詐行為。
2.3 穩定同位素分析
同位素是具有相同數量質子但不同數量中子的元素,穩定同位素分析(stable isotope analysis,SIA)通過同位素來區分樣本。一般來說,用于溯源的同位素有δ13C/δ12C、δ2H/δ1H、δ15N/δ14N、δ18O/δ16O[56]。當穩定同位素在營養鏈向上移動時,輕重同位素比率通過分流效應被同化到動物組織中[57]。對于海參而言,同位素分餾效應受到產地、生產方式及種間差異等因素影響,由此可以對海參的產地和生產方式進行溯源分析。
周永亮[58]采集大連瓦房店市下轄的紅沿河鎮、謝屯鎮、永寧鎮、李官鎮和三臺象5 個鄉鎮的刺參并進行分析,結果顯示不同地區的刺參之間δ13C、δ15N值存在明顯差異,進行判別分析的準確率達到71.5%。Kang Xuming等[59]從中國秦皇島、大連、東營、青島和福建5 個地區收集76 只海參,研究分析這些海參中C、H、O、N的穩定同位素比和組成,使用線性判別分析(linear discriminant analysis,LDA)獲得了較高的識別率(93.4%),預測能力也高達89.5%。同時,單體穩定同位素分析技術(compound-specific isotope analysis,CSIA)已成為海參產地溯源分析的新工具。劉瑀等[60]測定并分析了黃渤海區域遼寧、山東兩地刺參氨基酸相對含量及其δ13C值,發現其中非必需氨基酸δ13C值差異顯著性高于必需氨基酸,由此選取Tyr和Ser的δ13C值作為指標區分刺參產地,判別結果明顯優于單一的氨基酸譜鑒別。之后,劉瑀等[61]通過此技術分析了大連轄區下的瓦房店、普蘭店、長海縣等7 個地區刺參的氨基酸δ13C值,結果表明刺參中的丙氨酸、甘氨酸、脯氨酸、絲氨酸、酪氨酸、亮氨酸、異亮氨酸、苯丙氨酸、纈氨酸、谷氨酸的δ13C值表現出顯著差異,特別是非必需氨基酸不僅來源于食物,還可以通過自身合成,具有更高的多樣性,能表現出更獨特的信息特征。張旭峰在對刺參脂肪酸碳穩定同位素組成的地域性差異研究中發現,萊州、擔子島、牟平、瓦房店、皮口、長海島、獐子島、乳山、霞浦的刺參大部分脂肪酸的δ13C值表現出顯著性差異[62]。Liu Yu等[63]利用脂肪酸CSIA技術對中國沿海萊州、擔子島、牟平、乳山、瓦房店、皮口、長海島、獐子島和霞浦9 個地區A. japonicus樣品進行產地鑒別,除了長海島和獐子島地區外,其他地區的樣品都可以得到有效區分,乳山、瓦房店和皮口樣品的δ13C值較高,而擔子島、牟平和長海島樣品的值較低。Zhao Xinda等[64]通過氨基酸的CSIA技術成功地鑒別了福建、遼寧、山東3 個省8 個采樣點的野生A. japonicus,結果表明,通過氨基酸的δ13C值區分此8 種樣品的總準確率和交叉驗證率皆為100%,特別是δ13C Ser表現出顯著的區分能力。單一的穩定同位素技術在海參溯源中的難度越來越大,研究表明,多種溯源分析技術相結合對溯源準確率有顯著提高。
除了產地溯源外,生產方式溯源也同樣重要。周永亮[58]對不同環境下生長的刺參進行SIA,研究表明,同一采樣點成參δ13C值較人工養殖幼參高約2.5‰,δ15N值低約2.5‰,說明生長環境變化會帶來穩定同位素值的明顯改變。Zhao Xinda等[64]收集瓦房店、長島、煙臺三地野生和養殖仿刺參,根據氨基酸δ13C值在PCA中可以很好地將野生與養殖海參區分開來,特別是Gly的δ13C值對不同生長方式區分效果顯著。然而,大多數研究必須結合其他方法來分析在穩定同位素值無法區分的樣品。這些重疊可能是養殖飼料的相似、野生物種越境遷徙和人為污染造成。此外,季節性變化也會導致這些重疊的發生。由于穩定同位素組成受到飼料和環境條件等因素的影響,人為控制這些因素有可能調控同位素組成。雖然考慮到成本,這類欺詐不太可能發生,但僅使用SIA很難發現此類欺詐案件。因此,將SIA與其他溯源分析技術結合有助于區分具有相同同位素特征的樣品。
2.4 組學分析
2.4.1 脂質組學分析
脂肪酸可以根據飽和度的不同分為飽和脂肪酸、一價多不飽和脂肪酸和多價多不飽和脂肪酸,多價不飽和脂肪酸又可分為n-6系和n-3系[65]。脂質組學分析通常使用各種色譜或光譜學方法來確定樣品的脂肪酸組成[66]。雖然制備分析樣品所需時間較長,但它在產地來源和生產方式溯源方面顯示出很好的應用前景。在海參產地溯源分析中,脂質組學分析通常與SIA聯用[67]。
海參產地的不同會導致海參脂肪酸組成差異。Azad等[68]在馬來西亞沙巴海參中并沒有檢測到二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),其以飽和脂肪酸為主要脂肪酸,這與地中海海參中以多不飽和脂肪酸為主要脂肪酸具有明顯差異[69]。這可能由于馬來西亞沙巴地處赤道附近,氣候溫暖和常年的光照導致氧氣溶解度下降并且不利于去飽和酶基因表達,進而飽和脂肪酸成為主要脂肪酸[70]。劉瑀等[71]收集整理了不同緯度海參脂肪酸含量數據,總結歸納得出,海參EPA、DHA相對含量隨著緯度的降低而降低,C16:0和C18:0相對含量隨緯度降低而升高。Budge等[72]利用受飲食影響的脂肪酸分布來對28 種不同海產品進行產地溯源,發現物種內的差異不如物種間的差異大。
脂肪酸還適用于區分不同生產方式的海參。張旭峰[62]采集了萊州、擔子島、牟平、乳山、瓦房店、皮口、長海、獐子島和霞浦的刺參,研究發現霞浦地區刺參的C18:2n-6、C18:3n-3、C20:1n-9、C22:1n-9含量明顯高于其他地區,而C18:1n-9和C20:5n-3含量明顯低于其他地區,主要由于霞浦地區刺參的養殖方式為筏式養殖,飼料中添加了大量海帶,而底播養殖刺參食物來源主要以底棲硅藻為主;因此,底播刺參的C20:5n-3含量明顯高于筏式養殖。同時,不同季節刺參的脂肪酸組成也存在明顯差異,主要與刺參的主要食物來源與季節變化有關,來源為春季硅藻類、夏季綠藻類、秋季細菌、冬季褐藻類[73]。脂肪酸在生物新陳代謝中比較穩定,經過生物長期攝食累積后結構基本保持不變,食性差異會反映在海參的脂肪酸組成中[74]。
脂質組學分析也能夠與SIA一起用于區分海參的產地來源。Zhang Xufeng等[67]利用脂肪酸分析和碳、氮的SIA來區分中國北部海域7 個地點采集的仿刺參(Apostichopus japonicus)。利用δ13C和δ15N值可以有效區分5 個采集點的樣品,但長海島和擔子島結果部分重疊,可能是因為這兩地域海參有相似的食物來源。然而,δ13C與C14:1n-5結合可作為區分擔子島和長海島海參的指標。通過脂肪酸成分含量差異結合SIA,利用PCA能夠有效區分這7 個地點的仿刺參。不同海域生物的脂肪酸組成與鹽度直接相關。在高鹽度下,多不飽和脂肪酸含量增加,飽和脂肪酸含量減少,主要是為了維持細胞膜的雙層結構和提高細胞的遷移率[75]。Liu Yu等[63]建立了一種新的脂肪酸CSIA方法,結合PCA和判別分析對中國沿海9 個地區仿刺參產地進行溯源,結果表明:除瓦房店和皮口,春季刺參脂肪含量明顯高于秋季刺參,其中對A. japonicus產地起源鑒定貢獻最大的脂肪酸為C22:6n-3、C16:1n-7、C20:5n-3、C18:0和C23:1n-9。
脂質組學分析不僅可以區分海參產地來源,而且有助于生產方式溯源[75-76]。然而,海參脂肪酸組成的季節性變化需要進一步研究,以避免得到的產地來源和生產方式之間可能存在的重疊,并且海參的脂肪酸成分可能會通過控制飲食進行調控。此外,為了確定未知樣品的實際來源,需要一個包含不同海參物種脂肪酸分布的數據庫。一旦這些問題得到解決,脂質組學分析就可以在海參溯源分析中發揮重要作用。
2.4.2 蛋白質組學分析
蛋白質是海參的主要組成成分,蛋白質的差異可以指示海參相關特性,利用蛋白質技術可以鑒定并篩選有關蛋白作為生物標記物,建立海參的溯源分析技術。傳統的蛋白質檢測分析技術有酶聯免疫分析、電泳法和色譜分析法等。然而,這些檢測技術都存在一定的缺點,酶聯免疫法對于親緣關系較近的物種易產生假陽性結果,單克隆抗體雖然能顯著提高檢測特異性,但其檢測成本高、操作繁瑣,目前尚無商品化的水產品溯源酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)試劑盒面世[77]。蛋白質電泳法不適用于深加工樣品的分析。色譜分析法也存在操作復雜、定性能力較弱、不適合分離疏水性蛋白等問題。基因組計劃加快了質譜技術作為鑒定和探查蛋白質技術的趨勢,基于質譜的蛋白質組學作為后基因時代的組學分析核心為食品真實性溯源分析提供了新的技術思路[78],并已在水產品[79]、肉類[80-81]、乳制品[82]等食品的溯源分析中獲得了實際應用。常見的蛋白質定量技術包括同位素標記相對和絕對定量技術(isobaric tags for relative and absolute quantification,iTRAQ)、細胞培養氨基酸穩定同位素標記(stable isotope labeling with amino acid in cell culture,SILAC)、串聯質譜標記(tandem mass tag,TMT)、非標記技術[83]。非標記定量技術有數據依賴性采集(data-dependent acquisition,DDA)和數據非依賴性采集(data-independent acquisition,DIA)兩種方式,其中DIA的連續窗口所有理論碎片離子采集技術(sequential window acquisition of all the theoretical fragment ion,SWATH)是近年來被廣泛應用的技術[84]。Piovesana等[85]分別采用二甲基標記及非標記鳥槍法蛋白質組學方法表征養殖和野生的金頭鯛(Sparus aurata)的肌肉組織,結果表明二甲基標記的結果與非標記結果一致,但使用非標記方法可以獲得更全面的蛋白質鑒定結果、更好地分析重現性和樣品通量,且費用低廉。Zhang Hongwei等[86]基于SWATH-MS技術的蛋白質組學,檢測分析了中國霞浦、膠南、威海、煙臺和大連5 個不同產地來源的干制商品海參,17 種蛋白質被鑒定為可進行產地溯源的生物標記物組,在驗證測試和實際樣品分析中達到了100%的預測準確性。
基于質譜技術的蛋白質組學具有高穩定性、高靈敏度以及高通量的特點,有著其他分析方法沒有的優勢,例如可以獲得足夠的反映食品真實性特質的分子信息,且可以進行數據采集后的回溯分析,對加工貯藏過程中的特征標記肽段、氨基酸序列的修飾進行監控,利用熱穩定蛋白對標記物進行篩選等[87]。與DNA分子相比,蛋白的一級結構或多肽序列在某些加工中具有更好的分析穩定性,但其在食品溯源分析研究中仍存在某些制約因素。首先是蛋白質提取及富集方法的標準化,用以解決豐度低的標記蛋白及復雜基質蛋白質提取困難的問題;其次,由于海參存在自溶現象以及加工造成蛋白質溶解度降低,將依賴高分辨質譜技術先期進行深度的數據挖掘。最后,生物信息學工具的豐富和組學數據庫改進完善還有需要提升的空間,這兩者是進行蛋白質組學有效分析的關鍵。但未來隨著更多生物基因組測序的完成,蛋白質數據將進一步得到完善,加之數據挖掘工具的進一步改進,將為在更深更廣的范圍內闡述蛋白質組學數據提供強有力的支持。
2.4.3 糖組學分析
糖類成分在生物體中主要以復合糖的形式存在,包括糖蛋白、蛋白聚糖和糖脂。同時,糖組學研究也分為聚糖組和糖鏈組[88]。海參體壁主要有兩類活性多糖,一類是海參硫酸軟骨素(sea cucumber chondroitin sulfate,SC-CHS),由D-N-乙酰氨基半乳糖、D-葡萄糖醛酸和L-巖藻糖組成;另一類是海參巖藻聚糖硫酸酯(sea cucumber fucoidan,SC-FUC),由L-巖藻糖構成。海參多糖之間存在的硫酸化程度、相對分子質量、微觀結構以及殘基數量的差異決定了其結構分析的復雜性[89]。陳士國等[90]采用高溫氫核磁共振(1H-nuclear magnetic resonance,1H-NMR)技術分析了阿拉斯加刺參、海地瓜、墨西哥刺參、冰島刺參、日本刺參、明禿參、北極海參和八刺參8 種海參的SC-CHS,通過比較SC-CHS中硫酸酯化巖藻糖支鏈上的異頭氫信號確定硫酸基的取代類型,結果表明SC-CHS的指紋圖譜可作為海參物種的溯源工具。Wu Nian等[91]利用傅里葉變換紅外光譜分析儀和高溫1H-NMR技術測定印度太平洋的Pearsonothuria graeffei、挪威海岸的Holothuria vagabunda、西印度洋的Stichopus tremulu和西大西洋的Isostichopus badionotu4 種海參的SC-FUC化學性質,根據SC-FUC異頭氫信號可建立不同海域海參的指紋圖譜。
糖組學分析可以從生物小分子的角度更全面地發現用于食品溯源分析的分子標識物,為后續的營養功能與調控機制的研究積累基礎數據。相比于蛋白質組學和脂質組學的分析,糖組學分析更具有挑戰性。由單糖組成的寡糖和多糖結構十分復雜,需要專門的生物信息學軟件來分析復雜的糖基化位點和聚糖成分的質譜圖,并且糖類較高的極性也對樣品分離提出了較高的要求[92]。但隨著超高分辨質譜在糖組學分析領域的應用及數據庫與分析軟件的不斷完善,糖組學的研究也將更廣泛地應用于食品溯源分析領域。
2.5 常見海參溯源分析技術的比較
表3對6 種分析技術在海參溯源應用中的優勢和劣勢進行了對比,可以發現,在目前已有的報道中,沒有一種檢測技術可以獨立完成物種、產地和生產方式3 個方面的溯源分析。根據溯源目的以及適用條件可選擇最佳的檢測方法,并且多種技術聯合分析的手段將成為溯源檢測的發展趨勢。

表3 海參不同溯源分析技術的優勢和局限性Table 3 Advantages and limitations of different analytical techniques for the traceability of sea cucumber
2.6 溯源分析技術展望
目前還有一些技術開始在海產品的溯源分析中得到應用,這將為海參溯源分析技術的發展提供參考。Itrax X射線熒光光譜法(X ray fluorescence,XRF)是一種可以提供元素組成的方法,常用于沉積物巖芯掃描[93]。這種技術雖然只能輸出半定量分析的結果,但具有快速、無損、高精度的優勢,并且可以檢測到多達31 種不同元素的存在[94]。Gadd等[95]在2018年將該技術的應用拓展到了軟生物組織樣品,并認為基于Itrax的XRF技術有可能成為食品質量或安全性方面的有效工具。已有報道將Itrax XRF技術和SIA結合進行了有效的黑虎蝦生產方式和產地溯源分析[96]。基于該技術的方法還用于建立亞洲鱸魚(Lates calcarifer)的種源模型,研究表明組合模型中沒有錯誤預測的樣本[97]。這些研究結果表明,雖然可能無法提供元素的量化值,但基于Itrax的XRF通過分析樣品的元素組成對樣品進行溯源是可行的。目前,由于尚不清楚是否會因被掃描的組織類型不同而對結果產生影響,該方法在海參和海參不同組織部位的溯源分析應用方面還需要進一步探究。
3 結 語
目前對于海參物種、產地來源和生產方式3 個方面的溯源分析,上述不同的技術都有其各自的優勢。市面上海參深加工產品的不斷推出,加之海參養殖模式的演變導致養殖海域及方式的不定,都將給海參溯源分析帶來新的挑戰。與單一方法相比,使用多種溯源分析技術組合具有更高的辨識精度。同時,還需進一步完善相應的海參溯源分析數據庫,探究最佳的化學計量學統計方法,建立不同物種、不同產地、不同生產方式海參的溯源分析判別模型。
海參溯源分析對發現和預防食品欺詐有著重大意義,未來的發展趨勢主要包括如下3 個方面:1)深加工產品以及混合樣品的定性定量檢測;2)快速的現場溯源分析技術;3)構建無損的溯源分析技術體系。隨著大數據時代的到來,基因組學、代謝組學、蛋白質組學、脂質組學和糖組學等組學技術的發展為海參溯源分析技術的進一步發展提供了新的機遇。基于多組學分析手段、交叉生物信息學和化學計量學的食品組學分析技術將成為未來海參溯源分析的發展趨勢。

