食品環境中單核細胞增生李斯特菌菌膜形成、轉移及防控措施研究進展
孫琳珺,張紅芝,方太松,王 園,3,劉陽泰,王 翔,李紅梅,李代禧,董慶利,*
(1.上海理工大學醫療器械與食品學院,上海 200093;2.上海市疾病預防控制中心,上海 200336;3.上海中僑職業技術大學,上海 201514)
單核細胞增生李斯特氏菌(Listeria monocytogenes)是一種革蘭氏陽性桿菌,常見于生鮮或加工食品、家養或野生動物中,它能夠引起李斯特菌病,導致幼兒、老年人以及易感人群患敗血癥、腦膜炎等疾病以及孕婦流產[1]。歐洲食品安全局和歐洲疾病預防控制中心報道了歐洲2018年由單核細胞增生李斯特菌引起的食源性疾病2 549 例,其中死亡病例229 例[2]。美國疾病預防控制中心在2019年報道了24 例李斯特菌病例,其中22 例住院病例,2 例死亡病例[3]。2013—2017年,中國也報道了211 例李斯特菌病病例,致死率達26.1%[4]。因此,單核細胞增生李斯特菌對食品環境的污染值得加強關注。
單核細胞增生李斯特菌能夠在極端環境如低溫、高鹽和低pH值條件下存活,其菌膜形成可能是其耐受極端環境的原因之一[5-6]。菌膜是鑲嵌在自身產生且能夠黏附于生物或非生物表面的胞外物質中相同或不同屬的微生物群落[7]。在食品環境中,細菌可以在傳送帶、切割物表面、管道、墻壁等食品接觸表面形成菌膜[5],相比于游離細胞,菌膜對消毒劑具有更好的抗性,并且能夠在不同條件的極端環境下適應和生存[8],甚至可以提高單核細胞增生李斯特菌的毒性。單核細胞增生李斯特菌菌膜形成后就難以完全去除,從而成為交叉污染的傳播中心,并成為食品安全隱患,進而導致食源性疾病暴發以及經濟損失[9]。當前關于單核細胞增生李斯特菌菌膜的研究主要分為兩個方向:1)關注單核細胞增生李斯特菌菌膜在不同條件下的形成及轉移情況;2)針對單核細胞增生李斯特菌菌膜的預防及控制措施研究。
本文首先總結了食品環境中單核細胞增生李斯特菌菌膜形成能力的研究,其次綜述了單核細胞增生李斯特菌菌膜形成和轉移影響因素的研究進展,最后著重對單核細胞增生李斯特菌菌膜從預防和控制兩個方面進行較為全面的概述,以期為研究單核細胞增生李斯特菌在食品環境中的菌膜污染因素及途徑提供參考,同時也為食源性致病菌的風險評估提供理論依據。
1 食品環境中單核細胞增生李斯特菌菌膜形成能力
目前單核細胞增生李斯特菌菌膜的測定方式主要有微孔板結晶紫染色法以及菌膜菌量計數法兩種。結晶紫染色法是將培養一定時間后的菌膜通過結晶紫進行染色,進而測定菌膜的OD值并與對照組OD值進行比較來判斷菌膜形成能力的強弱。獲得的菌膜OD值將與陰性對照組OD值(ODc)的1、2、4 倍進行比較從而判定菌膜的形成能力[10-11]。結晶紫染色法可以在篩菌的過程中加清晰地了解到每株菌的菌膜形成能力,但是由于這一過程中一并測定了胞外物質的OD值并且結果相對不穩定,因此并不適用于觀察菌膜中細菌的生長與轉移過程。另外,隨著研究的深入,以OD值對菌膜形成能力強弱進行評判的標準也發生了一些改變。Osman等[12]將OD值為0.1和1作為菌膜形成能力弱、強和非常強的分界線。Stoller等[13]則使用一株菌膜形成能力強的菌株與一株菌膜形成能力弱的菌株作為對照組,將其OD值與其余菌株的菌膜OD值進行比較,進而判斷菌膜形成能力的強弱。因此就結晶紫染色法而言,菌膜形成能力的強弱判定標準需一致。
菌膜菌量計數法是將菌膜通過拍打或者漩渦的方式將菌膜脫落,進而測定菌膜中所含的菌量,通過菌膜中菌量來判定菌膜形成能力。Piercey等[14]發現在肉品工廠與海鮮工廠中采樣的單核細胞增生李斯特菌菌膜量都大于7(lg(CFU/cm2))。另外,標準菌株經常作為參考菌株來判定其他菌株的形成能力[15-17]。菌膜菌量計數法能夠較為直觀地看出菌膜中的菌量,從而可以更好地判斷在形成以及轉移過程中細菌數量的變化。然而,目前標準菌株的選擇并沒有一個統一的參考,因此,菌膜菌量法只能比較菌膜菌量的高低,但是對于菌膜的形成能力強弱無法確定。
近5 年來,食品生產中養殖、屠宰、加工以及零售等階段的單核細胞增生李斯特菌菌膜形成能力如表1所示。單核細胞增生李斯特菌具有良好的菌膜形成能力且不同菌株的菌膜形成能力有所差異,因此,更多具有代表性的單核細胞增生李斯特菌菌株需要進行進一步的研究,從而更加深入了解單核細胞增生李斯特菌的菌膜形成過程。其次,對于單核細胞增生李斯特菌菌膜的判斷標準也各有不同,并且不同測定方法獲得的數據也不具有可比性。此外,就1 種單核細胞增生李斯特菌菌膜測定方法來說,不同研究對菌膜的強弱判斷標準也有所不同。以上兩個問題導致數據之間缺乏可比性,從而對單核細胞增生李斯特菌菌膜形成強弱的判斷缺乏依據。所以,統一菌膜強弱評判標準以及建立菌膜測定方法之間的聯系是目前亟待解決的問題。
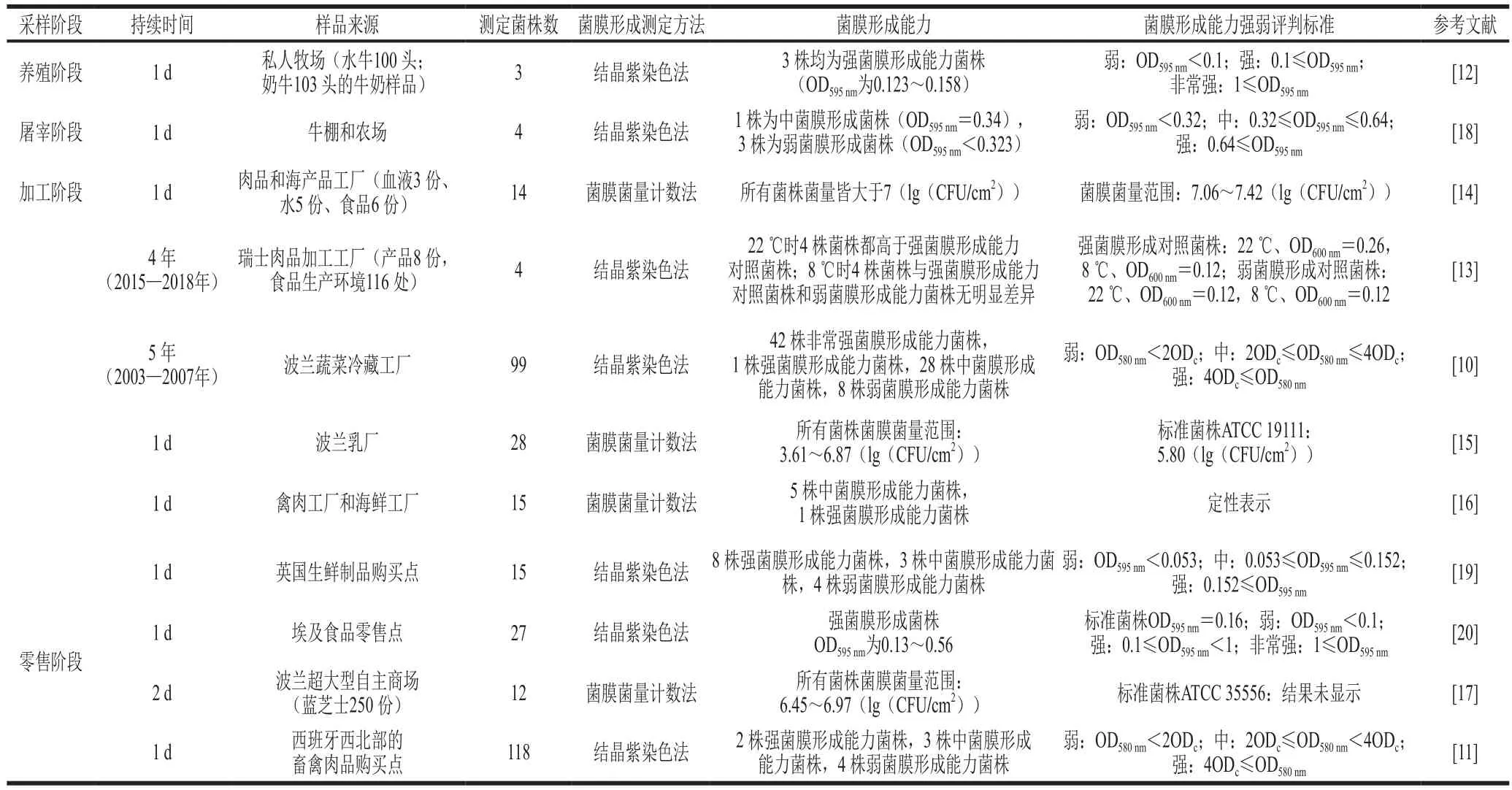
表1 食品環境中不同階段檢出的單核細胞增生李斯特菌形成能力Table 1 Biofilm formation ability of L. monocytogenes in food environment at the stages of farming, slaughter, processing and retail
2 單核細胞增生李斯特菌菌膜形成與轉移影響因素
2.1 單核細胞增生李斯特菌菌膜形成影響因素
2.1.1 內部形成影響因素
單核細胞增生李斯特菌菌膜形成受多種內部因素的影響。首先,菌株表面特性例如疏水性、黏液產生能力以及自聚能力等對菌膜形成可能產生影響,Choi等[21]在研究中發現菌膜形成與自聚能力無關聯,而與細菌的黏液產生能力以及疏水性呈正相關。然而,也有研究發現菌膜形成與細胞表面疏水性并無顯著性關聯[22]。
其次,不同采樣來源的單核細胞增生李斯特菌形成菌膜的能力也有所差異。Rodríguez-Campos等[23]發現分別取樣自不銹鋼材質以及聚苯乙烯材質上的單核細胞增生李斯特菌在原材質上的菌膜形成能力更強。同時,其還探討了采樣后單核細胞增生李斯特菌的持續性或偶發性對菌膜形成的影響。有研究發現單核細胞增生李斯特菌菌膜形成與菌株的偶發性或持續性均無關聯[24-25]。然而,Nowak等[24]通過對比采樣自禽類加工工廠中的持續性和偶發性單核細胞增生李斯特菌發現,持續性菌株的菌膜形成能力高于偶發性菌株。
除此之外,單核細胞增生李斯特菌中的胞外核糖核酸和質粒對菌膜的形成也具有顯著影響。Zetzmann等[26]對脫氧核糖核酸酶敏感或抵抗單核細胞增生李斯特菌的胞外核糖核酸進行研究,結果證實了胞外核糖核酸在低滲透活性物質濃度的介質中對單核細胞增生李斯特菌菌膜形成具有重要作用。pLMSZ08質粒也被發現對單核細胞增生李斯特菌菌膜的形成產生顯著影響,實驗發現,質粒的缺失對細菌黏附前期并無顯著影響,然而在30 ℃下培養48 h后的正常菌株有能力形成更加致密的菌膜[27]。
最后,大量研究表明基因的調控與單核細胞增生李斯特菌菌膜的形成也具有顯著聯系。當一些毒力基因或者脅迫基因(表2)缺失后,單核細胞增生李斯特菌的初步黏附以及菌膜形成量呈現下降趨勢并在極端環境下的存活能力降低。

表2 影響單核細胞增生李斯特菌菌膜形成的基因Table 2 Genes related to biofilm formation of Listeria monocytogenes
單核細胞增生李斯特菌自身特性對菌膜的形成具有影響,每株菌的特性不同導致了菌膜形成的變異性,因此內部影響因素導致單核細胞增生李斯特菌菌膜形成的不同需要更多具有代表性菌株去驗證。此外,許多內部形成因素對菌膜形成的機理并未了解清楚,需要進一步的基礎研究。
2.1.2 外部形成影響因素
溫度和培養成分是研究最多的兩個外邊形成因素。當溫度上升時,通常會促進單核細胞增生李斯特菌菌膜的形成[39-41]。然而,Zetzmann等[42]發現在稀釋的培養基中,較37 ℃下培養,25 ℃下培養的單核細胞增生李斯特菌菌膜形成量更多。Nowak等[39]也發現了這一現象,分析可能原因為過少的營養雖然使大部分細菌處于初步黏附狀態無法形成菌膜[43],但也迫使單核細胞增生李斯特菌在適宜的溫度下形成菌膜從而對抗極端環境。
綜上,單核細胞增生李斯特菌菌膜的形成與培養環境中的營養成分也有重要的聯系。在普通培養基中,胰酪大豆胨液體培養基和營養肉湯中形成的單核細胞增生李斯特菌菌膜具有顯著性差異[44];在實際食品培養介質中,豬肉汁、牛肉汁與雞肉汁中的單核細胞增生李斯特菌菌膜形成量也有所不同,其中在豬肉汁中的形成量最多[45]。除此之外,碳源的研究也是重要的考量指標之一。Ibusquiza[40]、Kyoui[46]等發現僅加入葡萄糖的培養基中單核細胞增生李斯特菌菌膜形成量顯著下降,而其余培養基中菌膜形成量并無顯著差異,然而葡萄糖能夠促進菌膜胞外物質的產生。另外,乳糖的加入使對抗逆境條件的sigB基因上調[47],從而使單核細胞增生李斯特菌形成更多菌膜,因此乳糖的利用會觸發強烈的SigB因子依賴性應激反應,這可能對食品接觸表面單核細胞增生李斯特菌菌膜形成有益。同樣的,殼寡糖在研究中也顯示出具有相同的促進效果[48]。
另外,菌膜的濕度、培養時間和黏附材質也影響了單核細胞增生李斯特菌菌膜的形成量。Piercey等[14]發現在濕度較低的環境中單核細胞增生李斯特菌菌膜量隨時間的延長而降低。Ripolles-Avila等[49]將單核細胞增生李斯特菌培養24、48、72 h后的菌膜量進行對比,發現48 h是最適宜的培養時間。有研究表明,當粗糙度越大時,單核細胞增生李斯特菌菌膜越容易形成[50]。另外,在不同材質上單核細胞增生李斯特菌菌膜的黏附也具有顯著性差異[51]。
在復雜的微生物環境中,兩菌和多菌之間的相互作用也影響了單核細胞增生李斯特菌菌膜的形成,當單核細胞增生李斯特菌與其他菌株混合培養時,其菌膜形成量將低于單菌培養時菌膜形成量。例如植物乳桿菌的增加會導致環境pH值下降,從而使單核細胞增生李斯特菌在酸環境中被殺滅[8],或者如枯草芽孢桿菌可以改變單核細胞增生李斯特菌菌膜的形態從而降低其酶活性、黏附能力、毒力、溶血活性以及細胞運動,最后導致單核細胞增生李斯特菌菌膜的減少[52]。另外,當兩菌生長過程中存在競爭關系時,優勢菌群例如假單胞菌屬[53-55]等在生長的過程中使單核細胞增生李斯特菌的生長緩慢,從而在兩菌菌膜中促進優勢菌群的菌膜形成,而單核細胞增生李斯特菌菌膜的形成沒有變化。兩菌或多菌對單核細胞增生李斯特菌菌膜形成的影響(表3)說明外部形成因素往往可以激發單核細胞增生李斯特菌內部形成因素的改變,從而使單核細胞增生李斯特菌菌膜的形成發生改變,因此,了解外部形成因素與內部形成因素的關系能夠更好地了解菌膜形成的機理。

表3 兩菌或多菌對單核細胞增生李斯特菌菌膜形成的影響Table 3 Effect of dual- or multi-species on Listeria monocytogenes biofilm formation
2.2 單核細胞增生李斯特菌菌膜轉移影響因素
單核細胞增生李斯特菌菌膜一旦形成,就難以徹底去除,繼而會導致交叉污染,擴大了單核細胞增生李斯特菌的傳播與污染范圍。目前關于單核細胞增生李斯特菌菌膜轉移的研究主要是模擬不同食品環境因素對菌膜轉移的影響以及對比有無菌膜下單核細胞增生李斯特菌的轉移情況以及消殺狀態下單核細胞增生李斯特菌菌膜的轉移,通過建立模型,可以更直觀地了解在食品環境中單核細胞增生李斯特菌菌膜的轉移情況(圖1)。

圖1 單核細胞增生李斯特菌菌膜轉移圖解Fig 1 Schematic representation of the transfer of Listeria monocytogenes biofilm
不同環境因素可以影響單核細胞增生李斯特菌菌膜的轉移效果。Midelet等[57]模擬了7 種因素對單核細胞增生李斯特菌單菌或混菌菌膜在胰蛋白胨大豆瓊脂上的黏附和連續轉移的影響,并且運用Veulemans公式和3 種雙相以及單相脫落動力學進行黏附強度和轉移能力的測定以及斜率。
單核細胞增生李斯特菌是否形成菌膜對其轉移能力也有一定的影響。Hansen等[58]模擬了三文魚生產環境中單核細胞增生李斯特菌在形成或未形成菌膜情況下的轉移,并通過轉移效率來衡量菌膜中細菌的轉移程度。結果發現在不同極端環境下,菌膜對細菌具有保護作用,且對食品加工過程中交叉污染具有潛在風險。另外,研究發現無菌膜情況下的細菌轉移能力要高于有菌膜下的轉移能力,但是菌膜的存在大大提高了二次污染的概率。在食品環境中,消毒殺菌會導致單核細胞增生李斯特菌及其菌膜被殺滅,從而導致菌膜的轉移。Keskinen等[59]對比了有無冷應激與消毒處理情況后單核細胞增生李斯特菌混菌菌膜的損傷與在肉制品中的轉移情況。結果表明,冷應激對單核細胞增生李斯特菌菌膜存活與轉移有一定影響,而消毒情況則隨食品成分、菌膜形成時間的不同有所差異。Pang Xinyi等[54]模擬了不同成膜順序下單核細胞增生李斯特菌和熒光假單胞菌兩菌菌膜在三文魚工廠中的消毒殺菌效果對菌膜轉移的效果。結果發現熒光假單胞菌先于單核細胞增生李斯特菌形成菌膜,對干燥環境和消毒劑處理的抗性更好。
以上諸多研究表明在不同的加工環境因素下,單核細胞增生李斯特菌的菌膜形成能力都有所不同。其次,食品接觸表面形成的菌膜會保護細菌免受極端環境和消毒劑的殺滅,從而提高交叉污染和二次污染的風險。然而,當前模擬實際情況中菌膜的轉移情況研究較少,這就意味著當前的菌膜轉移研究并不能更好地貼合工廠實際情況進行菌膜轉移的模型建立。因此,模擬真實食品介質以及復雜微生物環境下單核細胞增生李斯特菌菌膜的轉移研究值得進一步深入推進。
3 單核細胞增生李斯特菌菌膜防控措施
單核細胞增生李斯特菌菌膜的形成與轉移會導致污染的傳播,影響食品安全,同時也使食品企業受到巨大損失,因此針對于單核細胞增生李斯特菌菌膜的防控措施研究也是當下研究熱點。單核細胞增生李斯特菌菌膜的防控措施可分為物理、化學、生物措施或者聯合處理措施。
3.1 物理措施
近年來,物理控制措施不斷改進,最初研究發現通過在設備表面鍍銅納米粒子膜層可以明顯對單核細胞增生李斯特菌與銅綠假單胞菌單菌的初期黏附具有顯著抑制效果[60]。隨著研究的深入,目前物理措施主要分為兩種,一種是光動力滅菌技術,另一種則是冷大氣等離子體滅菌技術。李紅愛等[61]將質量濃度10 μg/mL亞甲基藍作為光敏劑,通過光動力滅菌技術,經200 mW/cm2的可見光照射30 min后單核細胞增生李斯特菌菌膜的失活率可達99.99%以上。姜黃素作為介導光動力學的滅活物質也被發現能夠改變單核細胞增生李斯特菌菌膜的形態以及黏附能力,因此可以有效消除單核細胞增生李斯特菌菌膜[62]。相比于光動力滅菌技術來說,冷大氣等離子體的研究更為廣泛。Kim等[63]應用大氣等離子體噴射裝置對3 種不同材質儲藏一段時間后形成的單核細胞增生李斯特菌菌膜進行3 種時間的處理。結果發現10 min處理后,單核細胞增生李斯特菌菌膜在任一材質上的菌量都減少3~4(lg(CFU/cm2))。
此后冷大氣等離子體被進一步應用于單核細胞增生李斯特菌與其他菌株的混合菌膜處理中。Govaert等[64]對不同培養介質、培養溫度、初始接菌量比例以及培養時間下的單核細胞增生李斯特菌與沙門氏菌兩菌菌膜進行冷大氣等離子體處理并分析不同處理時間后的結果。隨后,該團隊進一步研究了冷大氣等離子體在不同放電方式、氧氣水平及輸入電壓下對單核細胞增生李斯特菌和鼠傷寒沙門氏菌菌膜的滅活作用[65]。最后,他們嘗試運用大氣等離子體預冷液處理單核細胞增生李斯特菌菌膜,結果表明該方法也具有很好的處理效能[66]。冷大氣等離子體對單核細胞增生李斯特菌及與熒光假單胞菌形成的菌膜也被證明具有較好的去除效果[67]。
以上物理防控措施能夠較好地去除單核細胞增生李斯特菌菌膜,然而目前的研究較少,并且在食品加工工廠中的可操作性較差。另外,物理控制措施的機器成本也較高,并不能完全適應商業化生產,還需要進一步優化與改進。
3.2 化學措施
食品工廠消毒殺菌劑如季銨鹽消毒劑、氯溶液、次氯酸溶液、過氧乙酸等常用于工廠設備表面的化學消毒殺菌劑[68]。Poimenidou等[22]研究了商業殺菌劑的最小抑菌濃度以及去除菌膜濃度并且觀察各株單核細胞增生李斯特菌在72 h后菌膜對殺菌劑的抗性后發現單核細胞增生李斯特菌菌膜形成能力與最小抑菌濃度呈正相關,而菌膜形成能力越好,對殺菌劑的抗性也越大。
另外,其他具有殺菌消毒效果的化學試劑例如乙酸[69]、乳酸、次氯酸鈉以及乙酰丙酸加硫酸鈉混合殺菌劑[70]等對單核細胞增生李斯特菌混菌的殺菌效果也受到關注和研究。Lee等[69]運用乙酸對單核細胞增生李斯特菌在兩種不同材質表面形成的菌膜進行不同時間處理的失活研究。結果發現處理60 s后菌膜菌量幾乎全部失活,而到180 s時細胞全部破壞。Chen Dong等[71]發現2%乳酸鈉加3%乳酸對單核細胞增生李斯特菌菌膜滅活效力最好。Liu Fang等[70]對比了3-苯基乳酸、乳酸以及乙酰丙酸-硫酸鈉在不同濃度以及不同處理時間下對單核細胞增生李斯特菌菌膜的滅活作用。結果表明,3-苯基乳酸對單核細胞增生李斯特菌菌膜甚至成熟菌膜都具有良好的滅活作用。然而,此研究中所有方法都不能完全去除單核細胞增生李斯特菌菌膜。
化學防控措施是目前食品加工工廠中常用的消毒殺菌方法,雖然能夠去除較多的菌膜,但是本身具有一定毒性,這無疑對消費者的安全具有一定風險隱患。另外,單核細胞增生李斯特菌對化學消毒殺菌劑具有一定抗性和敏感性[72-73],因此并不能完全去除單核細胞增生李斯特菌菌膜。
3.3 生物措施
如表4所示,在當前研究中,生物控制措施主要分為植物精油及其提取物、噬菌體、乳桿菌及其細菌素以及抑菌肽等。大量研究表明植物精油及其提取物對單核細胞增生李斯特菌菌膜具有有效抑制效果。植物精油及其提取物能夠抑制單核細胞增生李斯特菌的生長,并且改變單核細胞增生李斯特菌菌膜的形狀。

表4 單核細胞增生李斯特菌菌膜生物防控措施Table 4 Biocontrol measures of Listeria monocytogenes biofilm
除了植物精油及其提取物,噬菌體、乳桿菌及其細菌素以及抑菌肽也受到關注和研究。噬菌體可以侵襲細菌從而抑制細菌生長,同樣地,產細菌素的菌株也可以抑制單核細胞增生李斯特菌生長并且破壞其菌膜的形狀,關于抑菌肽通過抑制細菌生長而減少單核細胞增生李斯特菌菌膜的研究也在逐步進行中。
生物控制措施作為較為安全且環保的方法逐漸引起研究者關注,然而生物防控措施對細菌控制的普適性以及精油的揮發氣味及效力、劑量與成本都有待評判。另外,關于抑菌肽和噬菌體的研究較少,需要進一步研究對其抑菌效果以及對食品安全進行評估。
3.4 聯合處理控制措施
冷大氣等離子體、化學消毒劑以及植物精油都被作為聯合處理措施之一進行更好的菌膜去除。冷大氣等離子體可以結合其他化學或者生物控制措施從而提高其殺菌效果。Govaert等[97]發現對單核細胞增生李斯特菌菌膜進行冷大氣等離子體處理后加入過氧化氫可以更好地去除菌膜。而經過等離子體處理后的包裝,加入細菌素衍生肽1018K6后可以有效減少單核細胞增生李斯特菌菌膜在工廠中形成的風險[98]。
化學消毒劑也常與其他措施混用從而達到更好的殺菌效果。Ban等[99]將4 種消毒殺菌劑(次氯酸鈉、過氧化氫、碘化物以及氯化苯)與蒸汽加熱方式結合具有協同增效作用,其中蒸汽加熱20 s后使用質量濃度20 mg/L碘化物消毒30 s可使測定菌量低于可檢測范圍。Rodríguez-López等[100]將鏈霉蛋白酶與氯化苯聯合可以更有效去除大腸桿菌和單核細胞增生李斯特菌兩菌晚期菌膜。乙二胺四乙酸與乳酸菌細菌素結合也具有協同增效的作用,然而兩者結合也并不能完全去除單核細胞增生李斯特菌菌膜[101]。
在聯合處理控制措施中,植物精油常作為其中的措施之一。Smith等[102]將乳酸鏈球菌素(Nisin)或Nisin衍生物M21A與兩種食品級添加劑(檸檬酸與肉桂醛)混合,結果發現M21A的效果更佳。檸檬醛精油配合納米乳液[103]的組合也可以有效抑制菌膜,其抑制率為83.51%。Vitanza等[104]發現冬季香薄荷精油和慶大霉素結合可以有效減少單核細胞增生李斯特菌形成并改變其菌膜形狀。然而,Tajik等[105]結合扎塔利亞多花波斯精油和紫外線照射模擬工廠環境下共同作用時卻發現,共同作用情況下單核細胞增生李斯特菌菌膜去除能力更弱,這可能是由于精油本身的強抗氧化性以及具有吸收紫外線的物質削弱了紫外線對單核細胞增生李斯特菌的殺滅,因此不建議將兩者混合使用。
除此之外,兩種生物措施的聯合處理也具有更好的抑菌膜效果。Pu Chuanfen等[106]研究了不同溫度下不同濃度的抗菌肽-幾丁質膏體組合對單核細胞增生李斯特菌在冷凍雞肉凍融水中的抑制菌膜效果較好。表面活性劑與鼠李糖脂組成的生物表面活性劑也對單核細胞增生李斯特菌菌膜的形成具有抑制的效果[107]。
聯合處理的防控措施一定程度上可以有效去除單核細胞增生李斯特菌菌膜,然而并非所有聯合處理都具有增效作用。因此選擇合適的防控措施組合才能夠更好地去除單核細胞增生李斯特菌菌膜。
4 結 語
本文首先對近5 年食品環境中采樣獲得的單核細胞增生李斯特菌菌膜形成能力進行了總結,發現采樣獲得的所有單核細胞增生李斯特菌都能夠形成菌膜,然而其形成能力有所不同;其次,本文概述了單核細胞增生李斯特菌菌膜形成的內部因素和外部因素,并且發現兩者之間存在相互作用,同時也發現不同因素下單核細胞增生李斯特菌菌膜的轉移也各不相同;最后對單核細胞增生李斯特菌菌膜防控措施通過預防和控制兩個方面進行闡述,其中控制措施中包括物理控制措施、化學控制措施、生物控制措施以及聯合處理控制措施。
單核細胞增生李斯特菌作為食品中重要的食源性致病菌受到了廣泛的關注和研究,在食品加工、運輸、零售等環節中,單核細胞增生李斯特菌菌膜的存在無疑是降低交叉污染的一大挑戰。針對于目前的單核細胞增生李斯特菌菌膜研究展望如下:1)單核細胞增生李斯特菌各菌株之間的菌膜形成具有變異性,不同菌株形成菌膜的能力各有不同。因此,只研究單一的單核細胞增生李斯特菌菌株菌膜特性并不能完全概括整體單核細胞增生李斯特菌的菌膜形成規律。所以,在研究中增加單核細胞增生李斯特菌的菌株數量有利于更好地了解單核細胞增生李斯特菌在不同因素下的菌膜形成和轉移情況,由此給菌膜防控措施作理論參考;2)目前針對于單核細胞增生李斯特菌菌膜形成的測定方法各有不同,且彼此之間并無關聯,除此之外,菌膜強弱評判標準也并未有統一的定論,不同的菌膜測定方法得出的數據不具有可比性,因此需統一菌膜強弱的評判標準以及建立起菌膜形成測定方法之間的關聯;3)針對于單核細胞增生李斯特菌菌膜研究大多都處于實驗室模擬階段,然而,培養介質的不同往往影響單核細胞增生李斯特菌菌膜的形成量與結構特征。同時,在復雜的食品微生物環境中,單核細胞增生李斯特菌常與其他菌株共同存在,產生互相作用。因此模擬真實食品介質中單核細胞增生李斯特菌兩菌或多菌菌膜的形成與轉移更符合實際意義;4)目前關于單核細胞增生李斯特菌菌膜的防控措施目前已有較多研究,但是大多研究只能盡可能地抑制菌膜,能夠完全清除菌膜又易于操作的方法鮮見報道。研究出一種更便捷更有效的防控措施是當前急需進一步探究的內容;5)不同因素下單核細胞增生李斯特菌菌膜形成量的研究已經開展,但是菌膜形成的機理及相關影響因素對菌膜作用的機制等尚不明確,因此,基于其相關的機理和機制的研究,有助于提升后續菌膜防控的高效性。

