3D-CRT 聯合吉西他濱、奧沙利鉑治療晚期非小細胞肺癌患者的療效評價
趙孟陽 張寧
(1 河南省人民醫院腫瘤中心 鄭州450003;2 河南省人民醫院影像科 鄭州450003)
非小細胞肺癌(Non-small Cell Lung Cancer,NSCLC)是一種常見肺癌病理分型,在全部肺癌中占比80%~85%[1]。因NSCLC 早期無典型癥狀,故確診時病情通常已處于晚期。有數據顯示,確診時約40%患者已發生遠處轉移,而20%~30%患者處于局部晚期,故適合行手術治療者較少,約80%患者需接受化療或放療[2]。其中化療能有效殺滅癌細胞,控制病情,但極易出現毒副反應。而三維適形放療(3D-CRT)雖可顯著提升NSCLC 局控率,但難以有效預防癌細胞擴散和轉移,從而降低遠期療效。因此針對局部晚期NSCLC 患者,治療時需注意全身、局部并重。本研究選取我院NSCLC 患者,旨在探討3D-CRT 聯合奧沙利鉑(LOHP)、吉西他濱(GEM)的應用價值。現報道如下:
1 資料和方法
1.1 一般資料 隨機選取2018 年4 月~2020 年8月我院76 例NSCLC 患者,根據治療方案不同分為常規組和研究組,各38 例。常規組男32 例,女6 例;年齡 43~64 歲,平均(53.72±5.01)歲;病理類型:鱗癌 23 例,腺癌 15 例;TNM 分期:Ⅲa 期 28 例,Ⅲb期 10 例。研究組男 34 例,女 4 例;年齡 45~65 歲,平均(54.57±4.68)歲;病理類型:鱗癌 26 例,腺癌12 例;TNM 分期:Ⅲa 期 25 例,Ⅲb 期 13 例。兩組一般資料均衡可比(P>0.05)。
1.2 入組標準 納入標準:細胞學或病理學證實為NSCLC,符合《Ⅲ期非小細胞肺癌多學科診療專家共識(2019 版)》[3]中 NSCLC 診斷標準;TNM 分期Ⅲ期,MRI、B 超、CT 檢查提示無腦、腹腔、肝轉移。排除標準:伴有肺不張、肺炎、肺結核等;合并風濕性疾病、強直性脊柱炎、結締組織病;有免疫抑制劑長期服用史或對GEM、LOHP 嚴重不耐受。
1.3 治療方法
1.3.1 常規組 以注射用鹽酸吉西他濱(國藥準字H20163144)治療,第 1~3 天,130 mg/m2,靜脈滴注;注射用奧沙利鉑(國藥準字H20064296)治療,第1、8、15 天,300 mg/m2,靜脈滴注。一個周期為 21 d,持續治療4 個周期。
1.3.2 研究組 接受3D-CRT+GEM+LOHP 治療。GEM、LOHP 用法用量同常規組,3D-CRT:模擬定位病灶,增強掃描胸部,層厚5 mm,輸入圖像至三維治療計劃系統,顯示病灶靶區、重要器官,涵蓋原發肺部病灶及縱隔淋巴結同側肺門、引流區域;外放腫瘤體積6 mm 左右為腺癌邊界,鱗癌邊界外放8 mm左右,計劃靶區體積外擴8~15 mm,采用劑量體積直方圖對治療計劃進行優化,等劑量曲線(95%)覆蓋計劃靶區體積;通過6MV-X 線進行放射治療,5次/周,1 次/d,放射劑量2 Gy,1 個月后復查胸部CT,根據病灶變化情況縮減治療,注意保護脊髓,劑量60~70 Gy。持續治療3 個月。
1.4 觀察指標 (1)療效:完全緩解(CR)為病灶消失,持續時間>1 個月;部分緩解(PR)為病灶體積縮小>50%,無新病灶出現;穩定(SD)為病灶體積增加<25%,縮小≤50%,無新病灶出現;進展(PD)為病灶體積增加≥25%或出現新病灶。CR+PR=總有效。(2)腫瘤標志物含量:治療前后分別取3 ml 靜脈血,離心(3 500 r/min,10 min),分離血清,以全自動電化學發光免疫分析儀測定兩組血清糖類抗原19-9(CA19-9)、糖類抗原 125(CA125)、癌胚抗原(CEA)含量,試劑盒由上海酶聯生物公司提供。(3)不良反應:腹瀉、血小板減少、肌酐增高、轉氨酶升高。
1.5 統計學方法 采用SPSS22.0 統計學軟件處理數據,計量資料以()表示,行t檢驗,計數資料以%表示,行χ2檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 兩組療效比較 研究組總有效率為71.05%,高于常規組的47.37%,差異有統計學意義(P<0.05)。見表 1。
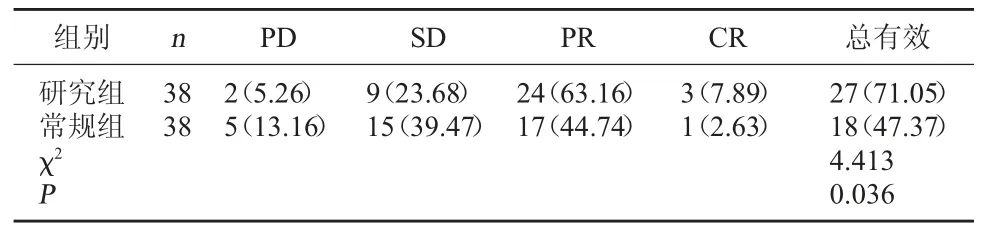
表1 兩組療效比較[例(%)]
2.2 兩組腫瘤標志物含量比較 治療前兩組血清CA19-9、CA125、CEA 水平對比無顯著差異 (P>0.05);治療后兩組血清 CA19-9、CA125、CEA 水平下降,且研究組更低(P<0.05)。見表2。
表2 兩組腫瘤標志物含量比較()
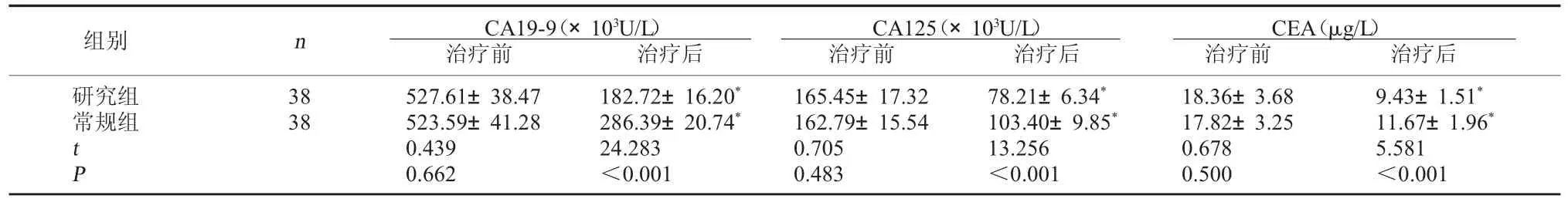
表2 兩組腫瘤標志物含量比較()
注:與本組治療前比較,*P<0.05。
CEA(μg/L)治療前 治療后研究組常規組組別 n CA19-9(×103U/L)治療前 治療后CA125(×103U/L)治療前 治療后38 38 tP 527.61±38.47 523.59±41.28 0.439 0.662 182.72±16.20*286.39±20.74*24.283<0.001 165.45±17.32 162.79±15.54 0.705 0.483 78.21±6.34*103.40±9.85*13.256<0.001 18.36±3.68 17.82±3.25 0.678 0.500 9.43±1.51*11.67±1.96*5.581<0.001
2.3 兩組不良反應發生情況比較 研究組不良反應發生率為13.16%,與常規組的7.89%比較,差異無統計學意義(P>0.05)。見表3。
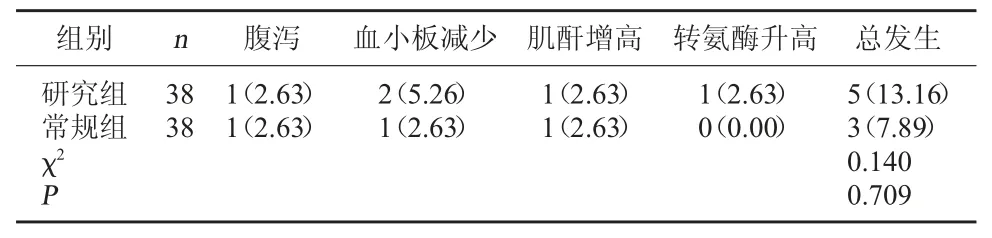
表3 兩組不良反應發生情況比較[例(%)]
3 討論
目前針對NSCLC 患者,臨床治療原則主要為延長生存周期,提升生存質量,常用治療方案有靶向治療、放療、化療。統計顯示,NSCLC 行單純放療5年生存率為3%~10%,而序貫放化療可提升2%左右[4]。故臨床日漸關注綜合性放化療方案。
本研究顯示,研究組總有效率為71.05%,高于常規組的47.37%,而不良反應發生率為13.16%與常規組的7.89%對比無明顯差異,提示3D-CRT 聯合LOHP、GEM 能明顯提升晚期NSCLC 近期療效,且不會增加毒副反應風險。吉西他濱是一種特異性抗癌藥,能阻斷細胞周期進展,促使細胞凋亡,從而起到抗癌效果。奧沙利鉑是非特異性細胞周期藥物,相較于順鉑,其結合DNA 速率可提高10 倍以上,能進一步抑制DNA 合成,達到高效細胞毒性效果,且無骨髓抑制、腎毒性,消化道反應輕,耐受性較差者亦可適用[5]。兩者雖藥物機制不同,但不會造成毒副反應疊加,故可為腫瘤治療奠定理論基礎。而3D-CRT 是一種基于多層CT 的放療技術,能精確定位、勾畫靶區,借助計算機技術可使靶區形狀與劑量分布保持一致,且其能提升靶區照射劑量,增強腫瘤局部控制效果;同時3D-CRT 經精確計算能降低正常組織照射劑量,減少食管、心臟等組織損傷[6]。因此 3D-CRT 聯合 LOHP、GEM 可明顯提高晚期NSCLC 患者近期療效,且能保障治療安全性。
腫瘤標志物在惡性腫瘤病情和預后評估中有重要作用,其中CA19-9 是一種腫瘤相關抗原,廣泛存在于膽道、胰腺等,其水平與惡性腫瘤病情、預后有明顯關聯性;CA125 是一種高分子糖蛋白,源自胚胎期體腔上皮,在肝癌、宮頸癌、卵巢癌等惡性腫瘤中水平會明顯升高,可用于評估腫瘤發生、病情進展;而CEA 源于胚胎期,惡性腫瘤中呈高表達,其血清水平與惡性腫瘤分期、患者近期死亡率有正相關關系。本研究結果發現,治療后研究組血清CA19-9、CA125、CEA 水平低于常規組,表明3D-CRT 聯合LOHP、GEM 能降低晚期NSCLC 患者腫瘤標志物含量,增強療效。綜上所述,晚期NSCLC 患者接受3D-CRT 聯合 LOHP、GEM 治療,可有效下調腫瘤標志物水平,提高近期效果,且安全性相對較高。

