駱駝奶對噁唑酮誘導的小鼠腸炎的作用
崔暢婉,孫崢嶸
(中國醫科大學附屬盛京醫院生物樣本庫,沈陽 110004)
炎癥性腸病包括克羅恩病和潰瘍性結腸炎,作為多種因素誘導的腸道疾病在世界范圍流行,其流行病學、病因學、遺傳學和表型被廣泛研究[1]。炎癥性腸病手術有關的并發癥如狹窄、瘺管和膿腫較為常見,因此探索預防和輔助治療機制勢在必行。有研究[2]證實,駱駝奶在某些疾病中可能具有治療作用,包括糖尿病、自閉癥、癌癥和酒精引起的中毒等,但駱駝奶的臨床療效和治療價值目前尚不十分清楚。先前的研究[3]表明,駱駝奶可能參與調節免疫細胞增殖、分化和細胞因子分泌,對維持機體內環境穩定具有重要作用。本研究采用噁唑酮(oxazolone,OXA)誘導的小鼠腸炎模型模擬人炎癥性腸病發病過程,通過灌胃方式給予駱駝奶,檢測腸黏膜免疫細胞和免疫因子的改變,探討駱駝奶對小鼠腸炎的作用機制。
1 材料與方法
1.1 實驗動物和試劑
SPF級BALB/c小鼠40只,由北京維通利華生物科技有限公司提供,18~20 g,5~6周齡,雄性,實驗動物使用經中國醫科大學實驗動物管理委員會批準。駱駝奶(新疆旺源有限公司),DMEM培養基、乙二胺四乙酸、膠原酶、DNA酶(美國Gibco公司),胎牛血清、離子霉素、佛波酯、蛋白轉運抑制劑布雷非德菌素A、OXA(美國Sigma公司),流式抗體CD4-異硫氰酸熒光素、CD3-紫草素葉綠素、γ干擾素(interferon γ,IFN-γ)-別藻藍蛋白、白細胞介素(interleukin,IL)-17-藻紅蛋白、CD25-別藻藍蛋白、ELISA試劑盒(美國R&D Systems公司)。
1.2 實驗方法
1.2.1 動物模型的建立:5~6周BALB/c小鼠40只,在特定的無病原體條件(溫度25 ℃,濕度60%~65%,12 h光照)下飼養和繁殖。在適應性喂養1周后的第1~2天戊巴比妥鈉(8 μL/g)注射給藥,待小鼠麻醉后,剃毛并暴露皮膚,涂擦3% OXA溶液(溶于100%乙醇,200 μL/只),并于第6天將l% OXA溶液(溶于50%乙醇,150 μL/只)經肛門給藥,通過直徑2.5 mm的硅膠細軟管插入距肛緣4 cm左右,注意避免用力過大造成腸壁損傷。經肛門給藥后,將小鼠保持倒立1 min,使藥物充分接觸腸壁,確保造模成功。將小鼠隨機分為實驗組和對照組,每組20只。l% OXA給藥當天起,實驗組小鼠每天駱駝奶灌胃(2 g/kg,溶于200 μL雙蒸水),對照組連續200 μL雙蒸水灌胃,7 d后斷頸法處死小鼠,進行后續實驗。
1.2.2 疾病活動指數(disease activity index,DAI)評分:每天記錄小鼠體質量、大便形態和隱血改變情況,用DAI評估結腸炎嚴重程度。體質量改變:體質量減輕<1%,0分;體質量減輕1%~<5%,1分;體質量減輕5%~<10%,2分;體質量減輕10%~<15%,3分;體質量減輕≥15%,4分。大便形態:正常,0分;稍稀,2分;稀便,3分;水樣便,4分。隱血試驗:陰性,0分;弱陽性,1分;陽性,2分;強陽性,3分;肉眼血便,4分。計算DAI=(體質量改變得分+大便形態得分+隱血試驗得分)/3。
1.2.3 腸黏膜固有層細胞提取:斷頸法處死小鼠后,剝離干凈結腸至肛門段腸管,在含有乙二胺四乙酸的DMEM培養基中剪碎并移至離心管。固有層細胞提取參見文獻[4]。在含有100 U/mL膠原酶和5 U/mL DNA酶Ⅰ的DMEM培養基中37 ℃孵育90 min,之后4 ℃、3 000 r/min離心10 min。棄上清,保留細胞沉淀,以梯度離心分離液分離細胞并回收中間段液體,3 000 r/min離心10 min,保留細胞沉淀,棄上清。
1.2.4 流式細胞分析:提取小鼠腸黏膜固有層淋巴細胞,并于細胞混懸液中加入胞外染色抗體進行流式細胞術表面染色。向細胞培養上清中加入佛波酯25 ng/mL,離子霉素1 μg/mL,布雷非德菌素A 10 μg/mL,37 ℃、5% CO2細胞培養箱孵育5 h。之后將細胞破膜固定,再加入胞內染色抗體,4 ℃孵育30 min,之后高速離心機4 ℃、4 800 r/min離心1 min,棄掉上清后重懸沉淀。FACS Canto Ⅱ流式細胞儀檢測,應用FlowJo7.6軟件進行數據分析。
1.2.5 ELISA:臺盼藍染色計數細胞,稀釋后將細胞接種 于96孔 板,每孔2×105/mL,200 μL,37 ℃、5%CO2細胞培養箱孵育48 h,回收上清,加入一抗室溫避光過夜。第2天棄掉孔中液體,洗滌3次,并以封閉液封閉。加入標準品和樣品(50 μL/孔),靜置2 h。加二抗,室溫靜置2 h。棄去孔中液體,加辣根過氧化物酶(50 μL/孔),靜置20 min后加入底物,20 min后以終止液終止反應,立即上機檢測450 nm處吸光度。
1.3 統計學分析
2 結果
2.1 小鼠體質量變化和DAI評分
1% OXA灌腸給藥當天作為第1天,記錄小鼠體質量和排便情況。給藥第1天小鼠體質量記為1,每日記錄體質量比值(當日小鼠體質量/第1天小鼠體質量)。與對照組小鼠相比,實驗組小鼠體質量下降程度減弱、DAI評分低,差異有統計學意義(P<0.05)。提示駱駝奶灌胃后,OXA誘導的小鼠結腸炎發展緩解,駱駝奶可能對腸道有保護作用。見圖1。
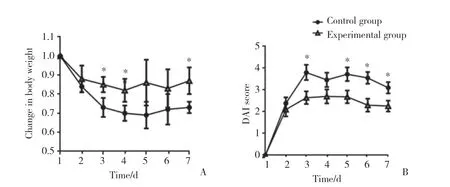
圖1 實驗組和對照組小鼠體質量和DAI評分Fig.1 Body weight and disease activity index(DAI)score of mice in experimental and control groups
2.2 小鼠腸道黏膜淋巴細胞比例
流式細胞術結果顯示,與對照組相比,實驗組小鼠腸黏膜淋巴細胞中CD4+CD25+T細胞(分別為5.78%±0.34%和10.91%±0.86%)和CD4+IFN-γ+T細胞比例(分別為9.48%±0.92%和15.95%±1.13%)升高,CD4+IL-17+T細胞比例(分別為8.23%±1.16%和4.07%±1.02%)下降,差異有統計學意義(P<0.05)。提示駱駝奶可能具有調節小鼠腸道黏膜免疫細胞增殖分化的作用,促進IFN-γ+輔助性T細胞(helper T cell,Th細胞)和調節性T細胞(regulatory T cell,Treg細胞)增殖,抑制Th17細胞增殖。駱駝奶可能通過抵抗OXA誘導的免疫細胞比例失衡,從而緩解腸道炎癥。見圖2。
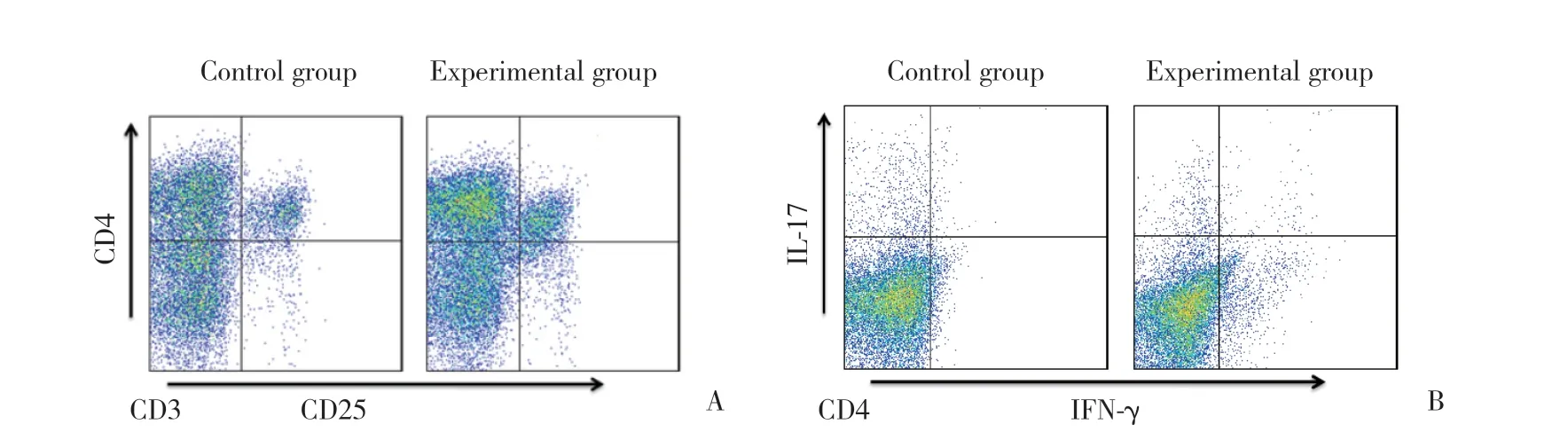
圖2 小鼠腸道淋巴細胞比例Fig.2 Proportions of lymphocytes in mice colon
2.3 小鼠腸道黏膜細胞因子分泌
ELISA結果表明,與對照組相比,實驗組小鼠腸黏膜淋巴細胞培養上清中IL-17、IL-4、IL-13濃度降低,IFN-γ濃度升高,差異有統計學意義(P< 0.05)。提示駱駝奶可能通過調節免疫細胞分泌細胞因子的濃度,緩解OXA誘導的小鼠腸炎。見圖3。
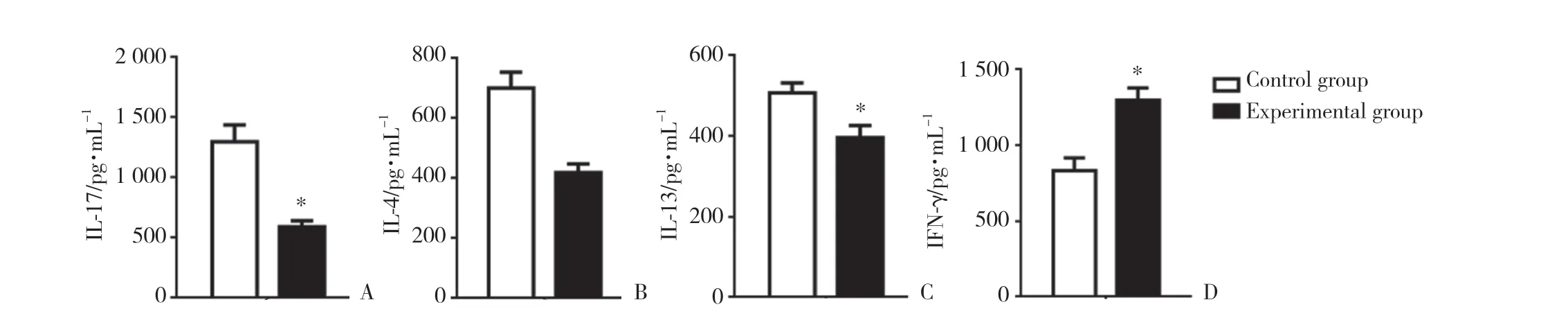
圖3 小鼠腸道黏膜固有層細胞培養上清中細胞因子濃度Fig.3 Concentration of cytokines in the culture supernatant of lamina propria cells from mice colon
3 討論
炎癥性腸病是由易感基因、環境、宿主腸道微生物群數量和種類、病毒和真菌以及免疫穩態失衡等多種因素引起的一系列復雜的病理改變。腸黏膜免疫系統與炎癥性腸病的發病機制有關,包括腸上皮細胞、固有層淋巴細胞、巨噬細胞/單核細胞、中性粒細胞、樹突狀細胞和Treg細胞/B淋巴細胞及其分泌的細胞因子和趨化因子[5]。根據HELLER等[6]的方法,OXA誘導的BALB/c小鼠急性腸炎模型,在疾病進展、病理改變以及免疫狀態改變等方面,均可作為潰瘍性結腸炎的實驗模型,探討其發病機制和藥物應用。
駱駝科與牛科有很大的進化差異,因此駱駝奶與牛奶的蛋白質組成不同,駱駝奶是對牛奶過敏的人群較好的一種替代選擇。研究[7]證明,駱駝奶中富含的胰島素和不飽和脂肪酸能夠調節糖尿病患者的血糖水平,增加患者血清中的超氧化物酶歧化酶、谷胱甘肽過氧物酶活性,降低糖尿病發生率。放化療或長期應用抗生素會對人體免疫系統造成破壞,對骨髓祖細胞造成損傷,引起免疫細胞減少,引起患者免疫抑制,增加病原微生物感染概率。有研究[8]表明,飲用駱駝奶可以調節免疫功能,促進免疫穩態恢復。潰瘍性結腸炎作為一種不典型CD4+Th2型淋巴細胞因子反應性疾病,其特征性免疫因子改變,包括IL-13等表達增多[9]。Th17細胞分泌IL-17A、IL-17F、IL-21等多種細胞因子,在炎癥性腸病發病機制中起關鍵作用。
本研究以OXA誘導的BALB/c小鼠急性腸炎模型作為實驗模型,模擬患者潰瘍性結腸炎發病過程,探究駱駝奶對小鼠腸道黏膜免疫的調節機制,進一步探究駱駝奶的輔助治療作用。本研究中,CD4+IFN-γ+T細胞比例增加,說明駱駝奶對小鼠腸炎的保護作用可能與調節T細胞向Th1型細胞分化有關。促炎的Th2型細胞因子包括IL-4和IL-13水平降低,也提示了小鼠腸道免疫穩態恢復。Treg細胞激活后高水平表達CD25[10]。本研究中,實驗組小鼠CD4+CD25+T細胞比例較對照組增加,而Treg細胞的增加有助于腸炎恢復。結果提示,飲用駱駝奶可能緩解腸炎進展。
總之,本研究表明,駱駝奶可能通過調節Th1-Th2/Treg細胞增殖及其細胞因子分泌,糾正失衡的細胞因子網絡,從而改善OXA誘導的小鼠潰瘍性結腸炎模型的疾病進展。這些結果表明,駱駝奶可能為緩解炎癥性腸病疾病進程提供一種新的輔助治療方法。

