草地貪夜蛾和斜紋夜蛾幼蟲體內(nèi)保護酶及解毒酶對2種殺蟲劑的響應(yīng)比較
李浩 陳亞平 魯智慧 郭建洋 李亞紅 朱林云 和淑琪 桂富榮
摘要:【目的】明確草地貪夜蛾[Spodoptera frugiperda(J. E. Smith)]及其近緣種斜紋夜蛾[Spodoptera litura (Fabricius)]幼蟲體內(nèi)保護酶和解毒酶對2種不同作用類型殺蟲劑的響應(yīng),為草地貪夜蛾和斜紋夜蛾的田間防控及抗藥性治理提供科學(xué)依據(jù)。【方法】采用葉片浸漬法測定甲維鹽和氯蟲苯甲酰胺對草地貪夜蛾和斜紋夜蛾3齡幼蟲的毒力,并用2種殺蟲劑亞致死濃度(LC25)和致死中濃度(LC50)處理過的小麥葉片分別飼喂2種害蟲的3齡幼蟲,比較取食6、12、18、24和48 h后幼蟲體內(nèi)保護酶[超氧化物歧化酶(SOD)、過氧化物酶(POD)和過氧化氫酶(CAT)]及解毒酶[谷胱甘肽S-轉(zhuǎn)移酶(GST)、細胞色素P450(CYP450)和羧酸酯酶(CarE)]的活性變化。【結(jié)果】甲維鹽對草地貪夜蛾和斜紋夜蛾的毒力高于氯蟲苯甲酰胺。2類殺蟲劑脅迫下2種害蟲的CYP450活性均上升,且草地貪夜蛾的CYP450活性高于斜紋夜蛾,在甲維鹽和氯蟲苯甲酰胺低劑量(LC25)脅迫下草地貪夜蛾的CYP450活性均高于高劑量(LC50)脅迫處理,處理后48 h均達最高值(15.72±0.41和15.36±0.47 ng/mL);而草地貪夜蛾另2種解毒酶(GST和CarE)活性在甲維鹽處理后低于斜紋夜蛾。甲維鹽脅迫下2種害蟲體內(nèi)保護酶(SOD和POD)活性均降低,且草地貪夜蛾保護酶活性低于斜紋夜蛾;氯蟲苯甲酰胺脅迫下草地貪夜蛾保護酶(SOD和POD)活性均上升,高劑量氯蟲苯甲酰胺脅迫下2種害蟲SOD和CAT活性均高于低劑量脅迫處理,且草地貪夜蛾SOD和CAT活性高于斜紋夜蛾。2種害蟲體內(nèi)保護酶和解毒酶活性對2類殺蟲劑響應(yīng)差異明顯,且物種、藥劑、濃度、時間、物種×濃度和藥劑×濃度因素對2種害蟲保護酶和解毒酶活性均有極顯著影響(P<0.01)。2類殺蟲劑脅迫下2種害蟲的SOD和CAT活性間相關(guān)性較強。【結(jié)論】草地貪夜蛾對甲維鹽的敏感性高于斜紋夜蛾,而對氯蟲苯甲酰胺的敏感性低于斜紋夜蛾,且2種害蟲均主要通過增強CYP450活性對殺蟲劑進行解毒代謝。農(nóng)業(yè)生產(chǎn)上推薦使用甲維鹽作為防治草地貪夜蛾的藥劑。
關(guān)鍵詞: 草地貪夜蛾;斜紋夜蛾;保護酶;解毒酶;抗藥性
中圖分類號: S433.4? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2021)03-0559-11
Response comparison of protective and detoxification enzymes in Spodoptera frugiperda(J. E. Smith) and Spodoptera litura (Fabricius) larvae to two insecticides
LI Hao1, CHEN Ya-ping1, LU Zhi-hui1,GUO Jian-yang2, LI Ya-hong3,
ZHU Lin-yun1, HE Shu-qi1*, GUI Fu-rong1,4*
(1Plant Protection College, Yunnan Agricultural University/State Key Laboratory for Conservation and Utilization of Bio-resources in Yunnan, Kunming? 650201, China; 2Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing? 100193, China; 3Yunnan Plant Protection and Quarantine Station, Kunming? 650034, China;
4Yunnan Plateau Characteristic Agriculture Industry Research Institute, Kunming? 650201, China)
Abstract:【Objective】The research aimed to clarify the response of different insecticides on the activities of protective enzymes and detoxification enzymes in the larvae of Spodoptera frugiperda(J. E. Smith)and Spodoptera litura (Fabricius) to two insecticides, and to provide theoretical basis for further study on the field control and and insecticide resistance mechanism of S. frugiperda and S. litura. 【Method】The toxicity of emamectin and chlorantraniliprole to the 3rd instar larvae of S. frugiperda and S. litura were assayed by leaf-dipping method by feeding wheat leaves treated with? sublethal concentration(LC25) and median lethal concentration(LC50) of the pesticides respectively, and the activities of protective enzymes[superoxide dismutase(SOD), peroxidase(POD) and catalase(CAT)] and detoxification enzymes [glutathione S-transferase(GST), cytochrome P450(CYP450) and carboxylesterase(CarE)] in larvae after being treated for 6, 12, 18, 24 and 48 h were measured and analyzed. 【Result】The toxicity of emamectin to S. frugiperda and S. litura was higher than that of chlorantraniliprole. The activity of CYP450 in both pests increased after the two insecticide treatments, and was significantly higher in S. frugiperda than that in S. litura. The CYP450 activity in S. frugiperda was more active at low concentration(LC25) of emamectin and chlorantraniliprole than at high concentration(LC50), which was the highest at 48 h as 15.72±0.41(emamectin) and 15.36±0.47 ng/mL(cholrantraniliprole). However, the activities of two detoxification enzymes GST and CarE in S. frugiperda were lower than those in S. litura after emamectin treatment. The activities of protective enzymes SOD and POD in both pests decreased after treated with emamectin, and were lower in S. frugiperda than those in S. litura; while the activities of SOD and POD in S. frugiperda increased after treated with chlorantraniliprole. The activities of SOD and CAT were higher in both pests at LC50 chlorantraniliprole than at LC25, and were higher in S. frugiperda than in S. litura. The response activities of protective enzymes and detoxification enzymes in both pests were greatly affected by the two insecticides, and species, insecticide, concentration, time, species×concentration and insecticide×concentration had extremely significant effects on the activities of protective enzymes and detoxification enzymes(P<0.01). There was a strong correlation between the activities of SOD and CAT of both S. frugiperda and S. litura under two insecticides treatments. 【Conclusion】The susceptibility of S. frugiperda to emamectinis higher than that of S. litura, while the sensitivity to chlorantraniliprole is lower than that of S. litura, and the two pests enhance detoxification metabolism of insecticides by increasing CYP450 activity. In agricultural production, it is recommended to use emamectin as an agent for controlling S. frugiperda.
Key words: Spodoptera frugiperda(J. E. Smith.); Spodoptera litura(Fabricius); protective enzyme; detoxification enzyme; pesticide resistance
Foundation item:National Key Research and Development Program of China(2019YFD0300101,2019YFD0300-104);Major Science and Technology Special Project of Yunnan(2019ZG00910)
0 引言
【研究意義】草地貪夜蛾[Spodoptera frugiperda (J. E. Smith)]隸屬于鱗翅目(Lepidoptera)夜蛾科(Noctuidae),原產(chǎn)于美洲熱帶和亞熱帶地區(qū),是一種具有重大入侵性且危害嚴重的全球性雜食性農(nóng)業(yè)害蟲,幼蟲可為害禾本科(玉米、小麥、水稻等)、十字花科(甘藍、白菜等)和茄科(馬鈴薯、番茄等)等350多種寄主植物(Goergen et al.,2016;Montezano et al.,2018)。草地貪夜蛾的同屬近緣本地種斜紋夜蛾[Spodoptera litura (Fabricius)]廣泛分布于亞洲和大洋洲,且與草地貪夜蛾有較高的生態(tài)位重疊(趙勝園等,2019a)。草地貪夜蛾作為入侵物種,其與本地種斜紋夜蛾對殺蟲劑的抗性水平及生理適應(yīng)性差異至今鮮有研究報道。目前,草地貪夜蛾的防治手段仍以化學(xué)防治為主,甲氨基阿維菌素苯甲酸鹽(Emamectin benzoate)、氯蟲苯甲酰胺(Chlorantraniliprole)等化學(xué)農(nóng)藥對草地貪夜蛾具有良好的防效(Okuma et al.,2018;宋潔蕾等,2019)。探明不同作用類型殺蟲劑對入侵種草地貪夜蛾和本地種斜紋夜蛾保護酶和解毒酶活性的影響,明確其對藥劑的解毒代謝機制,對延緩害蟲抗藥性產(chǎn)生及保障農(nóng)業(yè)生產(chǎn)安全具有重要意義。【前人研究進展】相關(guān)研究表明,昆蟲體內(nèi)的細胞色素P450(CYP450)、谷胱甘肽S-轉(zhuǎn)移酶(GST)和羧酸酯酶(CarE)等主要解毒酶在應(yīng)對殺蟲劑及其他外源或內(nèi)源有害物質(zhì)的過程中發(fā)揮重要作用(Zhang et al.,2017;李長春等,2019;魯智慧等,2020),解毒酶活性的改變與昆蟲抗藥性的產(chǎn)生有關(guān)(何超等,2020),解毒代謝增強是草地貪夜蛾對殺蟲劑產(chǎn)生抗性的主要原因(Teixeira and Andaloro,2013)。張百重等(2020)、Zhang等(2020)研究發(fā)現(xiàn)用甲維鹽、氯蟲苯甲酰胺和Bt殺蟲蛋白處理可誘導(dǎo)草地貪夜蛾幼蟲體內(nèi)CYP4G、CYP321A、CYP321B、CYP6AB和CYP6AE等亞家族的多個基因高表達,從而增強害蟲對殺蟲劑的抗性。Gui等(2020)研究23種常用殺蟲劑對草地貪夜蛾轉(zhuǎn)錄組的影響,發(fā)現(xiàn)經(jīng)殺蟲劑處理后草地貪夜蛾體內(nèi)與殺蟲劑代謝相關(guān)的CYP450、GST、CarE和腺苷三磷酸結(jié)合盒轉(zhuǎn)運蛋白(ABC轉(zhuǎn)運蛋白)等家族中的多個基因均被顯著誘導(dǎo)表達。昆蟲體內(nèi)解毒酶基因的過表達可能引起抗藥性的產(chǎn)生,如對有機磷、擬除蟲菊酯和氨基甲酸酯類殺蟲劑產(chǎn)生抗性的草地貪夜蛾體內(nèi)CYP450、GST和CarE編碼基因過表達(Carvalho et al.,2013)。高祖鵬等(2020)研究發(fā)現(xiàn)乙基多殺菌素對草地貪夜蛾幼蟲的毒殺效果高于氯蟲苯甲酰胺,在不同濃度的乙基多殺菌素處理條件下,草地貪夜蛾幼蟲體內(nèi)的CarE和多功能氧化酶(MFO)活性有所提高。王芹芹等(2020)研究表明茚蟲威對草地貪夜蛾MFO和GST活性具有顯著誘導(dǎo)作用,且增效醚(PBO)和順丁烯二酸二乙酯(DEM)對茚蟲威有明顯的增效作用,故推測MFO和GST活性增強與草地貪夜蛾抗藥性發(fā)展相關(guān)。昆蟲體內(nèi)的保護酶系主要包括超氧化物歧化酶(SOD)、過氧化物酶(POD)和過氧化氫酶(CAT),當受到包括殺蟲劑在內(nèi)的外源化學(xué)物質(zhì)刺激時,3種保護酶的動態(tài)平衡被破壞,導(dǎo)致生物機體內(nèi)氧自由基濃度過高,破壞生物功能分子,使細胞功能受到威脅(Senthil-Nathan,2013;唐芬芬等,2019),蟲體通過升高保護酶活性來最大限度降低外源物造成的氧化損傷(黃訓(xùn)兵等,2021)。【本研究切入點】目前,草地貪夜蛾與本地近緣種斜紋夜蛾的抗藥性差異比較鮮有報道。【擬解決的關(guān)鍵問題】以2種作用機制殺蟲劑(甲維鹽和氯蟲苯甲酰胺)為代表,在采用葉片浸漬法測定這2種殺蟲劑對草地貪夜蛾和斜紋夜蛾3齡幼蟲毒力的基礎(chǔ)上,分別以亞致死濃度(LC25)和致死中濃度(LC50)處理的小麥葉片飼喂2種害蟲的3齡幼蟲,用酶動力法測定其體內(nèi)保護酶和解毒酶活性的差異,并分析物種—藥劑—濃度—時間的關(guān)系,以明確不同作用類型殺蟲劑對2種近緣種害蟲體內(nèi)保護酶和解毒酶活性的影響,為草地貪夜蛾和斜紋夜蛾的田間防控及抗藥性治理提供科學(xué)依據(jù)。
1 材料與方法
1. 1 試驗材料
1. 1. 1 供試蟲源 草地貪夜蛾于2019年5月采自云南省元江縣(東經(jīng)101°58′,北緯23°35′,海拔421 m),斜紋夜蛾購自河南省濟源白云實業(yè)有限公司,2種害蟲均在人工氣候箱(上海一恒科學(xué)儀器有限公司,MG-300A)內(nèi)采用未施用化肥及農(nóng)藥的淮麥36小麥葉片飼養(yǎng)15代以上[飼養(yǎng)溫度(27±0.5)℃,相對濕度(70±5)%,光周期L∶D=16 h∶8 h,下同]。選取3齡幼蟲進行毒力測定及酶活性檢測。
1. 1. 2 供試藥劑 98%甲維鹽原藥和98%氯蟲苯甲酰胺原藥購自江蘇泰越生物科技有限公司;SOD、POD、CAT、GST和CarE等試劑盒購自南京建成生物工程研究所,CYP450 ELISA試劑盒購自上海優(yōu)選生物科技有限公司。
1. 2 試驗方法
1. 2. 1 毒力測定 采用葉片浸漬法(IRAC)對2種殺蟲劑進行毒力測定。以丙酮分別溶解甲維鹽和氯蟲苯甲酰胺原藥配制成母液,用含0.1% Triton X-100的雙蒸水按等比稀釋成5個濃度梯度,每個濃度3次重復(fù);以含0.1% Triton X-100雙蒸水為對照。將小麥葉片(5.0 cm×0.5 cm)在不同濃度藥液中浸漬15 s,取出晾干后放入養(yǎng)蟲盒(18 cm×12 cm×8 cm)中,每個養(yǎng)蟲盒放入大小一致、健康的3齡幼蟲45頭,置于人工氣候箱中飼養(yǎng),每處理3次重復(fù)。48 h后觀察和統(tǒng)計各處理2種害蟲的死亡情況,以毛筆輕觸幼蟲無反應(yīng)視為死亡。
1. 2. 2 2種殺蟲劑處理后草地貪夜蛾和斜紋夜蛾體內(nèi)保護酶及解毒酶活性測定 樣品藥劑處理:用含0.1% Triton X-100的雙蒸水分別將2種藥劑稀釋至相應(yīng)的LC25和LC50,將新鮮小麥葉片在藥液中浸漬15 s后取出,以在0.1% Triton X-100溶液中浸漬15 s的小麥葉片為對照,晾干后放入足量3齡幼蟲的養(yǎng)蟲盒內(nèi)。每個離心管分別收集6、12、18、24和48 h存活幼蟲10頭為1個重復(fù),每處理3次重復(fù),立即浸入液氮,置于-80 ℃?zhèn)溆谩C富钚詼y定按試劑盒說明操作。
酶源制備:分別取上述試蟲10頭(約0.03 g),加入適量的預(yù)冷勻漿介質(zhì)后用高通量研磨儀粉碎,4 ℃下12000 r/min離心10 min,取上清液作為待測酶液。
酶活性測定:按照試劑盒說明使用Varioskan LUX多功能酶標儀(Thermo Fisher Scientific,美國)分別測定酶活性。
SOD活性測定:以SOD抑制率達50%時所對應(yīng)的酶量為1個酶活性單位(U)。
SOD抑制率(%)=[(對照OD-對照空白OD)-
(測定OD-測定空白OD)]/
(對照OD-對照空白OD)×100
SOD活性=SOD抑制率/50%×反應(yīng)體系稀釋倍數(shù)/
待測樣本蛋白濃度
POD活性測定:以每毫克組織蛋白在37 ℃每分鐘催化1 μg底物的酶量定義為1個酶活性單位(U)。
POD活性=(測定OD-空白OD)/(12×比色光徑)×
(反應(yīng)液總體積/樣本量)/反應(yīng)時間/
待測樣本蛋白濃度×1000
CAT活性測定:以每毫克組織蛋白每秒鐘分解1 μmol H2O2的量定義為1個酶活性單位(U)。
CAT活性=(對照OD-測定OD)×271×[1/(60×取
樣量)]/待測樣本蛋白濃度
GST活性測定:以每毫克組織蛋白在37 ℃扣除非酶促反應(yīng),每分鐘降低1 μmol/L GSH的量為1個酶活性單位(U)。
GST活性=(對照OD-測定OD)/(標準OD-空白
OD)/反應(yīng)時間/(樣本取樣量×待測
樣本蛋白濃度)×標準品濃度×反應(yīng)
體系稀釋倍數(shù)
CYP450活性測定:測定待測樣品和標準品OD,將待測樣品OD代入標準品標準曲線直線回歸方程,計算樣品中昆蟲CYP450活性。
CarE活性測定:以每毫克組織蛋白在37 ℃反應(yīng)每分鐘催化吸光值增加1定義為1個酶活性單位(U)。
CarE活性=[(3 min 10 s測定OD-10 s測定OD)-
(3 min 10 s對照OD-10 s對照OD)]/
(待測樣品蛋白濃度×樣品取樣量)/
反應(yīng)時間×反應(yīng)體系總體積
蛋白含量測定:待測樣品蛋白濃度(μg/mL)=(測定OD-空白OD)/(標準OD-空白OD)×樣品測試前稀釋倍數(shù)×標準品濃度。
1. 3 統(tǒng)計分析
采用DPS V7.05分析得到甲維鹽和氯蟲苯甲酰胺的毒力方程及LC25和LC50。采用SPSS 24.0進行單因素方差分析(One-way ANOVA),分別比較草地貪夜蛾和斜紋夜蛾3齡幼蟲體內(nèi)同一時間不同劑量處理的保護酶和解毒酶活性差異顯著性;獨立樣本T 檢驗比較同一藥劑處理濃度2種害蟲保護酶和解毒酶活性差異顯著性;以物種、藥劑、濃度和時間為4個水平處理因子,應(yīng)用四因素方差分析(Four-way ANOVA)進行處理間試驗數(shù)據(jù)的差異顯著性分析,并采用R語言函數(shù)進行試驗數(shù)據(jù)的主成分分析(PCA)和皮爾森(Pearson)相關(guān)分析。
2 結(jié)果與分析
2. 1 2種殺蟲劑對草地貪夜蛾和斜紋夜蛾3齡幼蟲的毒力測定結(jié)果
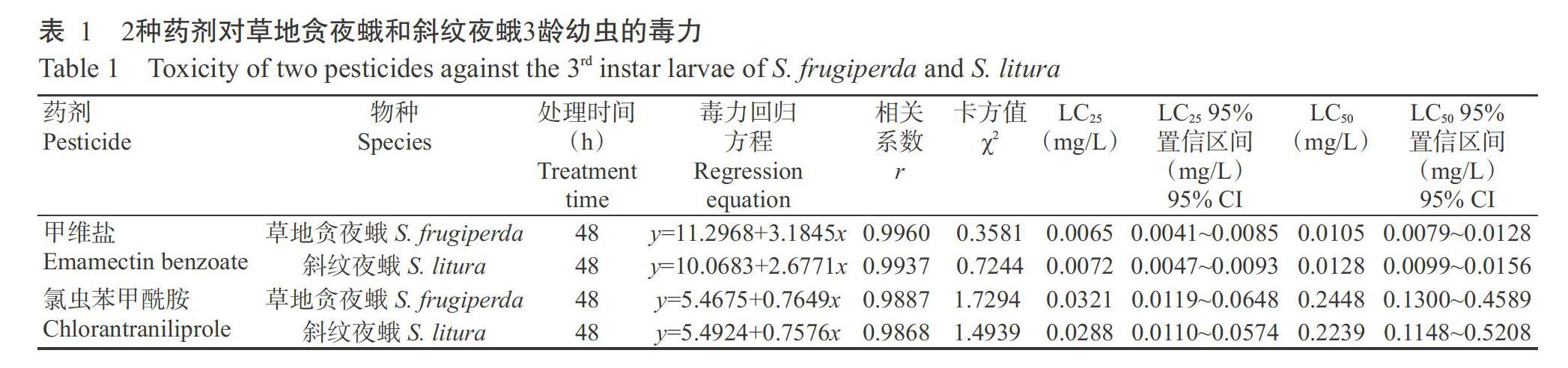
由表1可知,甲維鹽對2種害蟲的毒力高于氯蟲苯甲酰胺,其中甲維鹽對草地貪夜蛾和斜紋夜蛾3齡幼蟲48 h的LC25和LC50分別為0.0065和0.0105 mg/L及0.0072和0.0128 mg/L,氯蟲苯甲酰胺對草地貪夜蛾和斜紋夜蛾3齡幼蟲48 h的LC25和LC50分別為0.0321和0.2448 mg/L及0.0288和0.2239 mg/L。同一處理時間下,甲維鹽對草地貪夜蛾和斜紋夜蛾的LC25和LC50均小于氯蟲苯甲酰胺,甲維鹽對草地貪夜蛾幼蟲的LC25和LC50均小于斜紋夜蛾,而氯蟲苯甲酰胺對草地貪夜蛾幼蟲的LC25和LC50均大于斜紋夜蛾,說明草地貪夜蛾對甲維鹽的敏感性高于斜紋夜蛾,而對氯蟲苯甲酰胺的敏感性低于斜紋夜蛾。
2. 2 甲維鹽對草地貪夜蛾和斜紋夜蛾3齡幼蟲體內(nèi)保護酶及解毒酶活性的影響
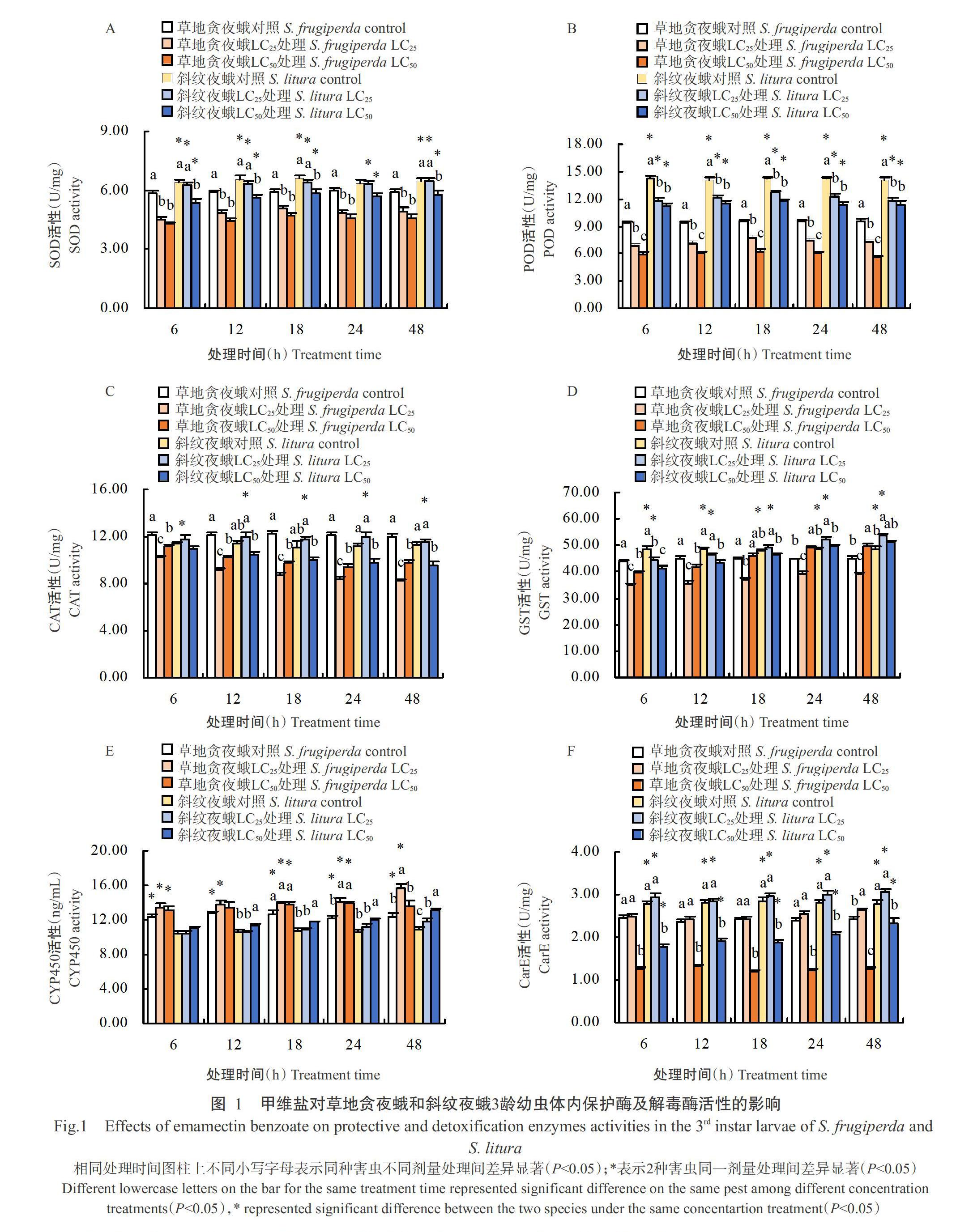
2. 2. 1 對保護酶活性的影響 甲維鹽處理后2種害蟲保護酶(除斜紋夜蛾CAT外)活性均呈降低趨勢,高劑量(LC50處理)甲維鹽脅迫下,2種害蟲SOD(圖1-A)和POD(圖1-B)活性均低于低劑量(LC25處理)脅迫處理,且草地貪夜蛾SOD和POD活性低于斜紋夜蛾,LC50處理草地貪夜蛾SOD和POD活性分別在處理后6和48 h達最低值(4.27±0.11和5.59±0.23 U/mg),僅為對照的73.17%和58.41%。LC25處理后的草地貪夜蛾CAT(圖1-C)活性低于LC50處理,且低于斜紋夜蛾,在處理后48 h達最低值(8.19±0.19 U/mg),僅為對照的68.17%,而斜紋夜蛾LC25處理的CAT活性高于LC50處理。
2. 2. 2 對解毒酶活性的影響 2種害蟲的GST(圖1-D)和CYP450(圖1-E)活性均隨甲維鹽處理時間的延長整體呈升高趨勢,且草地貪夜蛾CYP450活性高于斜紋夜蛾,而GST和CarE(圖1-F)活性低于斜紋夜蛾。其中LC25處理后的草地貪夜蛾CYP450和CarE活性均高于LC50處理,處理48 h均達最高值(15.72±0.41 ng/mL和2.64±0.04 U/mg),為對照的1.27和1.10倍,而GST活性低于LC50處理,在24 h達最高值(39.33±0.93 U/mg);LC25處理后斜紋夜蛾GST和CarE活性均高于LC50處理,均在處理48 h達最高值(53.63±0.82和3.05±0.07 U/mg)。
2. 3 氯蟲苯甲酰胺對草地貪夜蛾和斜紋夜蛾3齡幼蟲體內(nèi)保護酶及解毒酶活性的影響
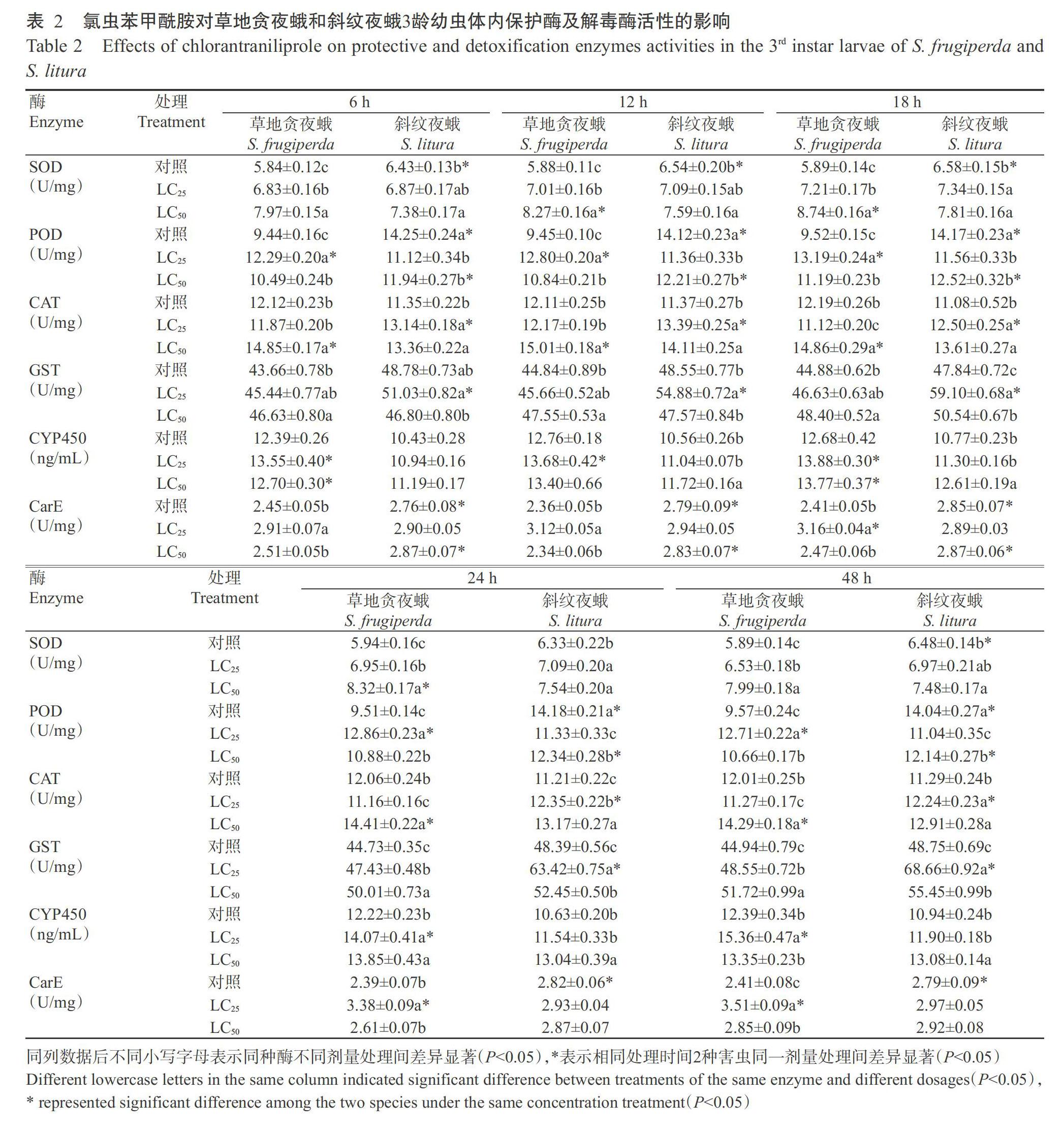
2. 3. 1 對保護酶活性的影響 氯蟲苯甲酰胺脅迫下草地貪夜蛾保護酶(SOD和POD)及斜紋夜蛾保護酶(SOD和CAT)活性均上升(表2),高劑量氯蟲苯甲酰胺脅迫下的2種害蟲SOD和CAT活性均高于低劑量脅迫處理,且草地貪夜蛾SOD和CAT活性高于斜紋夜蛾,LC50處理后18和12 h草地貪夜蛾SOD和CAT活性分別達最高值(8.74±0.16和15.01±0.18 U/mg),而LC25處理后草地貪夜蛾P(guān)OD活性高于LC50處理,且高于斜紋夜蛾,在處理后18 h達最高值(13.19±0.24 U/mg),為對照的1.39倍。
2. 3. 2 對解毒酶活性的影響 經(jīng)氯蟲苯甲酰胺處理后2種害蟲解毒酶活性隨處理時間的延長整體呈升高趨勢,且草地貪夜蛾CYP450活性高于斜紋夜蛾,而GST活性低于斜紋夜蛾,其中,LC25處理后草地貪夜蛾的CYP450和CarE活性均高于LC50處理,處理48 h達最高值(15.36±0.47 ng/mL和3.51±0.09 U/mg),分別為對照的1.24和1.46倍,而GST活性低于LC50處理,處理后48 h達最高值(48.55±0.72 U/mg),為對照的1.08倍;LC25處理后斜紋夜蛾GST和CarE活性均高于LC50處理,處理后48 h達最高值(68.66±0.92和2.97±0.05 U/mg)。
2. 4 草地貪夜蛾和斜紋夜蛾酶活性主成分分析結(jié)果
物種×藥劑因素下草地貪夜蛾和斜紋夜蛾保護酶及解毒酶活性的主成分分析見圖2。第一主成分(PC1)的貢獻度為54.9%,第二主成分(PC2)的貢獻度為17.2%,二者的累積貢獻率為72.1%。草地貪夜蛾甲維鹽處理的保護酶和解毒酶活性在PC1的負方向,斜紋夜蛾甲維鹽處理在PC2的正方向,兩者間無重疊;而2種害蟲氯蟲苯甲酰胺處理均在PC1正方向且有重疊,與2種害蟲甲維鹽處理無重疊;說明2種害蟲氯蟲苯甲酰胺處理間的保護酶和解毒酶活性差異不明顯,但兩者均與2種害蟲甲維鹽處理差異明顯。表明2種近緣種害蟲體內(nèi)的保護酶及解毒酶對甲維鹽和氯蟲苯甲酰胺響應(yīng)差異明顯。
2. 5 草地貪夜蛾和斜紋夜蛾酶活性變化的四因素方差分析結(jié)果
由表3可知,草地貪夜蛾和斜紋夜蛾幼蟲體內(nèi)SOD、POD、CAT、GST、CYP450和CarE活性修正模型F分別為40.06、95.07、37.07、60.40、24.57和60.08,處理間差異極顯著(P<0.01,下同),所選模型具有統(tǒng)計意義。其中,物種、藥劑、濃度、時間、物種×濃度、藥劑×濃度對3種保護酶和解毒酶活性均有極顯著影響;物種×藥劑、物種×藥劑×濃度對3種保護酶及CYP450和CarE活性均有極顯著影響;濃度×?xí)r間對CAT和3種解毒酶活性有極顯著影響;物種×藥劑×?xí)r間對GST和CarE活性有極顯著影響;物種×濃度×?xí)r間對GST和CYP450活性有極顯著影響。
2. 6 草地貪夜蛾和斜紋夜蛾酶活性相關(guān)分析結(jié)果
2種害蟲酶活性的皮爾森相關(guān)分析結(jié)果表明,經(jīng)2種殺蟲劑處理后,2種害蟲體內(nèi)的SOD與CAT活性間相關(guān)性較強(圖3),其中,草地貪夜蛾幼蟲體內(nèi)保護酶SOD、POD和CAT間呈正相關(guān),GST和CYP450活性與CarE呈正相關(guān)(圖3-A);斜紋夜蛾P(guān)OD和CAT活性與SOD活性呈正相關(guān),CYP450和CarE活性與GST活性呈正相關(guān)(圖3-B)。綜合GST、CYP450和CarE活性,推斷這3種與解毒代謝相關(guān)的酶在2種害蟲應(yīng)對不同殺蟲劑時通過調(diào)節(jié)活性相互協(xié)調(diào)、配合,共同抵御殺蟲劑脅迫,其中以殺蟲劑脅迫下草地貪夜蛾CYP450和CarE及斜紋夜蛾GST和CarE活性變化相關(guān)性較強。
3 討論
自2019年草地貪夜蛾入侵我國以來,國內(nèi)學(xué)者相繼開展了殺蟲劑對其毒力及防效研究。大量研究表明,新型作用機制殺蟲劑甲維鹽和氯蟲苯甲酰胺對草地貪夜蛾幼蟲具有較強的毒殺效果,校正死亡率均超過90%(宋潔蕾等,2019;趙勝園等,2019b)。本研究中甲維鹽對草地貪夜蛾和斜紋夜蛾的毒力均高于氯蟲苯甲酰胺,與蔣興川等(2019)、宋潔蕾等(2019)報道的結(jié)果一致,且草地貪夜蛾對甲維鹽的敏感性高于斜紋夜蛾,而對氯蟲苯甲酰胺的敏感性低于斜紋夜蛾。
外源毒物可使昆蟲體內(nèi)的O[-2]·、·OH和H2O2等活性氧自由基數(shù)量激增,對蟲體產(chǎn)生毒害作用,而保護酶SOD、POD和CAT通過清除多余的活性氧自由基,使蟲體不受外源毒物侵害(Bashan et al.,2009)。本研究中,經(jīng)甲維鹽處理后2種害蟲3齡幼蟲體內(nèi)保護酶(除斜紋夜蛾CAT外)活性均呈降低趨勢,而氯蟲苯甲酰胺處理后草地貪夜蛾保護酶(SOD和POD)及斜紋夜蛾保護酶(SOD和CAT)活性均升高,表明SOD持續(xù)歧化O[-2]·,由CAT和POD分解H2O2,從而促使2種害蟲能最大限度降低機體受到氯蟲苯甲酰胺脅迫的氧化損傷(張文成等,2009)。同時,以高濃度氯蟲苯甲酰胺處理后2種害蟲的保護酶活性均高于甲維鹽處理,表明保護酶活性升高可能是2種害蟲對氯蟲苯甲酰胺的敏感性低于甲維鹽的原因之一。
為應(yīng)對環(huán)境中的外源有毒物質(zhì)如殺蟲劑等壓力,昆蟲在長期的進化過程中已形成解毒代謝途徑,其中體內(nèi)的GST、CYP450和CarE等解毒酶在解毒代謝過程中發(fā)揮著重要作用(高祖鵬等,2020;Gui et al.,2020)。GST是昆蟲體內(nèi)重要的II相解毒酶,通過催化還原型谷胱甘肽(GSH)和有毒物質(zhì)發(fā)生軛合反應(yīng),使有毒軛合物的水溶性增強而更易排出體外,最終達到解毒代謝的目的(Song et al.,2020)。陳羿渠等(2017)研究表明,氯蟲苯甲酰胺亞致死劑量處理甜菜夜蛾(Spodoptera exigua)4齡幼蟲體內(nèi)中腸和脂肪體GST活性均升高,分別為對照的1.31和1.43倍;張振威等(2019)報道,舞毒蛾(Lymantria dispar)經(jīng)甲維鹽亞致死濃度處理后,幼蟲體內(nèi)的GST活性高于對照,且隨著處理濃度的增加而升高。本研究以甲維鹽和氯蟲苯甲酰胺LC50處理后草地貪夜蛾GST活性總體均升高,且低于斜紋夜蛾,表明在高濃度甲維鹽和氯蟲苯甲酰胺脅迫下,草地貪夜蛾和斜紋夜蛾通過提高GST活性而增強解毒代謝作用,與戴瀚洋等(2015)、陳羿渠等(2017)關(guān)于甲維鹽和氯蟲苯甲酰胺對甜菜夜蛾幼蟲GST活性影響的結(jié)果類似,同時表明殺蟲劑脅迫下草地貪夜蛾GST活性低于斜紋夜蛾是草地貪夜蛾對甲維鹽敏感性高于斜紋夜蛾的原因之一。CYP450是昆蟲體內(nèi)的重要代謝酶系之一,能代謝多種外源或內(nèi)源化合物(Riveron et al.,2013)。歐善生等(2012)研究報道,棉鈴蟲(Helicoverpa armigera)經(jīng)氯蟲苯甲酰胺脅迫后,3~6齡幼蟲體內(nèi)CYP450活性均高于對照。本研究發(fā)現(xiàn)經(jīng)甲維鹽和氯蟲苯甲酰胺處理后草地貪夜蛾CYP450活性均升高,且總體上高于斜紋夜蛾,表明草地貪夜蛾CYP450活性高于斜紋夜蛾是草地貪夜蛾對氯蟲苯甲酰胺敏感性低于斜紋夜蛾的原因之一。Gui等(2020)通過基因組學(xué)分析揭示,入侵我國的草地貪夜蛾CYP450、解螺旋酶等多個基因家族出現(xiàn)顯著擴增,其中CYP450家族多達425個基因,為本地種斜紋夜蛾的3倍,且有283個為草地貪夜蛾特有;在染色體水平基因組基礎(chǔ)上進一步測定23種農(nóng)藥處理后的草地貪夜蛾轉(zhuǎn)錄組水平差異,發(fā)現(xiàn)草地貪夜蛾425個CYP基因中有107個基因差異表達明顯。本研究結(jié)果表明,在甲維鹽和氯蟲苯甲酰胺脅迫下草地貪夜蛾CYP450活性升高是解毒代謝的關(guān)鍵。邢靜等(2011)研究發(fā)現(xiàn),以氯蟲苯甲酰胺亞致死濃度處理3齡小菜蛾(Plutella xylostella)幼蟲后,其體內(nèi)CarE活性顯著高于對照。蔣興川等(2019)研究報道,甲維鹽LC20處理后草地貪夜蛾3齡幼蟲體內(nèi)CarE活性隨著處理時間的延長呈升高趨勢。本研究中,甲維鹽和氯蟲苯甲酰胺LC25處理后草地貪夜蛾CarE活性均升高,且甲維鹽處理后CarE活性均低于斜紋夜蛾,與邢靜等(2011)、蔣興川等(2019)的研究結(jié)果類似。任娜娜等(2014)研究表明,CarE在甲維鹽、氯蟲苯甲酰胺等新型作用類型殺蟲劑的抗性發(fā)展中具有重要作用。Gui等(2020)研究顯示,入侵我國的草地貪夜蛾CarE家族基因數(shù)78個,僅為本地種斜紋夜蛾的一半。可見,草地貪夜蛾CarE活性低于斜紋夜蛾可能是對甲維鹽敏感性高的主要原因之一。
本研究首次比較入侵種草地貪夜蛾和本地種斜紋夜蛾對2種新型作用機制殺蟲劑的酶活性響應(yīng)差異,探究2種夜蛾對殺蟲劑脅迫下的競爭優(yōu)勢,為研究草地貪夜蛾的抗藥性機制和延緩抗藥性產(chǎn)生打下基礎(chǔ),有關(guān)這2種殺蟲劑對草地貪夜蛾和斜紋夜蛾的抗性選育和抗藥性基因篩選等有待進一步研究。
4 結(jié)論
草地貪夜蛾對甲維鹽的敏感性高于斜紋夜蛾,而對氯蟲苯甲酰胺的敏感性低于斜紋夜蛾,且2種害蟲均主要通過增強CYP450活性對殺蟲劑進行解毒代謝。農(nóng)業(yè)生產(chǎn)上推薦使用甲維鹽作為防治草地貪夜蛾的藥劑。
參考文獻:
陳羿渠,向興,貢常委,王學(xué)貴. 2017. 氯蟲苯甲酰胺亞致死劑量對甜菜夜蛾主要解毒酶活性與生長繁殖的影響[J]. 中國農(nóng)業(yè)科學(xué),50(8):1440-1451. doi:10.3864/j.issn. 0578-1752.2017.08.008. [Chen Y Q,Xiang X,Gong C W,Wang X G. 2017. Effects of sublethal doses of chlorantraniliprole on the detoxification enzymes activities and the growth and reproduction of Spodoptera exigua[J]. Scientia Agricultura Sinica,50(8):1440-1451.]
戴瀚洋,孫洋,柏立新,趙靜,肖留斌,譚永安. 2015. 亞致死濃度甲維鹽脅迫對甜菜夜蛾幼蟲解毒酶系活力及其相關(guān)基因表達量的影響[J]. 棉花學(xué)報,27(2):149-158. doi:10.11963/issn.1002-7807.201502008. [Dai H Y,Sun Y,Bai L X,Zhao J,Xiao L B,Tan Y A. 2015. Activities of detoxification enzymes and expressions of related genes in Spodoptera exigua larvae treated with sublethal concentrations of emamectin benzoate[J]. Cotton Science,27(2):149-158.]
高祖鵬,郭井菲,何康來,王振營. 2020. 乙基多殺菌素對草地貪夜蛾幼蟲的毒力及對其解毒酶和乙酰膽堿酯酶活性的影響[J]. 害蟲學(xué)報,63(5):558-564. doi:10.16380/j.kcxb.2020.05.004. [Gao Z P,Guo J F,He K L,Wang Z Y. 2020. Toxicity of spinetoram and its effects on the detoxifying enzyme and acetyl cholinesterase activities in Spodoptera frugiperda (Lepidoptera:Noctuidae) larvae[J]. Acta Entomologica Sinica,63(5):558-564.]
何超,沈登榮,尹立紅,張睿,袁盛勇,田學(xué)軍. 2020. 3種殺蟲劑對井上蛀果斑螟存活、化蛹及羽化的影響[J]. 河南農(nóng)業(yè)科學(xué),49(9):105-111. doi:10.15933/j.cnki.1004-3268. 2020.09.013. [He C,Shen D R,Yin L H,Zhang R,Yuan S Y,Tian X J. 2020. Effects of three insecticides on survival,pupation and emergence of Assara inouei Yamanaka[J]. Journal of Henan Agricultural Sciences,49(9):105-111.]
黃訓(xùn)兵,李輝,涂雄兵,張澤華. 2021. 四種植物源化合物對亞洲小車蝗存活率、解毒酶和保護酶活性的影響[J]. 植物保護學(xué)報,48(1):158-164. doi:10.13802/j.cnki.zwbhxb. 2021.2021821. [Huang X B,Li H,Tu X B,Zhang Z H. 2021. Effects of four plant-derived compounds on the survival rate and activities of detoxification enzymes and protective enzymes in the grasshopper Oedaleus asiaticus[J]. Journal of Plant Protection,48(1):158-164.]
蔣興川,沈懌丹,孫勁超,李秀霞,黃勇,董永成,操海群. 2019. 氯蟲苯甲酰胺和甲維鹽對草地貪夜蛾幼蟲的毒力及解毒酶活性的影響[J]. 環(huán)境害蟲學(xué)報,41(5):961-967. doi:10.3969/j.issn.1674-0858.2019.05.5. [Jiang X C,Shen Y D,Sun J C,Li X X,Huang Y,Dong Y C,Cao H Q. 2019. Effect of chlorantraniliprole and emamectin benzoa-te on toxicity and detoxification enzymes activity in Spo-doptera frugiperda larva[J]. Journal of Environmental Entomology,41(5):961-967.]
李長春,寧青,戴余軍,王立華,李國元,彭宇. 2019. 擬環(huán)紋豹蛛谷胱甘肽S-轉(zhuǎn)移酶基因的克隆及表達分析[J]. 江蘇農(nóng)業(yè)學(xué)報,35(5):1068-1074. doi:10.3969/j.issn.1000-4440. 2019.05.010. [Li C C,Ning Q,Dai Y J,Wang L H,Li G Y,Peng Y. 2019. Cloning and expression analysis of glutathione S-transferase gene in Pardosa pseudoannulata[J]. Jiangsu Journal of Agricultural Sciences,35(5):1068- 1074.]
魯智慧,和淑琪,郭晉,陳亞平,胡雪瓊,李浩,謝琦,桂富榮. 2020. 取食不同寄主植物對草地貪夜蛾幼蟲體內(nèi)3類酶活性的影響[J]. 南方農(nóng)業(yè)學(xué)報,51(10):2461-2469. doi:10.3969/j.issn.2095-1191.2020.10.018. [Lu Z H,He S Q,Guo J,Chen Y P,Hu X Q,Li H,Xie Q,Gui F R. 2020. Effects of host plants on activities of three groups of enzymes in Spodoptera frugiperda(Smith) larvae[J]. Journal of Southern Agriculture,51(10):2461-2469]
歐善生,梁沛,宋敦倫,史雪巖,高希武. 2012. 氯蟲苯甲酰胺亞致死劑量對棉鈴蟲生長發(fā)育和解毒酶活性的影響[J]. 植物保護,38(4):1-8. doi:10.3969/j.issn.0529-1542.2012. 04.001. [Ou S S,Liang P,Song D L,Shi X Y,Gao X W. 2012. Effects of sublethal dosage of chlorantraniliprole on development and detoxifying enzymes activity of Helicoverpa armigera[J]. Plant Protection,38(4):1-8.]
任娜娜,謝苗,尤燕春,尤民生. 2014. 羧酸酯酶及其介導(dǎo)害蟲抗藥性的研究進展[J]. 福建農(nóng)林大學(xué)學(xué)報(自然科學(xué)版),43(4):337-344. doi:10.13323/j.cnki.j.fafu(nat.sci.). 2014.04.005. [Ren N N,Xie M,You Y C,You M S. 2014. An overview on the study of insect carboxylesterases (COEs) and the COE-mediated resistance to insecticides[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition),43(4):337-344.]
宋潔蕾,李艷麗,李亞紅,黃碧芬,康云昌,馬庭矗,張澍雷,桂富榮. 2019. 不同殺蟲劑對草地貪夜蛾的室內(nèi)毒殺效果及毒力測定[J]. 南方農(nóng)業(yè)學(xué)報,50(7):1489-1495. doi:10.3969/j.issn.2095-1191.2019.07.12. [Song J L,Li Y L,Li Y H,Huang B F,Kang Y C,Ma T C,Zhang S L,Gui F R. 2019. Measurements of indoor toxic effects and viru-lence of different insecticides against Spodoptera frugiperda[J]. Journal of Southern Agriculture,50(7):1489-1495.]
唐芬芬,楊偉克,朱峰,邵榆嵐,張永紅,白興榮. 2019. BmNPV對家蠶抗氧化酶基因表達及其酶活性的影響[J]. 南方農(nóng)業(yè)學(xué)報,50(10):2308-2313. doi:10.3969/j.issn.2095-1191.2019.10.22. [Tang F F,Yang W K,Zhu F,Shao Y L,Zhang Y H,Bai X R. 2019. Effects of BmNPV on the antioxidant enzyme gene expression and enzyme activity of Bombyx mori[J]. Journal of Southern Agriculture,50(10):2308-2313.]
王芹芹,崔麗,王立,黃偉玲,代黎明,袁會珠,芮昌輝. 2020. 茚蟲威對草地貪夜蛾的毒力及解毒酶的誘導(dǎo)作用[J]. 植物保護,46(1):78-81. doi:10.16688/j.zwbh.2019557. [Wang Q Q,Cui L,Wang L,Huang W L,Dai L M,Yuan H Z,Rui C H. 2020. Toxicity of indoxacarb to Spodoptera frugiperda and induction of its detoxifying enzymes[J]. Plant Protection,46(1):78-81.]
邢靜,梁沛,高希武. 2011. 亞致死濃度氯蟲苯甲酰胺對小菜蛾藥劑敏感度和解毒酶活性的影響[J]. 農(nóng)藥學(xué)學(xué)報,13(5):464-470. doi:10.3969/j.issn.1008-7303.2011.05.05. [Xing J,Liang P,Gao X W. 2011. Effects of sublethal concentrations of chlorantraniliprole on insecticide susceptibility and detoxifying enzyme activity in Plutella xylostella[J]. Chinese Journal of Pesticide Science,13(5):464-470.]
趙勝園,羅倩明,孫小旭,楊現(xiàn)明,姜玉英,吳孔明. 2019a. 草地貪夜蛾與斜紋夜蛾的形態(tài)特征和生物學(xué)習(xí)性比較[J]. 中國植保導(dǎo)刊,39(5):26-35. doi:10.3969/j.issn.1672-6820.2019.05.005. [Zhao S Y,Luo Q M,Sun X X,Yang X M,Jiang Y Y,Wu K M. 2019a. Comparison of morphological and biological characteristics between Spodoptera frugiperda and Spodoptera litura[J]. China Plant Protection,39(5):26-35.]
趙勝園,孫小旭,張浩文,楊現(xiàn)明,吳孔明. 2019b. 常用化學(xué)殺蟲劑對草地貪夜蛾防效的室內(nèi)測定[J]. 植物保護,45(3):10-14. doi:10.16688/j.zwbh.2019160. [Zhao S Y,Sun X X,Zhang H W,Yang X M,Wu K M. 2019b. Laboratory test on the control efficacy of common chemical insecticides against Spodoptera frugiperda[J]. Plant Protection,45(3):10-14.]
張百重,蘇栩,盧留洋,甄叢愛,朱斌,李亞設(shè),董文陽,汪耿,胥燕博,孔凡彬,劉潤強,陳錫嶺,高希武. 2020. 三種殺蟲劑亞致死劑量對草地貪夜蛾細胞色素P450基因表達的影響[J]. 害蟲學(xué)報,63(5):565-573. doi:10.16380/j.kcxb.2020.05.005. [Zhang B C,Su X,Lu L Y,Zhen C A,Zhu B,Li Y S,Dong W Y,Wang G,Xu Y B,Kong F B,Liu R Q,Chen X L,Gao X W. 2020. Effects of three insecticides at the sublethal dose on the expression of cytochrome P450 genes in Spodoptera frugiperda (Lepidoptera:Noctuidae)[J]. Acta Entomologica Sinica,63(5):565-573.]
張文成,王開運,牛芳,王東,任學(xué)祥. 2009. 蟲螨腈脅迫對甜菜夜蛾保護酶系和解毒酶系的誘導(dǎo)效應(yīng)[J]. 植物保護學(xué)報,36(5):455-460. doi:10.13802/j.cnki.zwbhxb.2009. 05.005. [Zhang W C,Wang K Y,Niu F,Wang D,Ren X X. 2009. Induction of chlorfenapyr on endogenous protective and detoxifying enzymes in beet armyworm,Spo-doptera exigua (Hübner)[J]. Journal of Plant Protection,36(5):455-460.]
張振威,趙清泉,郝昕,潘佳亮,馬玲. 2019. 阿維菌素和甲維鹽對舞毒蛾幼蟲的毒力及解毒酶活性的影響[J]. 東北林業(yè)大學(xué)學(xué)報,47(5):118-122. doi:10.13759/j.cnki.dlxb. 2019.05.023. [Zhang Z W,Zhao Q Q,Hao X,Pan J L,Ma L. 2019. Effect of avermectin and emamectin benzoa-te on toxicity and detoxifying enzymes activity in Lymantria dispar larva[J]. Journal of Northeast Forestry University,47(5):118-122.]
Bashan N,Kovsan J,Kachko I,Ovadia H,Rudich A. 2009. Positive and negative regulation of insulin signaling by reactive oxygen and nitrogen species[J]. Physiological Reviews,89(1):27-71. doi:10.1152/physrev.00014.2008.
Carvalho R A,Omoto C,F(xiàn)ield L M,Williamson M S,Bass C. 2013. Investigating the molecular mechanisms of organophosphate and pyrethroid resistance in the fall armyworm Spodoptera frugiperda[J]. PLoS One,8(4):e62268. doi:10.1371/journal.pone.0062268.
Goergen G,Kumar P L,Sankung S B,Togola A,Tamò M. 2016. First report of outbreaks of the fall armyworm Spo-doptera frugiperda(J. E. Smith)(Lepidoptera,Noctuidae),a new alien invasive pest in west and central Africa[J]. PLoS One,11(10):e0165632. doi:10.1371/journal.pone.0165632.
Gui F R,Lan T M,Zhao Y,Guo W,Dong Y,F(xiàn)ang D M,Liu H,Li H M,Wang H L,Hao R S,Cheng X F,Li Y H,Yang P C,Sahu S K,Chen Y P,Cheng L,He S Q,Liu P,F(xiàn)an G Y,Lu H R,Hu G H,Dong W,Chen B,Jiang Y,Zhang Y W,Xu H H,Lin F,Slipper B,Postma A,Jackson M,Abate B A,Tesfaye K,Demie A L,Bayeleygne M D,Degefu D T,Chen F,Kuria P K,Kinyua Z M,Liu T X,Yang H M,Huang F N,Liu X,Sheng J,Kang L. 2020. Genomic and transcriptomic analysis unveils population evolution and development of pesticide resistance in fall armyworm Spodoptera frugiperda[J]. Protein & Cell. doi:10.1007/s13238-020-00795-7.
Montezano D G,Sosa-Gómez D R,Specht A,Roque-Specht V F,Sousa-Silva J C,Paula-Moraes S V,Peterson J A,Hunt T E. 2018. Host plants of Spodoptera frugiperda (Lepidoptera:Noctuidae) in the Americas[J]. African Entomology,26(2):286-300. doi:10.4001/003.026.0286.
Okuma D M,Bernardi D,Horikoshi R J,Bernardi O,Silva A P,Omoto C. 2018. Inheritance and fitness costs of Spodoptera frugiperda (Lepidoptera:Noctuidae) resistance to spinosad in Brazil[J]. Pest Management Science,74(6):1441-1448. doi:10.1002/ps.4829.
Riveron J M,Irving H,Ndula M,Barnes K G,Ibrahim S S,Paine M J I,Wondji C S. 2013. Directionally selected cytochrome P450 alleles are driving the spread of pyrethroid resistance in the major malaria vector Anopheles funestus[J]. Proceedings of the National Academy of Scien-ces of the United States of America,110(1):252-257. doi:10.1073/pnas. 1216705110.
Senthil-Nathan S. 2013. Physiological and biochemical effect of neem and other Meliaceae plants secondary metabolites against Lepidopteran insects[J]. Frontiers in Physio-logy,4:359. doi:10.3389/fphys.2013.00359.
Song X,Pei L,Zhang Y,Chen X,Zhong Q,Ji Y,Tang J,F(xiàn)eng F,Li B. 2020. Functional diversification of three delta-class glutathione S-transferases involved in development and detoxification in Tribolium castaneum[J]. Insect Molecular Biology,29(3):320-336. doi:10.1111/imb.12637.
Teixeira L A,Andaloro J T. 2013. Diamide insecticides:Global efforts to address insect resistance stewardship challenges[J]. Pesticide Biochemistry and Physiology,106(3):76-78. doi:10.1016/j.pestbp.2013.01.010.
Zhang B Z,Su X,Zhen C A,Lu L Y,Li Y S,Ge X,Chen D M,Pei Z,Shi M W,Chen X L. 2020. Silencing of cytochrome P450 in Spodoptera frugiperda(Lepidoptera:Noctuidae) by RNA interference enhances susceptibility to chlorantraniliprole[J]. Journal of Insect Science,20(3):12;1-7. doi:10.1093/jisesa/ieaa047.
Zhang X L,Liao X,Mao K K,Yang P,Li D Y,Alia E,Wan H,Li J H. 2017. The role of detoxifying enzymes in field-evolved resistance to nitenpyram in the brown planthopper Nilaparvata lugens in China[J]. Crop Protection,94:106-114. doi:10.1016/j.cropro.2016.12.022.
(責(zé)任編輯 麻小燕)

