霍奇金淋巴瘤放化療后原發性惡性心包間皮瘤1例
陳海峰
患者男性,38歲。因“反復左側胸痛4個月余”于1999年2月13日在紹興第二醫院行B超檢查,提示兩側鎖骨上多個腫大淋巴結。2月20日在湖州市第一人民醫院行胸部X線片檢查示縱隔惡性腫瘤。3月3日轉浙江大學醫學院附屬第一醫院接受進一步治療,入院體格檢查:左下頸部見2 cm×2 cm、3 cm×2.5 cm淋巴結,質硬,活動度差,右鎖骨上見1 cm×0.9 cm淋巴結,左腋下見1.5 cm×2 cm淋巴結。行左鎖骨上淋巴結活檢,病理結果提示霍奇金淋巴瘤(混合細胞型)。4月23日、5月20日、7月1日、7月29日予ABVD方案(多柔比星40 mg,第1、15天+博來霉素15 mg,第1、15天+長春新堿2 mg,第1、15天+達卡巴嗪400 mg,第1、15天,每4周重復)化療4個周期。8月18日至9月27日予放療,具體方案:直線加速器6~10 MV-X線外照,縱隔DT=5 000 cGy/25 F,雙頸部DT=50 Gy/25 F,雙腋窩下DT=50 Gy/20 F。8月26日再次行ABVD方案化療1個周期,此后定期復查。2001年8月30日復查兩側鎖骨上、腋下及縱隔淋巴結基本消失。至2011年9月6日,患者病情穩定。
2017年3月27日患者因“心前區疼痛2 d”就診于紹興市人民醫院,查癌胚抗原0.67 μg/L、CA19-9為34.63 U/mL。心臟彩超檢查示:心包積液,二尖瓣、三尖瓣、肺動脈瓣少量反流。血常規檢查示:白細胞計數8.35×109/L,紅細胞計數3.09×1012/L,血紅蛋白91g/L,血小板計數16×109/L。肌鈣蛋白<0.01μg/L。心電圖檢查示:(1)竇性心動過速;(2)ST段普遍抬高(Ⅱ、aVFⅠ、aVL V2~V6ST段抬高0.05~0.1 mv);(3)左胸導聯QRS低電壓。入院后予心包穿刺引流。3月31日轉至浙江大學醫學院附屬第一醫院接受進一步診治,入院診斷考慮“化膿性心包炎”,先后予頭孢曲松針、達托霉素針、利奈唑胺片、頭孢克肟膠囊抗感染治療,胸水及心包積液消失。5月16日因“再發伴咳嗽氣促5 d”再次就診于浙江大學醫學院附屬第一醫院,予胸腔穿刺引流,胸水生化檢查示:腺苷酸脫氨酶3 U/L,葡萄糖7.19 mmol/L,白蛋白26.16 g/L,乳酸脫氫酶83 U/L。胸水常規檢查示:外觀黃色、清晰,李凡他試驗陽性,紅細胞550 μL,嗜中性細胞百分比11%,淋巴細胞百分比89%。胸水結核菌涂片檢查未找到抗酸桿菌。血、胸水結核感染T細胞斑點試驗陽性。5月17日胸部CT檢查示:雙肺上葉支氣管擴張,雙肺少許感染,雙側胸腔積液伴雙下肺膨脹不全,心包積液,心膈角淋巴結腫大。5月25日心臟彩超檢查示:心包彌漫性低回聲稍增厚,伴左、右室心外膜層心肌活動受限,下腔靜脈增厚,二尖瓣、三尖瓣輕度反流,肺動脈壓增高,符合縮窄性心包炎的表現,見圖1。經全院多學科討論,考慮結核性心包炎。5月18日開始予異煙肼+利福平+吡嗪酰胺+乙胺丁醇+莫西沙星(HRZEMfx)方案診斷性抗結核治療。6月6日復查胸部CT示:雙肺胸腔積液伴左肺上葉、雙肺下葉膨脹不全,心包增厚,心包少量積液,見圖2。治療3周后行全麻下心包剝離術。6月14日術后病理檢查示:(心包)異形腺體浸潤,結合免疫組化考慮惡性心包間皮瘤。免疫組化:CK(pan)(+),Calretinin(CR)(+),CK5/6(+),Meso-cell(Mes)(+),WT1(+),TTF1(-),CK-7(+),CD3(-),CD20(-),CD10(-),Ki-67(+),見圖3。術后患者心包縮窄癥狀未緩解,反而持續加重,腫瘤外科會診后建議化療,但患者拒絕化療出院。6月28日因“雙下肢浮腫伴少尿20 d”轉至紹興第二醫院,予平喘、抗炎、利尿等對癥治療。7月10日死于心力衰竭。
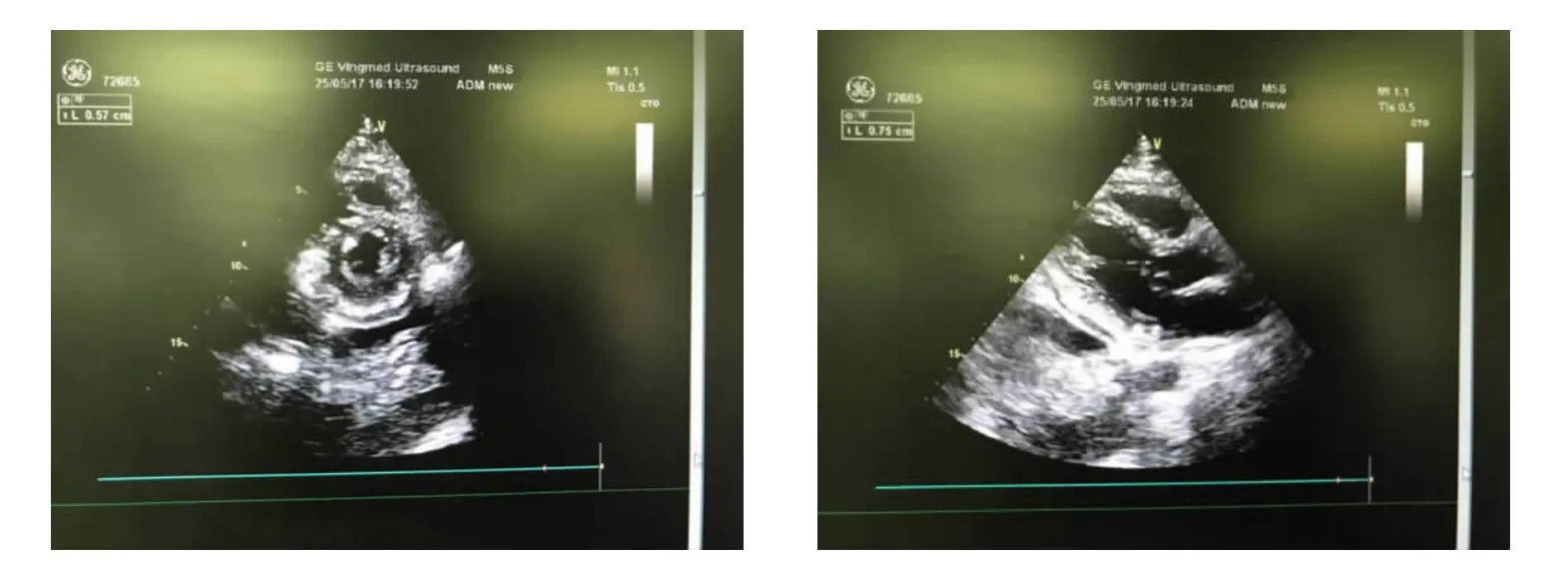
圖1 2017年5月25日心臟彩超檢查所見

圖2 2017年6月6日抗結核治療后復查胸部CT所見
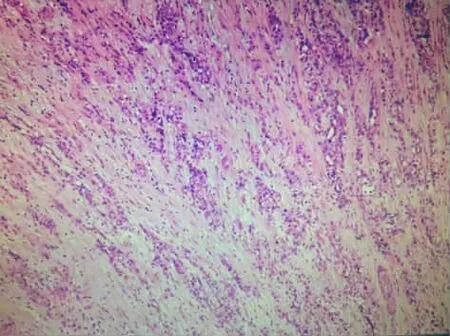
圖3 2017年免疫組化結果[(心包)異形腺體浸潤,×10]
討論心包間皮瘤發生率極低,國外一項大規模尸檢結果顯示其發生率在0.022‰以下[1-2],約占所有心臟及心包原發腫瘤的2%~3%,是繼血管肉瘤、橫紋肌肉瘤之后的第三大腫瘤。該病男女比接近2∶1,低于胸膜間皮瘤3.5∶1的比例;好發年齡40~70歲,相比于胸膜或腹膜間皮瘤,發病年齡更趨于年輕化。目前關于心包間皮瘤的病因尚不明確。國外個案報道與局部區域放療相關[3-4]。心包間皮瘤無特異性表現,可表現為咳嗽、胸痛、呼吸困難、心包摩擦音和奇脈,其中心包積液為最常見的表現,縮窄性心包炎亦可見。當腫瘤浸潤心肌導致限制型心肌病時,可出現心力衰竭。心包積液細胞學檢查對診斷意義不大,很難鑒別惡性間皮瘤細胞和反應性細胞。絕大多數心包間皮瘤被誤診為縮窄性心包炎,最后經手術獲得病理組織檢查或尸檢確診。間皮瘤細胞對放療的靈敏度較高,但同時易發生放射性心肌病、慢性心包炎,心功能惡化加速,故不推薦使用[5]。手術切除間皮瘤或聯合心包部分切除僅可以達到緩解癥狀的目的,順鉑和(或)培美曲塞全身化療并不能顯著改善心包間皮瘤患者的預后。另外,對于心包填塞患者,心包積液引流是改善癥狀的有效方法[6]。
本例患者20歲時因確診霍奇金淋巴瘤而行ABVD方案化療和縱隔、雙頸部、雙腋下放療。治療結束后18年出現大量心包積液,心包剝離術后病理檢查確診為惡性心包間皮瘤。從心包間皮瘤發病至死亡,生存期3個月余。該患者臨床分期為ⅡA期,超過3個受侵部位,常規ABVD方案化療4個周期后再給予放療。放化療是導致原發惡性腫瘤的常見病因。射線長期照射導致DNA損傷和突變,在中高劑量輻射下,細胞殺傷作用破壞組織,約束控制變異細胞增殖的效能減低,進而誘導慢性放射損傷(組織凋亡或無序的高增殖)[7]。抗癌藥物在殺死腫瘤細胞的同時,也可殺死正常細胞,或可導致正常細胞癌變。化療藥物致DNA-蛋白質交聯和(或)引起DNA鏈斷裂、細胞轉化、突變及染色體畸變等,破壞血液環境[8]。此外,癌癥患者在接受長期化療的同時,需要進行大劑量激素預處理,兩者都會直接削弱人體免疫功能,導致機體不能有效地抑制其他器官組織發生癌變[9]。本例患者縱隔區域放療,由于受當時技術的限制,定位不夠精確,照射可能影響到心臟。研究發現,放療不但會導致心肌纖維化、心臟傳導系統損害,還可引起心臟瓣膜損傷、纖維化,并可導致冠狀動脈粥樣硬化[10]。Gujral等[11]發現,心臟接受照射劑量每增加1 Gy,患者出現心臟猝死、血流重建以及心肌梗死的概率就增加7.4%。同時ABVD方案中使用的多柔比星具有心臟毒性,會加重心臟損傷。放療聯合化療會增加心臟損傷,也會增加原發性惡性心包間皮瘤的發生率。多項臨床研究及病例報道均提示霍奇金淋巴瘤放療后會提高繼發腫瘤的風險[12-13]。國外也有1例霍奇金淋巴瘤放療后繼發心包間皮瘤的報道[14]。
目前臨床中涉及較多左胸部放療。左側乳腺癌、左肺癌、食管癌、縱隔淋巴瘤、胸腺瘤及左側胸壁轉移瘤的根治或姑息性放療均不可避免地發生照射野與心臟重疊,從而導致心臟損害的發生。放射性心臟損傷的發生與心臟受照射劑量、照射位置、照射技術、單次分割劑量、射線質、是否聯合其他治療等有關。目前并沒有針對病因的特異性治療,預防其發生是最主要的措施[15]。臨床實踐中應注意以下幾點:(1)放射技術的改變,如適形調強放療、呼吸門控技術以及螺旋斷層放療等可降低心臟受照射劑量及體積[15];(2)精確定位,縮小靶區范圍,避免在心臟上出現高劑量熱點,必要時可使用鉛擋塊;(3)要超過心臟耐受劑量,修正單次分割劑量;(4)聯合蒽環類等損害心肌的化療藥時,適當調整化療藥及放療劑量;(5)加用保護心臟藥物治療[16],定期心電圖檢查。但是,單純放療技術的改善并不能完全避免放射性心臟損傷的發生,今后仍需進一步深入探索損傷發生的機制及防護措施,為減輕放射性心臟損傷提供有價值的理論依據。

