適宜內生真菌Epichlo? sinensis生長的碳氮源篩選
王興迪,田 沛
(草地農業生態系統國家重點實驗室/ 蘭州大學農業農村部草牧業創新重點實驗室/蘭州大學草地農業教育部工程研究中心 / 蘭州大學草地農業科技學院,甘肅蘭州 730020)
禾草內生真菌(Grassendophyte)指在禾草體內渡過全部或大部分生活周期,而禾草本身不顯示任何外部癥狀的一大類真菌[1]。目前國內外對禾草內生真菌的研究主要集中在子囊菌門(Ascomycota)麥角科(Clavicipitaceae)的Epichlo?屬[2]。禾草內生真菌與禾草形成互惠共生體,即禾草為內生真菌提供生存空間以及糖類、氨基酸等營養物質以維持其生長,內生真菌通過合成生物堿等次生代謝物來抵御害蟲、家畜等生物對宿主的侵害以及改善禾草對干旱、鹽堿、重金屬等非生物脅迫的抵抗能力[3-5]。內生真菌菌絲體主要集中分布于禾草地上部分[6-8]。且主要依靠種子進行垂直傳播[9-11],其形態特征以及生長特性具有豐富的多樣性[12]。
中華羊茅(Festuca sinensis)是青藏高原草地植被群落中的主要伴生種,在青藏高原有豐富的野生資源分布,具有抗逆性強、適應性廣、適口性好、營養價值高等優良特性,是天然草地改良、退化草地恢復和生態建設中最適宜的優良草種之一[13]。中華羊茅對不良環境如干旱、寒冷及鹽堿脅迫等有較強的抵抗力,已在氣候惡劣的高海拔三江源區引種栽培成功[13]。目前已知中華羊茅多被Epichlo?屬內生真菌侵染,二者形成互惠共生體[14]。大量研究表明,Epichlo?內生真菌可提高宿主中華羊茅在逆境脅迫下的耐受能力[14-17]。干旱脅迫條件下,內生真菌促使中華羊茅地上生物量以及地下生物量增加,促進中華羊茅種子的萌發,提高可溶性糖等滲透調節物質的含量[14]。寒冷脅迫下,內生真菌可提高帶菌中華羊茅種子萌發率,縮短帶菌中華羊茅種子萌發時間[15]。鹽脅迫條件下,內生真菌能夠促進種子萌發與幼苗生長[16]。且帶菌的中華羊茅與其他禾草混播時,內生真菌能增加中華羊茅的競爭力,促進伴生植物的生長,提高草地群落的穩定性[17]。以上研究結果均說明內生真菌的存在對中華羊茅生長過程中的重要性。
目前此內生真菌已被鑒定為Epichlo?sinensis。前人研究已確定E. sinensis有豐富的生物多樣性[18]。楊洋[19]發現分離自同一地區中華羊茅種子中不同的內生真菌菌株,其生長速度、菌落特征和孢子形態存在差異。金文進等[20]研究也發現不同培養基、溫度、pH 以及營養成分均對分布于甘肅的E.sinensis菌株的生長有影響。王美寧[21]發現不同維生素、植物生長調節劑及金屬離子均對分布于5個不同地理區域的中華羊茅內生真菌菌株的生長有影響,且5 個不同地理區域的E. sinensis菌株存在顯著差異。
植物在受到非生物脅迫時,會產生大量的活性氧(reactive oxygen species,ROS)自由基,自由基會損傷蛋白質、DNA 等生物大分子并引起膜脂過氧化,植物可以通過提高自身抗氧化能力來保護細胞免受氧化脅迫的傷害,這也是植物抗非生物脅迫的主要機理之一[22]。研究發現,植物內生真菌是一種具有較大潛力的天然抗氧化劑。高媛等[23]研究發現,疏花水柏枝(Myricaria laxiflora)淹水前根部分離得到的內生真菌SG17具有強抗氧化活性。Tianpanich 等[24]從一株內生真菌(Colletotrichum)分離出的5種化合物均具有良好的抗氧化能力。
綜上所述,目前離體條件下對中華羊茅內生真菌不同菌株生長影響的研究主要集中在不同溫度、pH、維生素、植物生長調節劑及重金屬元素等方面,而不同碳氮源對中華羊茅內生真菌生長及總抗氧化能力的影響鮮見報道。基于此,為進一步篩選出適宜于不同E.sinensis菌株的碳氮源,本研究擬檢測不同碳氮源培養基上從不同生態型中華羊茅宿主中分離的內生真菌的生長情況。
1 材料和方法
1.1 供試材料
1.1.1供試菌株
菌株1分離自甘肅省夏河縣野生中華羊茅種子,菌株41C分離自青海省平安縣野生中華羊茅種子,菌株111C分離自四川省紅原縣野生中華羊茅種子,均由蘭州大學草地農業科技學院草地保護研究所提供,已明確其均為Epichlo? sinensis[25]。各菌株均在馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養基上低溫保存,試驗前接種于新鮮的PDA 培養基上,于(25±1)℃黑暗培養條件下培養28 d 備用。
1.1.2固體培養基制備
基礎成分:去皮馬鈴薯(Solanum tuberosum)200 g 煮汁、磷酸二氫鉀3 g、硫酸鎂1.5 g、瓊脂18 g、水1 000 mL。在基礎培養基中分別添加碳、氮含量等量的碳氮源,即葡萄糖20 g、淀粉29.96 g、麥芽糖33.32 g、甘露醇19.96 g、山梨醇19.96 g 及氯化銨19.10 g、蛋白胨34.48 g、胰蛋白胨36.69 g、酵母浸粉38.12 g、尿素10.72 g(下同),制成不同的碳、氮源培養基[24],分裝入90 mm 直徑的培養皿中,每皿約30 mL,每個菌株每種處理均為5個重復。待培養皿冷卻后,放入一層透氣膜(賽璐玢)。
1.1.3液體培養基的制備
基礎成分:去皮馬鈴薯200 g 煮汁、磷酸二氫鉀3 g、硫酸鎂1.5 g、水1 000 mL。在基礎培養基中分別添加碳、氮含量等量的葡萄糖、淀粉、麥芽糖、甘露醇、山梨醇以及氯化銨、蛋白胨、胰蛋白胨、酵母浸粉、尿素,制成不同的碳、氮源培養基,分裝入250 mL的錐形瓶中,每瓶100 mL,每個菌株每種處理均為5個重復[26]。
1.2 指標測定
1.2.1菌落直徑
將已活化的3株內生真菌菌株用6 mm 打孔器打孔,接于不同碳、氮源固體培養基上,在(25±1)℃黑暗培養條件下培養4周,每周(7 d)用十字法測量菌株直徑。
1.2.2菌落生長速率
菌落生長速率=(菌落菌絲直徑?初始接菌落菌絲直徑)/菌落培養時間[27]。
1.2.3菌絲直徑
在收獲菌絲之前,用膠帶粘貼法獲取菌絲后用熒光顯微鏡(OLYMPUS,BX51)直接測量菌絲直徑。
1.2.4菌絲生物量
揭開透氣膜,用解剖刀將菌絲輕輕刮取,放入Eppendorf 管中,稱量鮮重。
1.2.5總抗氧化能力測定
將已活化的3株內生真菌菌株用6 mm 打孔器打孔,接于不同碳、氮源液體培養基中,在(25±1)℃、148 r·min?1搖床上培養3 周,使用總抗氧化能力(total antioxidant capacity,T-AOC)試劑盒測定(南京建成生物工程有限公司),發酵菌懸液過濾菌體,濾液10 000 r·min?1離心10 min,將所獲得的上清液按照試劑盒內置的方法反應,在波長520 nm 處測定吸光 值。計算公式 如 下:T?AOC(U·mL?1) =(ODU–ODC)/N×0.3;式中:ODU(optical density unit)為測定樣品吸光度值,ODC(optical density contrast)為對照吸光度值,N為反應液總體積/取樣量[21]。
1.3 統計分析
采用SPSS 25.0軟件對所測數據進行統計分析,用平均值± 標準誤表示測定結果,分別對同一菌株不同碳氮源處理、同一碳氮源處理不同菌株處理進行單因素方差分析;采用Excel 2010制圖。
2 結果與分析
2.1 不同碳源對Epichlo? sinensis 生長的影響
2.1.1不同碳源對Epichlo? sinensis菌落直徑的影響
3株Epichlo? sinensis在不同碳源條件下的菌落直徑存在不同差異,其中6種碳源處理條件下,菌株111C 的菌落直徑均顯著高于菌株41C和菌株1(P<0.05)(表1)。以葡萄糖為碳源時,3株菌株的菌落直徑間均有顯著差異(P<0.05),且菌落直徑表現為111C>1 >41C;在以山梨醇為碳源時,3株菌株的菌落直徑間也均有顯著差異(P<0.05),且菌落直徑表現為111C>41C>1;以麥芽糖、淀粉、甘露醇為碳源的處理條件下,111C的菌落直徑顯著大于菌落41C和1(P<0.05),但菌落41C和菌落1之間差異不顯著(P>0.05)。

表1 不同碳源條件下Epichlo? sinensis 生長4周的菌落直徑、菌絲直徑和菌絲鮮重Table 1 Colony diameters,hypha diametersand mycelium biomass of Epichlo? sinensis grown using different carbon sourcesfor 4 weeks
不同碳源對3株內生真菌菌株的菌落直徑均有明顯影響(表1)。菌株1在有葡萄糖、麥芽糖的培養基上的菌落直徑顯著高于其他成分培養基(P<0.05),而有淀粉、甘露醇的培養基上的菌落直徑顯著高于山梨醇培養基(P< 0.05)。菌株41C在有麥芽糖的培養基上的菌落直徑顯著高于甘露醇、葡萄糖培養基(P<0.05),而這3種碳源培養基上的菌落直徑與淀粉、山梨醇培養基之間差異不顯著(P>0.05)。菌株111C在有淀粉的培養基上的菌落直徑顯著高于山梨醇培養基(P<0.05),而這兩種碳源培養基上的菌落直徑與甘露醇、麥芽糖、葡萄糖培養基之間差異不顯著(P> 0.05)。
2.1.2不同碳源對Epichlo? sinensis菌絲直徑的影響
3株Epichlo? sinensis菌株在不同碳源條件下的菌絲直徑存在明顯差異(表1)。3株菌株的菌絲直徑在以淀粉、麥芽糖、甘露醇、山梨醇為處理的條件下,菌株1、41C的菌絲直徑顯著高于111C(P<0.05);以葡萄糖為處理的條件下,菌株41C 的菌絲直徑顯著高于菌株1、111C(P<0.05)。
不同碳源對3株內生真菌菌株的菌絲直徑均有明顯影響(表1)。菌株1的菌絲直徑在不同碳源培養基上有顯著差異(P<0.05),而有甘露醇的培養基上的菌絲直徑顯著高于其他4種培養基(P<0.05),而有淀粉、山梨醇的培養基上的菌絲直徑顯著高于麥芽糖、葡萄糖培養基(P< 0.05)。菌株41C的菌絲直徑在不同碳源培養基上有顯著差異(P<0.05),有葡萄糖、甘露醇培養基上的菌絲直徑顯著高于淀粉、山梨醇、麥芽糖培養基(P<0.05)。菌株111C的菌絲直徑在不同碳源培養基上有顯著差異(P<0.05),在有甘露醇、山梨醇、葡萄糖的培養基上的菌絲直徑顯著高于麥芽糖、淀粉培養基(P<0.05),而有淀粉的培養基上的菌絲直徑顯著低于麥芽糖培養基(P< 0.05)。
2.1.3不同碳源對Epichlo? sinensis菌絲鮮重的影響
3株Epichlo? sinensis菌株在不同碳源條件下的菌絲鮮重存在明顯差異(表1)。3株菌株的菌絲鮮重在以淀粉、甘露醇、山梨醇為處理的條件下均有顯著差異(P< 0.05),且菌絲鮮重表現為111C > 41C >1;以葡萄糖、麥芽糖為處理的條件下,111C 的菌絲鮮重顯著大于菌株41C和1(P< 0.05)。
不同碳源對3株內生真菌菌株的菌絲鮮重均有明顯影響(表1)。菌株1的菌絲鮮重在不同固體培養基上有顯著差異(P<0.05),在有葡萄糖的培養基上的菌絲鮮重顯著高于其他4種培養基(P<0.05),而有山梨醇、麥芽糖的培養基上的菌絲鮮重顯著高于淀粉培養基(P< 0.05)。菌株41C的菌絲鮮重在不同固體培養基上有顯著差異(P<0.05),在有葡萄糖培養基上的菌絲鮮重顯著高于其他4種培養基(P<0.05),而有甘露醇、山梨醇的培養基上的菌絲鮮重顯著高于麥芽糖、淀粉培養基(P<0.05),且在有麥芽糖培養基上的菌絲鮮重顯著高于淀粉培養基(P<0.05)。菌株111C的菌絲鮮重在不同碳源培養基上有顯著差異(P<0.05),在有麥芽糖的培養基上的菌絲鮮重顯著高于其他4種培養基(P<0.05),而有甘露醇、葡萄糖的培養基上的菌絲鮮重顯著高于淀粉、山梨醇培養基(P< 0.05)。
2.1.4不同碳源對中華羊茅內生真菌總抗氧化能力的影響
3株Epichlo? sinensis菌株在不同碳源條件下的總抗氧化能力存在明顯差異(P<0.05)(圖1)。在以葡萄糖、淀粉為碳源的條件下,3株菌株的總抗氧化能力均有顯著差異(P<0.05),且總抗氧化能力表現為111C>1 >41C;以麥芽糖、甘露醇、山梨醇為碳源的條件下,菌株111C的總抗氧化能力顯著高于菌株1和41C(P< 0.05)。
不同碳源對3株內生真菌菌株的總抗氧化能力均有不同影響(圖1)。菌株1的總抗氧化能力在不同碳源發酵液中均無顯著差異(P<0.05)。菌株41C在麥芽糖發酵液中的總抗氧化能力顯著高于葡萄糖、淀粉發酵液(P<0.05)。菌株111C在葡萄糖、麥芽糖發酵液中總抗氧化能力顯著高于淀粉、山梨醇發酵液(P<0.05),在甘露醇發酵液中總抗氧化能力則與上述4種發酵液間無顯著差異(P>0.05)。
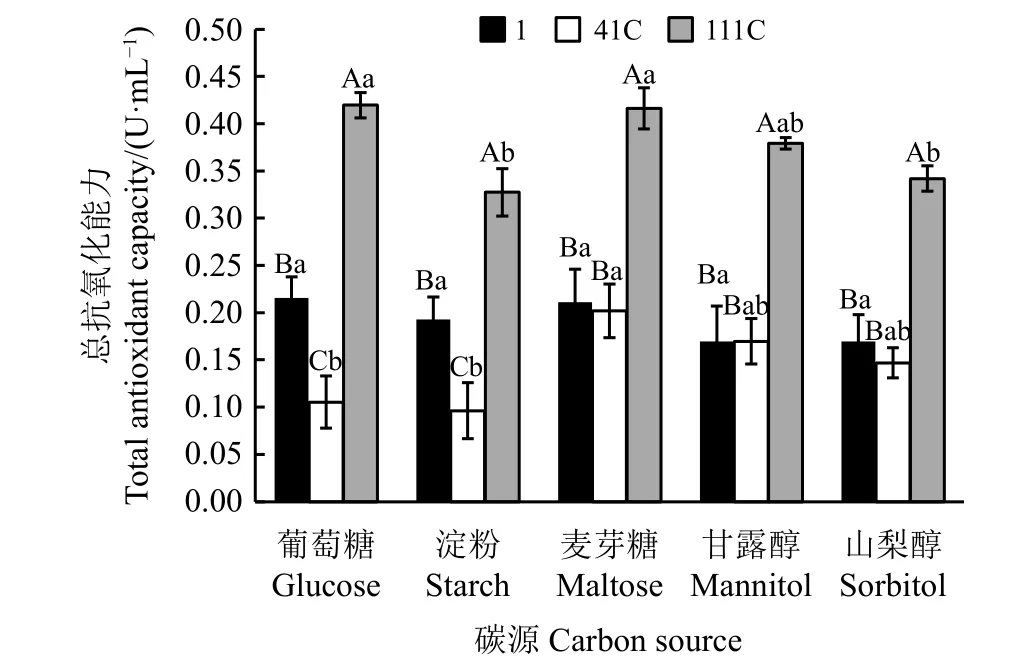
圖1 不同碳源條件下Epichlo? sinensis菌株的發酵液的總抗氧化能力Figure1 Total antioxidant capacitiesof fermented extractsof Epichlo? sinensis grown using different carbon sources
2.2 不同氮源對Epichlo? sinensis 生長的影響
2.2.1不同氮源對Epichlo? sinensis菌落直徑的影響
3株Epichlo? sinensis菌株在不同氮源條件下的菌落直徑存在明顯差異(P<0.05),其中3株中華羊茅菌株在以尿素為氮源時均不生長,且菌株111C的菌落直徑在除尿素外的不同氮源條件下均顯著高于菌株41C和1(P<0.05)(表2)。在以胰蛋白胨、氯化銨和酵母浸粉為處理的條件下,3株菌株的菌落直徑均有顯著差異(P<0.05),且菌落直徑表現為111C>41C>1;以蛋白胨為處理的條件下,111C的菌落直徑顯著大于菌落41C和1(P< 0.05)。
氮源對3株內生真菌菌株的菌落直徑均有明顯影響(P< 0.05),3株菌株均不能吸收利用尿素(表2)。菌株1和41C的菌落直徑在除尿素外的不同氮源培養基上有顯著差異(P<0.05),在有胰蛋白胨的培養基上的菌落直徑均顯著高于其余4種培養基(P<0.05),其余4種有蛋白胨、氯化銨、酵母浸粉和尿素的培養基上菌落直徑均有顯著差異(P<0.05),菌株1 和41C的菌落直徑表現為胰蛋白胨>蛋白胨> 氯化銨>酵母浸粉> 尿素。菌株111C的菌落直徑則表現為胰蛋白胨>蛋白胨>酵母浸粉>氯化銨>尿素。
2.2.2不同氮源對Epichlo? sinensis菌絲直徑的影響
3株Epichlo? sinensis菌株在除尿素外的不同氮源條件下的菌絲直徑存在明顯差異(表2)。3株菌株的菌絲直徑在以氯化銨、胰蛋白胨、蛋白胨為氮源的條件下均無顯著差異(P>0.05),且以氯化銨為氮源時菌絲直徑表現為41C> 1>111C、以蛋白胨為氮源時菌絲直徑表現為41C > 111C>1、以胰蛋白胨為氮源時菌絲直徑表現為111C> 1>41C,以酵母浸粉為氮源的條件下,菌株1和41C的菌絲直徑顯著高于菌株111C(P< 0.05)。

表2 不同氮源條件下Epichlo? sinensis 生長4周的菌落直徑Table 2 Colony diameters,hypha diametersand mycelium biomass of Epichlo? sinensis grown using different nitrogen sourcesfor 4 weeks
不同氮源對3株內生真菌菌株的菌絲直徑均有明顯影響(表2)。菌株1的菌絲直徑在不同氮源培養基上有顯著差異(P<0.05),在有酵母浸粉的培養基上的菌絲直徑顯著高于其他成分培養基(P<0.05),而有氯化銨的培養基上的菌絲直徑顯著高于蛋白胨、胰蛋白胨培養基(P<0.05)。菌株41C的菌絲直徑在不同氮源培養基上有顯著差異(P<0.05),有酵母浸粉、氯化銨的培養基上的菌絲直徑顯著高于其他2種培養基(P<0.05),而在有蛋白胨的培養基上的菌絲直徑顯著高于胰蛋白胨培養基(P<0.05)。菌株111C的菌絲直徑在不同氮源培養基上有顯著差異(P<0.05),有酵母浸粉、氯化銨的培養基上的菌絲直徑顯著高于蛋白胨、胰蛋白胨培養基(P< 0.05)。
2.2.3不同氮源對Epichlo? sinensis菌絲鮮重的影響
3株Epichlo? sinensis菌株在不同氮源條件下的菌絲鮮重存在明顯差異(表2)。3株菌株的菌絲鮮重在以胰蛋白胨、氯化銨為處理的條件下,3株菌株的菌絲鮮重均有顯著差異(P<0.05),且菌絲鮮重表現為111C >1>41C;以酵母浸粉為處理的條件下,3 株菌株的菌絲鮮重均有顯著差異(P<0.05),且菌絲鮮重表現為111C>41C>1;以蛋白胨為處理的條件下,菌株111C的菌絲鮮重顯著大于菌株1和41C(P< 0.05)。
不同氮源對3株內生真菌菌株的菌絲鮮重均有明顯影響(表2)。菌株1的菌絲鮮重在不同氮源培養基上有顯著差異(P<0.05),在有胰蛋白胨的培養基上的菌絲鮮重顯著高于其他3種培養基(P<0.05),而有蛋白胨的培養基上的菌絲鮮重顯著高于酵母浸粉、氯化銨培養基(P<0.05)。菌株41C的菌絲鮮重在不同固體培養基上有顯著差異(P<0.05),在有酵母浸粉、胰蛋白胨、蛋白胨的培養基上的菌絲鮮重顯著高于氯化銨培養基(P<0.05)。菌株111C 的菌絲鮮重在不同固體培養基上有顯著差異(P<0.05),在有胰蛋白胨的培養基上的菌絲鮮重顯著高于其他3種培養基(P<0.05),而有蛋白胨的培養基上的菌絲鮮重顯著高于酵母浸粉和氯化銨培養基上的(P<0.05)。
2.2.4不同氮源對Epichlo? sinensis總抗氧化能力的影響
3株Epichlo? sinensis菌株在不同氮源條件下的總抗氧化能力存在明顯差異(圖2)。在以尿素、氯化銨、酵母浸粉為氮源的條件下,3株菌株的總抗氧化能力均有顯著差異(P<0.05),且總抗氧化能力均表現為111C>1>41C。在以蛋白胨為氮源的條件下,菌株1的總抗氧化能力顯著高于菌株111C和41C(P<0.05)。在以胰蛋白胨為氮源的條件下,菌株1、111C 的總抗氧化能力顯著高于菌株41C(P<0.05)。
不同氮源對3株內生真菌菌株的總抗氧化能力均有明顯影響(P<0.05) (圖2)。菌株1的總抗氧化能力在不同氮源發酵液中有顯著差異(P<0.05),在有酵母浸粉的發酵液中的總抗氧化能力顯著高于其他成分發酵液(P<0.05),而在有尿素的發酵液中的總抗氧化能力顯著高于胰蛋白胨、氯化銨發酵液(P<0.05)。菌株41C的總抗氧化能力在不同氮源發酵液中有顯著差異(P<0.05),在有酵母浸粉的發酵液中的總抗氧化能力顯著高于其他成分發酵液(P<0.05),在有尿素、蛋白胨的發酵液中的總抗氧化能力顯著高于胰蛋白胨、氯化銨發酵液(P<0.05),且在有胰蛋白胨、氯化銨的發酵液中的總抗氧化能力均差異顯著(P<0.05)。菌株111C的總抗氧化能力在不同氮源發酵液中均有顯著差異(P<0.05),總抗氧化能力表現為酵母浸粉> 尿素> 胰蛋白胨 > 蛋白胨> 氯化銨。

圖2 不同氮源條件下Epichlo? sinensis菌株的發酵液的總抗氧化能力Figure 2 Total antioxidant capacities of fermented extracts of Epichlo? sinensis grown using different nitrogen sources
3 討論與結論
Epichlo?內生真菌通過促進宿主中華羊茅地上、地下生物量增加以及提高可溶性滲透調節物質含量、植物激素含量等來增強中華羊茅逆境脅迫的抗性[14-17]。因此內生真菌的生長和代謝在中華羊茅生長發育中發揮著重要作用。碳氮源是內生真菌生長所需的最基本營養因子,對其研究具有重要意義。Kulkarni 和Nielsen[28]研究發現在不同碳源及氮源條件下,高羊茅(Festuca arundinacea)內生真菌的菌落直徑存在差異,該內生真菌在以甘露醇為碳源、胰蛋白胨為氮源的條件下生長的最好。Li 等[29]亦發現醉馬草(Achnatherum inebrians)內生真菌對10種碳源和11種氮源的利用能力各不相同,其中蔗糖是最容易利用的碳源,酵母浸膏是最容易利用的氮源。本研究發現,碳源中菌株1和41C對葡萄糖的利用能力最強,111C對麥芽糖的利用能力最強;氮源中,3株E. sinensis菌株均對胰蛋白胨的利用能力最強。3株E. sinensis菌株在以尿素為氮源的發酵液上均不能正常生長,說明E. sinensis基本上不能以尿素作為氮源。
內生真菌有嚴格的寄主特異性,即同一種宿主植物中分離出的內生真菌為同一種,但是從不同生態型宿主分離出的內生真菌的形態特征以及生長特性具有豐富的多樣性[12]。楊洋[19]從采自甘肅甘南的中華羊茅種子中分離出48株內生真菌,在菌株培養的過程中發現48株內生真菌的生長速度、菌落特征和孢子形態存在差異。王美寧[21]對不同地理區域采集的中華羊茅種子中分離出的5株內生真菌在添加維生素、植物生長調節劑及金屬離子的條件下進行培養,發現從不同地理區域中華羊茅種子中分離出的內生真菌菌株在每個處理條件下存在顯著差異。本研究選取從3個不同生態型中華羊茅種子中分離出的內生真菌,以進一步明確宿主生態型對E. sinensis最適碳氮源選擇的影響。結果發現,3 株E. sinensis在最適碳氮源的選擇上僅菌株111C 的最適碳源與其他菌株不同,說明宿主生態型對E. sinensis最適碳氮源的選擇影響不大。
此外,內生真菌是一種具有較大潛力的天然抗氧化劑。王夢亮等[30]研究2株紅景天(Sedum rosea)內生真菌的抗氧化活性,發現2株內生真菌發酵物的1,1-二苯基-2-三硝基苯肼(DPPH,1,1-Diphenyl-2-Picrylhydrazyl)自由基清除能力、羥基自由基清除能力、超氧陰離子清除能力較強。劉雅莉等[31]研究21株蒺藜(Tribulus terrestris)內生真菌的抗氧化與自由基清除能力,發現21株內生真菌的發酵物均具有一定的抗氧化作用。本研究結果表明,3株E.sinensis菌株均有一定的抗氧化能力,菌株111C的總抗氧化能力最強。在不同碳源條件下,不同菌株的總抗氧化能力差異不顯著,說明碳源對E.sinensis的總抗氧化能力影響不大。在不同氮源條件下,不同菌株的總抗氧化能力亦有差異,3株內生真菌均在以酵母浸粉為氮源的條件下,總抗氧化能力最強。而E. sinensis產生抗氧化能力的原因尚未明確,下一步應致力于研究E. sinensis內生真菌的發酵產物,探究其產生抗氧化能力的原因。

