轉基因作物中CaMV 35S序列信號雙重放大的電化學基因傳感方法
鄭海松,謝晶琦,孫娟娟,葉永康,操小棟*
(1.合肥海關技術中心,安徽 合肥 230022;2.合肥工業大學 食品與生物工程學院,安徽 合肥 230009)
轉基因作物在全球種植面積逐年增加,越來越多的轉基因作物被批準用于食品、飼料和其它工業品(如紡織品、藥品及塑料制品等)的加工。同時,轉基因產品因對人類或動物可能帶來潛在的健康威脅及對環境和生態帶來風險而在全球范圍內引起廣泛的爭議。為了應對轉基因技術存在的潛在風險,回應公眾的關注,保證國際貿易順利進行,我國2017年最新修訂的《農業轉基因生物標識管理辦法》對目錄上所列的轉基因生物采取強制標注,以加強對轉基因生物的監管,保證消費者的基本權利。其中,轉基因成分的檢測和識別是其中的重要組成部分[1]。轉基因植物中普遍含有外源基因如花椰菜花葉病毒35S(CaMV 35S)啟動子、根癌農桿菌終止子(Terminator nopaline synthase,tNOS)或其他特定目標基因序列等。針對這些特定序列,聚合酶鏈反應(PCR)方法具有高靈敏度和高穩定性,是轉基因生物檢測的首選方法[2],但該方法較為復雜,檢測成本偏高和耗時長[3]。其他常用方法有酶聯免疫吸附測定[4]、新一代測序[5]、基因芯片[6]和電化學分析[7]等。其中,電化學基因傳感器因其成本低廉,配套儀器易于小型化、微型化,是快速檢測轉基因生物較為理想的選擇。
為提高靈敏度和選擇性,電化學傳感器表面修飾的納米材料如非金屬納米材料[8-10]和金屬/金屬氧化物納米材料[11-13],因其比表面積大、電子傳輸效率高而受到青睞。其中,石墨烯材料因具有良好的導電性和巨大的比表面積,在電化學傳感器中有著廣泛的應用前景。為了克服溶劑中石墨烯納米片層在范德華力作用下重新聚集從而限制了其有效表面積[14],研究人員利用血紅素(Hemin)與石墨烯片層通過π-π非共價結合形成具有氧化還原活性兼備石墨烯固有性質的納米復合材料[15-16]。此外,金屬納米粒子如金納米粒子(AuNP)因具有較大的比表面積,且可方便地利用Au―S鍵固定巰基化核酸探針等生物材料[17],常作為信號標簽或信號標簽載體[18-19]。硫堇(Thi)是電活性小分子,可通過靜電吸附在電性相反的AuNP表面[20],從而導致電流響應的顯著增大。
本研究首先制備了AuNP/Hemin-rGO修飾玻碳電極,然后通過巰基化捕獲序列在修飾電極表面AuNP上自組裝后,再與目標序列雜交。隨后,以5'-SH標記的第三條輔助序列與目標序列雜交形成“三明治”結構,通過Au―S鍵共價結合AuNP并預富集Thi以放大電流響應,實現了電化學雙重信號放大,以用于轉基因植物中CaMV 35S啟動子目標序列的超靈敏檢測(見圖1)。
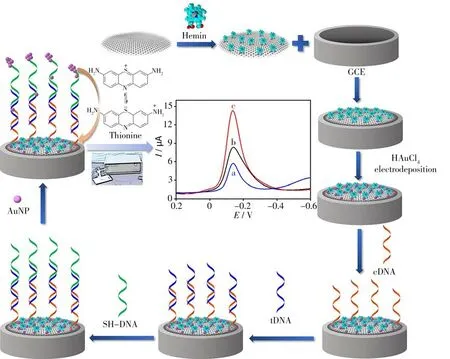
圖1 雙重放大基因傳感器檢測轉基因CaMV 35S序列的示意圖Fig.1 Schematic diagram of duo-amplification genosensor for detection of transgenic CaMV 35S sequence
1 實驗部分
1.1 試劑與材料
氧化石墨(GO,南京濟倉納米科技有限公司);Thi(85%)、Hemin(95%),購自美國Sigma-Aldrich公司;NH2NH2·H2O、HAuCl4·4H2O(分析純,國藥集團化學試劑公司);三(羥甲基)氨基甲烷(Tris,99%)、十二烷基硫酸鈉(SDS,95%)、乙二胺四乙酸二鈉鹽(EDTA,99%),購自北京Solarbio科技有限公司;Invitrogen TRIzol分離試劑(美國ThermoFisher公司)。用TE緩沖溶液(10 mmol/L Tris-HCl,1.0 mmol/L EDTA,pH 8.0)制備濃度為1.0×10-4mol/L的所有寡核苷酸儲備溶液保存至冰箱。實驗所用緩沖液如下:電化學測試溶液(0.1 mol/L磷酸鹽緩沖液,pH 7.4),雜交緩沖溶液(10 mmol/L Tris-HCl,1.0 mmol/L EDTA,50 mmol/L NaCl,pH 7.4)。其他化學品均為分析級,實驗用水均為超純水。
CaMV 35S啟動子基因作為DNA靶序列。寡核苷酸序列由上海生工合成,其序列如下:
捕獲序列(pDNA,S1):5'-SH-TAC GTT ATC AGA CTG ATG ATG A-3'。
互補序列(cDNA,S2):5'-ATG CAA TAG TCT GAC TAC TAC T-3'。
單堿基錯配序列(Mis-1):5'-ATGTAA TAG TCT GAC TAC TAC T-3'。
三堿基錯配序列(Mis-3):5'-ATGTAA TGG TCT GTC TAC TAC T-3'。
1.2 儀器與方法
用JEM-2100F(JEOL)在200 kV加速電壓下獲得場發射透射電子顯微鏡(TEM)圖像;在ESCALAB250 X射線光電子能譜儀(ThermoFisher)上完成X射線光電子能譜(XPS)分析;以修飾玻碳電極(GCE,φ3 mm)為工作電極,Ag/AgCl電極為參比電極,鉑絲電極為輔助電極的三電極體系在CHI832D電化學工作站(上海辰華儀器有限公司)上進行循環伏安法(CV)和示差脈沖伏安法(DPV)實驗。
1.3 Hemin-rGO、AuNP納米復合物的制備
1.3.1 AuNP的制備 根據先前報道的方法制備AuNP[21]:將10.0 mL的38.8 mmol/L檸檬酸鈉加入沸騰的100 mL 0.01%的HAuCl4溶液,劇烈攪拌至酒紅色。繼續攪拌溶液直至室溫。
1.3.2 Hemin-rGO和rGO的制備 rGO通過改進的Hummers方法合成[22]。通過超聲波剝離氧化石墨(1.0 mg/mL)24 h后,將得到的棕色分散體離心(3 000 r/min,30 min)從而制得GO納米片,隨后透析1周以除去小分子。Hemin-rGO的制備[23]:將GO分散體(10 mL,0.5 mg/mL)與Hemin水溶液(10 mL,用0.1 mol/L NaOH溶解至0.5 mg/mL)和氨溶液(100μL,28%)混合,接著加入水合肼(20μL,25%),劇烈攪拌30 min后,置于60℃水浴中24 h。多次洗滌離心得到黑色的Hemin-rGO納米復合材料。除了加入Hemin之外,rGO的制備與Hemin-rGO的步驟相同。
1.4 DNA傳感界面的構建
將5μL Hemin-rGO溶液(0.5 mg/mL)均勻滴涂在處理光滑的GCE上,干燥后得到Hemin-rGO/GCE。通過在含有0.1 mol/L KNO3的3 mmol/L HAuCl4溶液中電沉積(-0.2 V,100 s)得到AuNP/Hemin-rGO/GCE[24]。隨后,浸入5μL 10μmol/L巰基化S1,室溫下溫育過夜后,用0.1%SDS溶液、Tris-HCl溶液和水依次洗滌電極以除去未自組裝的S1,得到S1/AuNP/Hemin-rGO/GCE。
1.5 核酸序列雜交和電化學信號的放大
將S1/AuNP/Hemin-rGO/GCE置于不同濃度S2的雜交緩沖液中,37℃溫育90 min后,淋洗以去除未雜交的S2(如“1.4”所述),得到S2/S1/AuNP/Hemin-rGO/GCE。然后,將5μL巰基化的S3滴加到電極表面并溫育2 h,淋洗后得到S3/S2/S1/AuNP/Hemin-rGO/GCE。再將該電極避光浸泡在AuNP溶液中40 min,得到AuNP/S3/S2/S1/AuNP/Hemin-rGO/GCE,經水沖洗后,插入0.5 mmol/L Thi溶液避光放置15 min,使Thi與AuNP結合。最后用水淋洗電極后待用。
1.6 樣品的制備和PCR對照
轉基因擬南芥樣品用TRIzol試劑提取總RNA后,應用逆轉錄方法獲得cDNA。在含有1μL cDNA,0.4μL 10μmol/L每種引物,0.2μL Premix Taq和17.2μL水,且終體積為20μL的溶液中進行PCR擴增。tDNA首先在94℃預變性5 min,然后是94℃、30 s(變性),51℃、30 s(退火),72℃、40 s(延伸)和最后5 min延伸的40個循環。取10μL PCR產物進行1%瓊脂糖凝膠電泳(電泳條件為80 V,30 min)。另外,將得到的PCR產物在100℃水浴中加熱7 min后立即冰水浴5 min以獲得解旋的ssDNA,最后利用已制備好的電化學基因傳感器,在最優的雜交及檢測條件下進行電化學檢測。
2 結果與討論
2.1 Hemin-rGO和AuNP納米復合材料的表征
采用TEM對rGO、Hemin-rGO和AuNP納米復合材料進行表征。可觀察到,rGO為輕微皺紋的片狀(圖2A),Hemin-rGO納米片與rGO相比無顯著差異(圖2B),表明Hemin-rGO保持了rGO原有的片層結構。所制備的AuNP呈顆粒狀(圖2C)。

圖2 rGO(A)、Hemin-rGO(B)及AuNP(C)的TEM圖像Fig.2 TEM images of rGO(A),Hemin-rGO(B)and AuNP(C)
采用XPS譜圖對GO、rGO、Hemin-rGO復合材料進行考察,計算出GO、rGO、Hemin-rGO中C與O原子比(C/O)分別為0.759、1.814、2.06,推測可能由于化學還原反應導致rGO中C/O值增加,而Hemin的加入進一步增加了復合材料的還原能力。Hemin-rGO在711.88 eV(Fe2p3/2)和725.63 eV(Fe2p1/2)處的Fe2p帶也證明Hemin已成功修飾,與文獻[25]報道的Hemin結合能712.5 eV(Fe2p3/2)和726.3 eV(Fe2p1/2)相比,有0.7 eV的轉移,表明Hemin與rGO納米片之間存在相互作用。
2.2 修飾電極的電化學行為
采用CV和DPV法表征了電極在0.1 mol/L pH 7.4的磷酸鹽緩沖溶液中的修飾過程,如圖3所示。裸GCE無氧化還原峰(曲線a);Hemin-rGO修飾后充電電流顯著增加并可觀察到明顯的氧化還原峰(曲線b);當AuNP電沉積在Hemin-rGO修飾電極上時,由于AuNP促進了電子傳輸(曲線c),峰電流進一步增加;巰基化捕獲探針自組裝到AuNP/Hemin-rGO表面后阻礙了電子轉移,峰電流下降(曲線d);當S1/AuNP/Hemin-rGO/GCE與tDNA(S2,1×10-15mol/L)雜交后(曲線e),電流稍有增加,可能是雜交減少了S1的空間位阻;當S2/S1/AuNP/Hemin-rGO/GCE與輔助DNA序列(S3)雜交后,峰電流減少(曲線f);當S3/S2/S1/AuNP/Hemin-rGO/GCE富集AuNP時,電流無明顯變化(曲線g),這可能由于空間位阻和轉移電子能力的綜合影響;但當硫堇分子負載在AuNP后,可導致氧化、還原電流顯著增加,且峰電位向平衡電位移動(曲線h)。DPV的實驗結果和CV一致。可見,傳感器組裝并通過DNA雜交鏈吸附AuNP后可負載硫堇分子,且電流響應顯著增加,達到放大該基因傳感器檢測CaMV 35S目標序列電化學信號的目的。
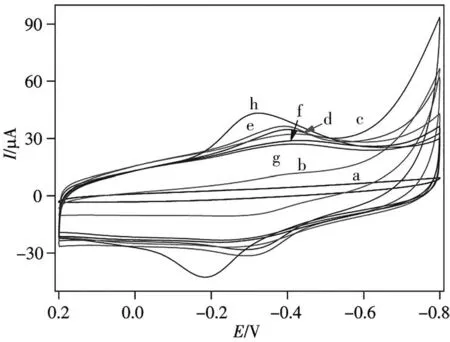
圖3 CaMV 35S基因傳感器組裝過程的CV圖Fig.3 CV curves of step by step preparation of CaMV 35S genosensora.bare GCE;b.Hemin-rGO/GCE;c.AuNP/Hemin-rGO/GCE;d.S1/AuNP/Hemin-rGO/GCE;e.S2/S1/AuNP/He?min-rGO/GCE;f.S3/S2/S1/AuNP/Hemin-rGO/GCE;g.AuNP/S3/S2/S1/AuNP/Hemin-rGO/GCE;h.Thi/AuNP/S3/S2/S1/AuNP/Hemin-rGO/GCE;phosphate buffer:0.1 mol/L,pH 7.4;concentration of S2:1×10-15 mol/L
2.3 CaMV 35S基因傳感器的電化學信號放大
在0.1 mol/L pH 7.4的磷酸鹽緩沖溶液中,采用DPV方法考察了不同傳感器各組成部分對其分析性能的影響。從圖4A可以看出,如果在組裝階段略過Hemin-rGO修飾,那么在預富集AuNP后的S3/S2/S1/AuNP/GCE上核酸雜交的電化學信號很小,電流響應僅約4.948μA(cDNA為1.0×10-12mol/L)(圖4A曲線a)。如果缺少核酸序列頂端巰基AuNP預富集Thi的步驟,雖然在AuNP/S3/S2/S1/AuNP/Hemin-rGO/GCE基因傳感器上也觀察到Thi的還原峰,但其峰電流增加不明顯(約為7.549μA,圖4A曲線b)。而同時預富集AuNP以及修飾了Hemin-rGO后,因為雜交后預富集的AuNP可吸附更多的Thi分子,同時Hemin-rGO的優異電子傳遞能力及較大表面積可進一步有效放大AuNP/S3/S2/S1/AuNP/Hemin-rGO/GCE上雜交的電化學信號(約12.74μA,曲線c),從而達到雙重放大的目的。圖4B可以看出(曲線a),即使無tDNA時,S1/AuNP/Hemin-rGO/GCE上仍然存在一個較弱的DPV峰(5.168μA),這可能是由于帶正電荷的Thi分子吸附在含有AuNP的電極上,導致背景信號產生。與圖4A曲線a的峰電流接近,因此推測其也僅為背景電流,而非CaMV 35S目標核酸序列產生的電化學信號。而在組裝完全的CaMV 35S基因傳感器上可得到一個被雙重放大的峰電流信號(圖4B曲線b)。
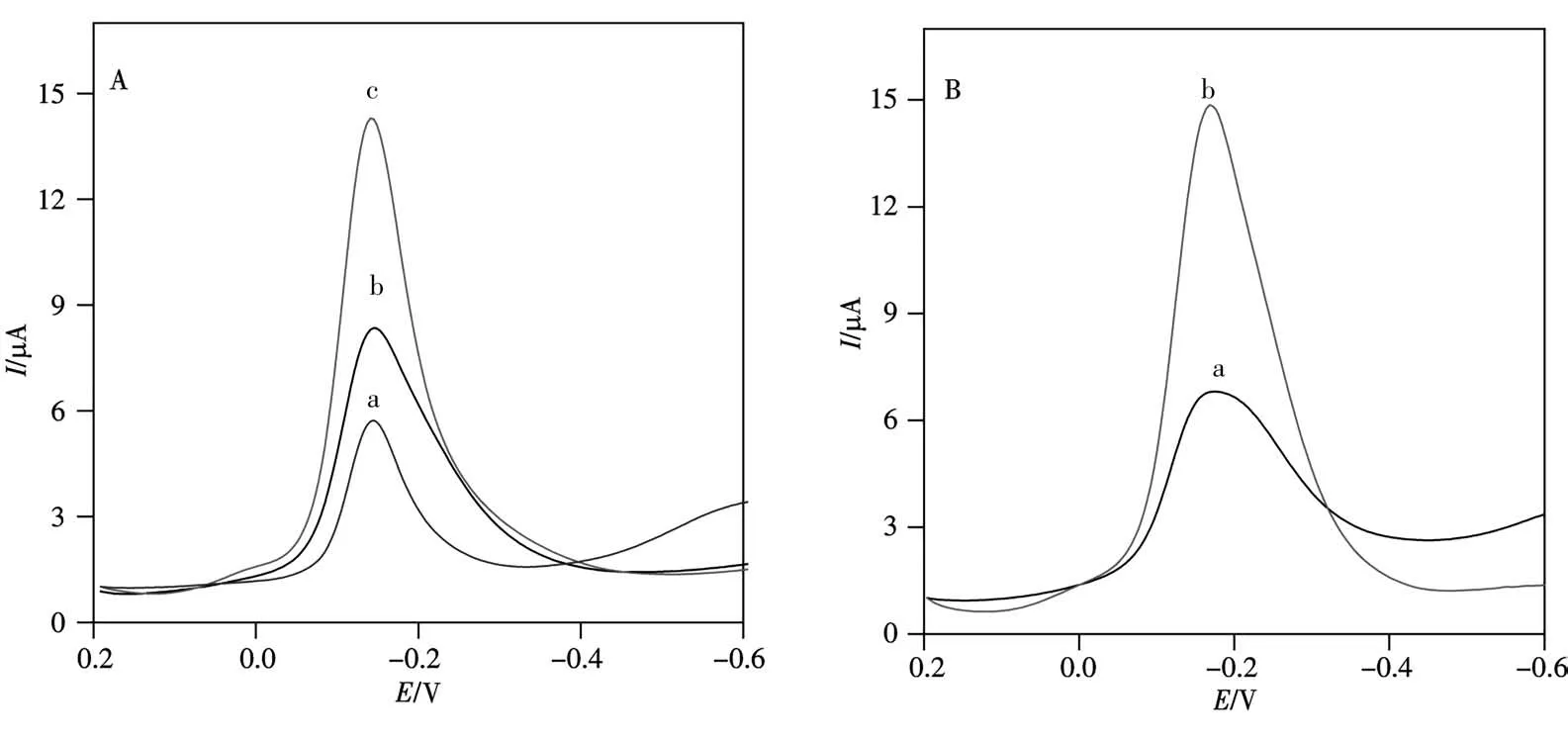
圖4 雙重信號放大的可行性Fig.4 Feasibility of signal duo-amplificationA.DPV curves of without Hemin-rGO(a),AuNP without Thi(b),with Hemin-rGO and AuNP-thionine(c);B.DPV curves of absence(a)and presence(b)of 1.0×10-12 mol/L target DNA in phosphate buffer(0.1 mol/L,pH 7.4)
2.4 CaMV 35S序列檢測條件的優化
為了使該CaMV 35S基因傳感器達到最優檢測性能,對測試底液pH值、Thi濃度、吸附AuNP的時間以及DNA序列雜交時間進行優化。結果如圖5所示,最優測試條件為:pH 7.4(圖5A);0.5 mmol/L Thi(圖5B);吸附AuNP的時間為40 min(圖5C);DNA雜交時間為60 min(圖5D)。
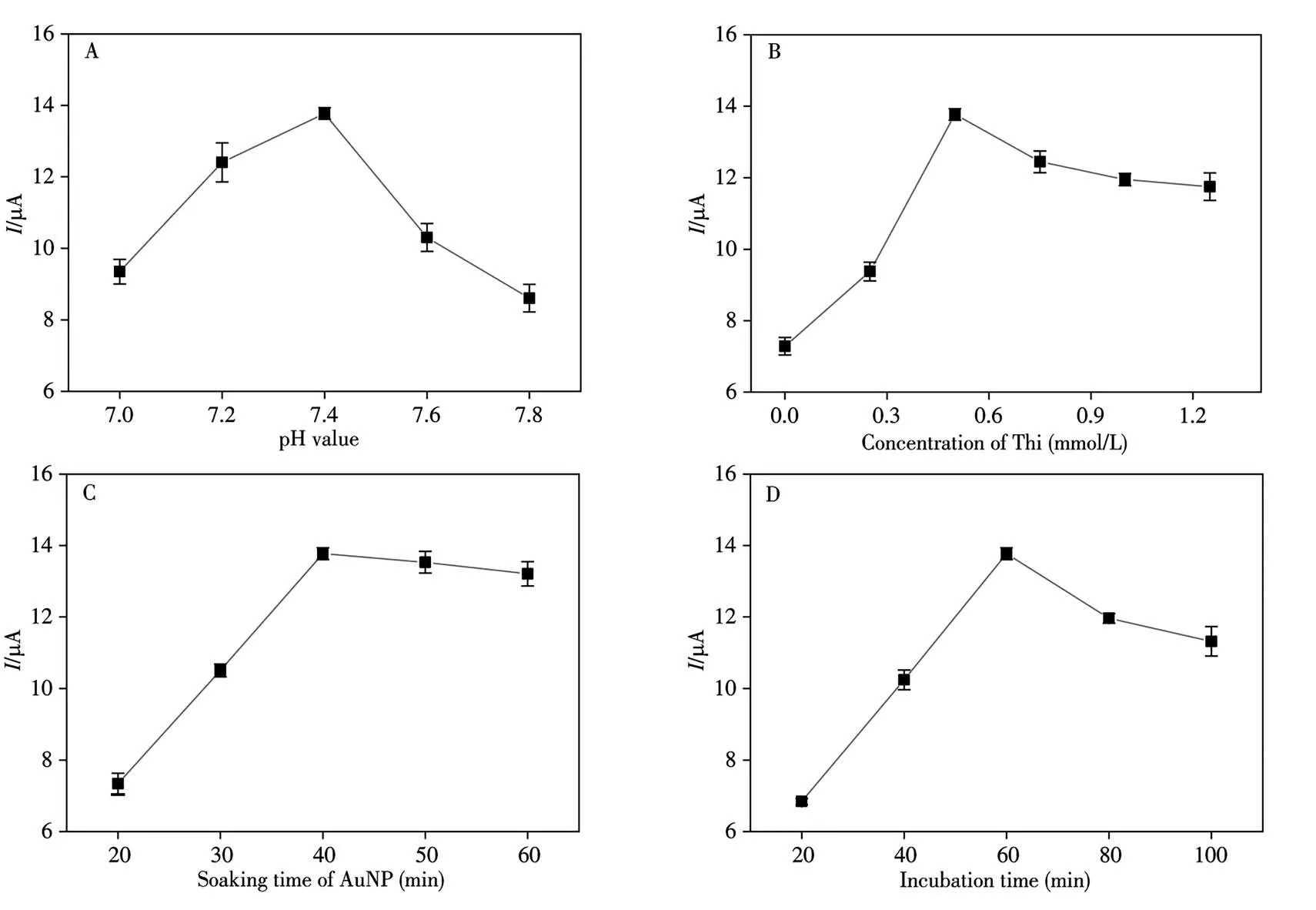
圖5 CaMV 35S基因傳感器檢測的條件優化Fig.5 Parameter optimization for CaMV 35S genosensor performanceA:buffer pH value;B:Thi concentration;C:soaking time of AuNP;D:incubation time of DNA sequences;concentration of S2:1×10-12 mol/L
2.5 CaMV 35S序列的檢測
CaMV 35S基因傳感器的選擇性如圖6所示,曲線a為目標空白,曲線b~d分別為與1×10-12mol/L的cDNA、Mis-1和Mis-3雜交后的DPV響應。5次測量平均值中,Mis-1比cDNA的信號約低30.4%,Mis-2和空白的峰值電流值分別比cDNA的信號約低52.7%和64.9%。可見所提出的基因傳感方法對特定的DNA序列有較好的選擇性。
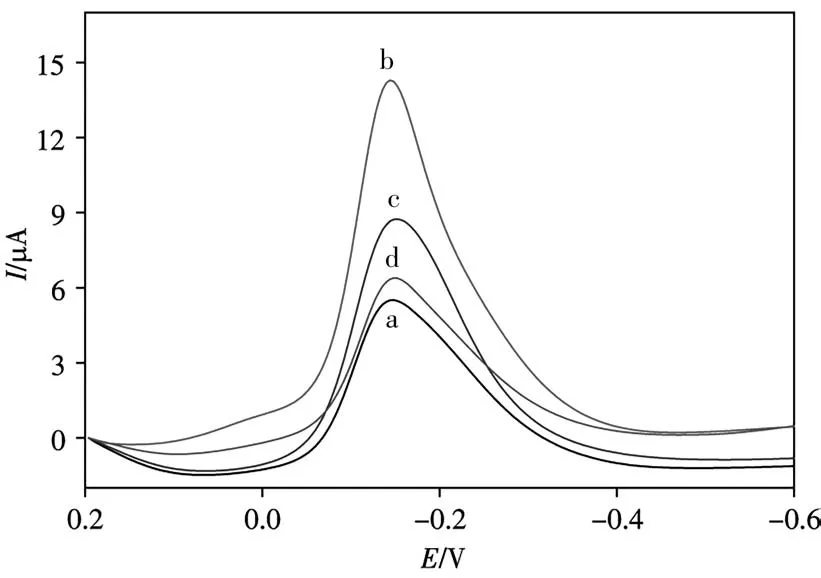
圖6 CaMV 35S傳感器對3種特定DNA序列的選擇性Fig.6 Selectivity of CaMV 35S sensor for three specif?ic DNA sequencesa:blank;b:cDNA;c:Mis-1;d:Mis-3;concentration of S2:1×10-12 mol/L
采用DPV進一步考察CaMV 35S基因傳感器對不同濃度目標序列的分析性能。結果顯示,隨著cDNA濃度的增加,DPV信號響應明顯增加,且峰電流(I,MA)與cDNA濃度(C,mol/L)的對數在1×10-16~1×10-10mol/L范圍內呈線性關系,線性方程為:I=32.001+1.549 lgC,r=0.994,方法檢出限(LOD,S/N=3)為9.46×10-17mol/L。
2.6 DNA傳感器的重復性與穩定性
取6支CaMV 35S基因傳感器同時檢測1.0×10-15mol/L cDNA,其組間相對標準偏差為4.6%;在4℃下儲存7 d后,該基因傳感器仍保留了94.5%的初始伏安響應。因此該傳感器具有良好的重復性和穩定性。
2.7 實際樣品CaMV 35S序列的PCR產物檢測
本研究提取擬南芥總RNA通過逆轉錄為cDNA后,PCR擴增得到其PCR產物。考察了CaMV 35S基因傳感器對不同PCR產物變性后ssDNA的DPV響應(圖7),其中陽性樣品的PCR產物雜交后的DPV峰電流約為15.198μA和11.185μA(曲線b和c),分別相當于1.420×10-11mol/L和3.645×10-14mol/L ssDNA;而陰性樣品的結果與cDNA空白結果基本一致(曲線a)。插圖為PCR產物dsDNA的瓊脂糖凝膠電泳結果,泳道2為陰性樣品,未出現明顯條帶;泳道3和泳道4為陽性樣品,可見其PCR擴增產物條帶出現在約500 bp處。利用電化學傳感方法檢測的結果與凝膠電泳法的結果一致。
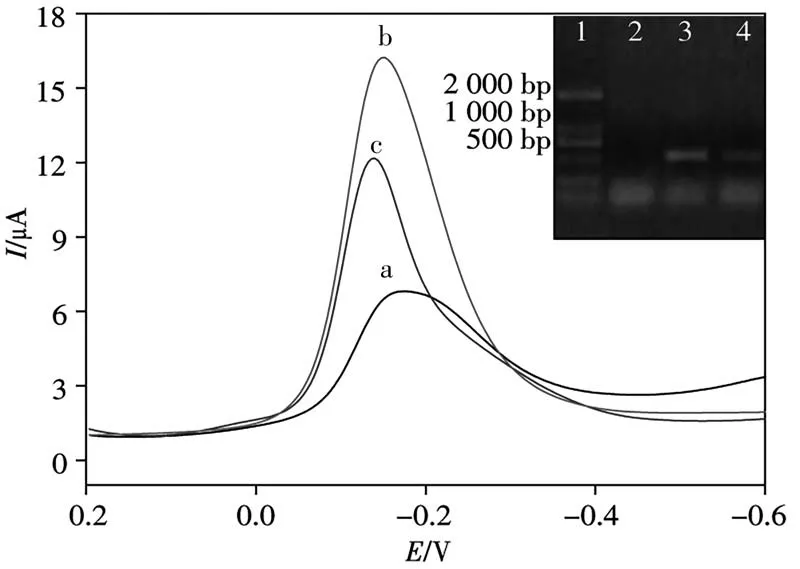
圖7 PCR產物的DPV曲線Fig.7 DPV curves for PCR producta.negative real sample;b,c:two positive real samples;inset:gel electrophoresis for DL2000 DNA marker(lane 1),negative sample(lane 2),and positive real samples(lane 3 and 4)
3 結 論
本研究建立了一種基于Hemin-rGO和AuNP負載Thi的雙重信號放大的電化學DNA傳感方法,可用于轉基因作物中花椰菜花葉病毒35S啟動子序列的快速檢測。在最優分析條件下,該CaMV 35S傳感器可用于實際樣品的檢測,實現了對超低含量目標序列的檢測。該傳感器制備較為簡便、易于保存,具有良好的選擇性、穩定性和重復性,可以滿足食品、飼料及其他工業品等原料或成品中轉基因作物成分快速檢測篩查的需求。

