前噬菌體對細菌毒力的影響
季強,金琳,栗紹文,宋厚輝,劉梅*
(1. 華中農業大學動物醫學院,湖北 武漢 430070;2. 浙江省畜禽綠色生態健康養殖應用技術研究重點實驗室,浙江 杭州 311300)
噬菌體(bacteriophage, phage)是感染細菌、真菌和藻類等微生物的一類病毒。根據復制方式,可以將噬菌體分為裂解性噬菌體(lytic phage)和溶原性噬菌體(lysogenic phage)。裂解性噬菌體是指噬菌體侵入宿主菌后,在宿主體內自主復制,裂解細菌,釋放子代噬菌體的一類噬菌體。溶原性噬菌體亦稱溫和噬菌體(temperate phage),是指侵入宿主菌的噬菌體將自己的基因組整合到宿主細菌的染色體(或基因組)上,隨著細菌基因組的復制而復制的一類噬菌體。溶原性噬菌體整合到宿主細菌基因組的核酸稱為前噬菌體(prophage)。攜帶有前噬菌體的細菌稱為溶原性細菌(lysogenic bacterium; lysogen),簡稱溶原菌。當整合到細菌基因組后,前噬菌體會受到噬菌體編碼的阻遏蛋白的抑制而保持靜止狀態即溶原狀態,但在一定條件下,前噬菌體會被切除,從細菌基因組上脫離,從溶原狀態進入裂解狀態,產生并釋放子代噬菌體,這個過程稱為前噬菌體的誘導。前噬菌體的誘導通常是在細菌DNA受到損傷時被引發的。細菌DNA受到損傷后,觸發細菌的SOS反應,使噬菌體阻遏蛋白失去活性,從而消除對前噬菌體的抑制作用,前噬菌體脫離細菌基因組,進入裂解狀態[1]。因此,一些可以引起細菌DNA損傷的因素,比如紫外線[2]、絲裂霉素C[3]和喹諾酮類藥物[4]等,都可以誘導溶原菌產生子代噬菌體,紫外線照射和絲裂霉素C處理是實驗室中常見的前噬菌體誘導的方法。
隨著基因測序技術的發明和不斷升級換代,以及生物信息學的誕生和發展,大量的細菌基因組被測序,前噬菌體序列被預測,兩個預測工具為Prophage Hunter(https://pro-hunter.bgi.com)和PHASTER(https://phaster.ca),這使得對前噬菌體的研究能夠深入到分子水平。Touchon等[5]對2 110個細菌基因組測序后發現,約一半細菌是溶原菌,對病原菌來說更是如此,且研究證明,前噬菌體與細菌的毒力密切相關。本文就該方面的研究結果進行綜述,以增加人們對噬菌體的了解,并為研究細菌的毒力提供參考,進而幫助人們制定出從噬菌體的角度來消除病原菌的方針和策略。
1 前噬菌體增強細菌的黏附性
細菌感染的第一步是黏附到機體組織細胞表面,前噬菌體能夠增強宿主細菌對組織細胞的黏附性。缺失了前噬菌體phiv142-3后的禽致病性大腸桿菌(avian pathogenicEscherichiacoli, APEC)菌株DE142,對雞的心、肝和肺等組織的黏附性顯著下降[3]。菌毛是細菌的黏附結構,其幫助細菌結合到宿主細胞的受體上;鞭毛相當于細菌的運動器官,其驅動細菌擴散到更有利的位置定植。進一步研究發現,前噬菌體phiv142-3基因組上的orf20編碼的蛋白促進了菌株DE142鞭毛蛋白的輸出和菌毛相關基因的表達,從而增強了菌株的黏附性[6]。大腸桿菌(Escherichiacoli)λ噬菌體的基因lom(lambda outer membrane)編碼一種外膜蛋白,該蛋白能使大腸桿菌對口腔上皮細胞的黏附性增加50%[7]。耐甲氧西林金黃色葡萄球菌(methicillin-resistantStaphylococcusaureus, MRSA)的ΦSPβ樣前噬菌體編碼的表面錨定蛋白SasX,能促進MRSA對鼻腔上皮細胞的黏附[8],該蛋白是治療和疫苗設計的潛在靶標[9]。前噬菌體編碼的蛋白還可以增強細菌對宿主血小板[10]和免疫球蛋白[11]的黏附能力,以增強細菌的毒力。
2 前噬菌體編碼細菌毒素和調控毒素的產生與釋放
2.1 前噬菌體編碼細菌毒素
細菌毒素是細菌致病的重要毒力因子,某些毒素的基因是細菌通過水平基因轉移(horizontal gene transfer, HGT)獲得的,HGT可以通過以噬菌體為媒介的轉導進行[12]。攜帶毒素基因的溶原性噬菌體侵入宿主細菌后成為前噬菌體,毒素基因被表達,使菌株產毒,所以許多病原菌依賴前噬菌體編碼的基因產生毒素(表1)。

表1 前噬菌體編碼的細菌毒素
例如,C型肉毒梭菌(Clostridiumbotulinumtype C)菌株468C產生的肉毒毒素,是由前噬菌體CEβ編碼的[13];金黃色葡萄球菌(Staphylococcusaureus)菌株PS42-D產生的葡萄球菌腸毒素A是前噬菌體PS42-D(與菌株名相同)編碼的[14];化膿鏈球菌(Streptococcuspyogenes)T253菌株被溶原性噬菌體T12侵染后,產生A型致熱外毒素(又稱紅疹毒素),這個毒素的基因就定位在T12上[15]。前噬菌體發生誘導后可以攜帶這些毒素基因在細菌間轉移,將非致病菌轉化為致病菌,比如,非致病性的霍亂弧菌(Vibriocholerae)由于整合了編碼霍亂毒素的前噬菌體CTXΦ,從而轉變為致病性的霍亂弧菌[16];金黃色葡萄球菌的前噬菌體80α發生誘導后產生的子代噬菌體,能包裹細菌毒力島SaPI1基因片段并轉移至受體菌株,使受體菌株具有了致病性[17]。
2.2 前噬菌體調控細菌毒素的產生與釋放
有些前噬菌體雖然不直接編碼細菌毒素,不直接影響細菌的毒力,但可以通過調控細菌毒素的產生來間接影響細菌的毒力。如艱難梭菌(Clostridiumdifficile)的兩個重要外毒素TcdA和TcdB基因的表達,受選擇性RNA聚合酶σ因子TcdR(又稱為TxeR)的正向調控[26],而TcdR又受前噬菌體ΦCD119編碼的RepR蛋白的調控,RepR能結合到TcdR基因的上游,抑制TcdR的表達,從而抑制兩種外毒素的產生[27]。
前噬菌體可以通過誘導后裂解細菌,促進毒素的釋放,來增強細菌的毒力。有的細菌素如大腸桿菌素(colicin)是通過前噬菌體誘導裂解菌體釋放出來的。大腸桿菌素分為A和B兩類,A類依靠與之配對的大腸桿菌素釋放蛋白(colicin release protein, CRP)釋放到菌體外,而B類沒有與之配對的釋放蛋白,那么B類的大腸桿菌素是怎么釋放出菌體的呢?鼠傷寒沙門菌(salmonellaentericaserovar typhimurium)菌株SL1344,能產生大腸桿菌素 Colicin Ib (ColIb),ColIb屬于B類大腸桿菌素。研究發現,ColIb的釋放是菌株SL1344內的前噬菌體ST64B來完成的。當用絲裂霉素C誘導時,前噬菌體ST64B進入裂解循環,導致菌體裂解,從而釋放出大腸桿菌素ColIb[28]。
3 前噬菌體協助細菌逃避宿主防御
在細菌感染期間,前噬菌體可以協助細菌逃避宿主的防御,促進細菌在機體內的繁殖和擴散。
3.1 前噬菌體協助細菌逃逸巨噬細胞的吞噬
巨噬細胞是重要的免疫細胞,它吞噬病原菌,在胞內降解和消化菌體,并將菌體的抗原成分遞呈給T細胞,以啟動機體的特異性免疫功能來抵抗病原菌的侵染。病原菌若能避免被巨噬細胞吞噬掉,就能成功逃脫機體的免疫防御。有的前噬菌體就能幫助病原菌逃逸巨噬細胞的吞噬,使病原菌成功地在機體內繁殖和擴散。
單增李斯特菌(Listeriamonocytogenes)是胞內病原菌(intracellular bacterial pathogen),其被宿主巨噬細胞捕獲后不但不會被吞噬掉反而能在巨噬細胞中生長繁殖,原因是該菌能從巨噬細胞的吞噬小體中逃逸出來,進入胞質,得以生長繁殖,這逃逸的本事離不開前噬菌體的幫助。以單增李斯特菌10403S菌株為例,研究發現,菌株要從吞噬小體中逃逸出來,需要comK基因產物的調控,但comK基因上帶有前噬菌體φ10403S,由于該前噬菌體的插入使comK處于無功能狀態[30]。當10403S菌株進入巨噬細胞吞噬小體后,菌株啟動前噬菌體誘導系統,切除了comK上的φ10403S,使comK基因恢復功能,促使菌株從吞噬小體中逃逸出來。簡而言之,由于前噬菌體φ10403S的切除增強了細菌的毒力。奇妙的是,前噬菌體φ10403S從細菌基因組上切除后,并未產生子代裂解性噬菌體使宿主細菌裂解消亡,反而增強了宿主菌在巨噬細胞內的生長能力,這個前噬菌體如同一個基因開關調節著細菌在感染過程中的毒力。
3.2 前噬菌體協助細菌抑制機體的炎癥反應
炎癥反應是機體抵御入侵的病原菌的一種免疫機制。病原菌為了不被炎癥反應消滅掉,會進化出抑制炎癥反應的能力以便能在體內定植和擴散,這其中有前噬菌體的功勞。
鼠傷寒沙門菌的前噬菌體Gifsy-1編碼蛋白GogB,它是一個經沙門氏菌三型分泌系統(T3SS)釋放出來的分泌性蛋白,其具有抑制宿主機體細胞轉錄因子NFκB活性的功能,活化的NFκB能正向調控促炎細胞因子的表達。GogB通過干擾NFκB的抑制蛋白IκBα的降解來抑制NFκB的活性,進而抑制了炎癥反應,是個抗炎效應分子[31]。鼠傷寒沙門氏菌的前噬菌體Gifsy-1還編碼另一個參與抗炎的蛋白,稱為SarA(Salmonellaanti-inflammatory response activator),SarA能誘導細胞因子IL-10的產生。IL-10能減弱促炎細胞因子(如TNFα和IFNγ)的表達、抑制Th1細胞、減少巨噬細胞中活性氧(reactive oxygen species, ROS)的產生和降低巨噬細胞中炎癥小體(inflammasome)的活性。SarA與上面的GogB一樣,是T3SS釋放出來的分泌性蛋白,能激活宿主細胞轉錄因子STAT3,STAT3調控IL-10的表達,IL-10發揮抑炎作用進而促進沙門氏菌在宿主細胞內的復制[32]。所以前噬菌體Gifsy-1為沙門氏菌逃避宿主炎癥反應立下了汗馬功勞。
4 前噬菌體參與細菌生物被膜的形成
細菌生物被膜(bacterial biofilm, BF)是指細菌為了適應環境,黏附接觸表面,分泌蛋白質、多糖和核酸等胞外基質,將自身包繞其中的一種細菌聚集膜樣物[33]。形成生物被膜是細菌體現其毒力的一個重要方面。細菌通過形成生物被膜,抵御機體免疫細胞、免疫分子和藥物的攻擊,克服機體液態流的沖擊而持續留在定植部位,難以根除,導致長期慢性感染。約有65%的細菌感染與生物被膜的形成有關[34]。在細菌生物被膜的形成過程中,前噬菌體發揮著重要的作用。
4.1 前噬菌體影響細菌產毒的同時也影響生物被膜的形成
有些細菌由于前噬菌體的存在而具有產毒能力并能形成生物被膜,但當前噬菌體消失后,菌體變得不能產毒且同時也喪失了形成生物被膜的能力。
霍亂弧菌的霍亂毒素CT(cholera toxin)的編碼基因(ctxA和ctxB)位于前噬菌體CTXφ上,帶有CTXφ的菌株為產毒菌株,當CTXφ缺失后,產毒菌株變為非產毒菌株。非產毒菌株不僅喪失了毒力,同時也喪失了形成生物被膜的能力,其原因與位于染色體上的調控基因aphA密切相關。aphA的產物AphA既調控包括前噬菌體CTXφ上的ctxA和ctxB在內的毒力基因的表達,又調控形成生物被膜的基因的表達。前噬菌體CTXφ缺失后,使aphA的轉錄水平降低,進而影響到形成生物被膜的基因的表達。CTXφ缺失后是如何導致aphA的轉錄水平降低的還不清楚,但推測aphA的轉錄水平受細胞里CT等毒力因子的濃度的反饋調節,當CTXφ存在時,CT濃度高,aphA的轉錄水平高,CTXφ缺失后,無CT產生,aphA的轉錄水平就下降了,繼而導致菌體喪失形成生物被膜的能力[35]。
4.2 前噬菌體參與液晶狀生物被膜的形成
當細菌的生物被膜呈現出高度有序的狀態時,即成為了液晶狀生物被膜(圖1)。與非液晶狀生物被膜即普通生物被膜相比,液晶狀生物被膜的黏附力和抗逆性更強,因此,液晶狀生物被膜使細菌的毒力增強,這種增強與菌株攜帶的前噬菌體密切相關。
銅綠假單胞菌(Pseudomonasaeruginosa)PAO1菌株就能形成液晶狀生物被膜,這與PAO1菌株攜帶的前噬菌體Pf4密切相關。Pf4是一種絲狀噬菌體(filamentous bacteriophage)。當PAO1菌株由自由生活階段切換到生物被膜生活階段后,菌體中發生前噬菌體Pf4的誘導而產生子代噬菌體顆粒,隨之裂解宿主菌,被裂解的菌體DNA和釋放出來的大量Pf4參與生物被膜基質的構建,絲狀的Pf4將生物被膜基質組織成高度有序的液晶狀(圖1),這種液晶狀的基質使生物被膜的黏附力、抗干燥能力和耐受抗生素的能力增強。奇妙的是,基質中的Pf4噬菌體并不會導致被膜中細菌的消亡,而是與宿主菌共生存在于液晶狀的生物被膜中[36]。
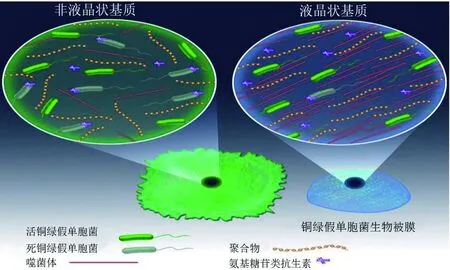
此圖來自參考文獻[36]
4.3 前噬菌體促進eDNA的釋放
胞外DNA(extracellular DNA, eDNA)是生物被膜基質中重要的結構性成分,其能促進細菌細胞附著和生物被膜的形成[37]。前噬菌體對生物被膜中eDNA的增加有貢獻。如,齲齒放線菌(Actinomycesodontolyticus)菌株XH001在形成生物被膜時,菌體中的前噬菌體xhp1發生自發誘導(spontaneous induction),導致部分細菌細胞裂解而釋放出菌體DNA,菌體DNA作為eDNA參與生物被膜的構建[38]。
4.4 細菌通過調控前噬菌體的誘導促進生物被膜的形成
在生物被膜形成的早期,細菌群落作為一個整體可以從有限的前噬菌體誘導中受益,但過量的前噬菌體誘導使大量菌體裂解消亡反而不利于生物被膜的形成,因此,為了更好地促進生物被膜的形成,細菌會對前噬菌體的誘導進行調控。
銅綠假單胞菌菌株PA14含有前噬菌體Pf5。在生物被膜形成過程中,前噬菌體Pf5的誘導受菌體細胞中DppA1的調控。DppA1是ABC轉運系統(ATP Binding Cassette transporter system)DppBCDF的一個底物結合蛋白(substrate binding protein, SBP),DppA1結合的底物是二肽和三肽。DppA1能抑制前噬菌體Pf5的誘導,從而限制大量裂解性子代噬菌體的產生,控制了大量菌體裂解事件的發生,進而增進生物被膜的形成。DppA1如何具體抑制前噬菌體Pf5的誘導還未探究清楚,但推測,當胞外氮源充足時,DppA1通過轉運二肽給Pf5整合酶或切除酶傳遞了一個抑制前噬菌體切除的信號;當胞外氮源匱乏時,DppA1轉運二肽的活動減弱,抑制信號消失,Pf5被誘導,產生大量的子代噬菌體,菌體裂解,生物被膜出現空洞而發生潰散[39]。細菌還可以通過轉錄因子Hha[40]和群體感應(quorum sensing, QS)系統[41]控制前噬菌體的誘導以促進生物被膜的形成。
5 前噬菌體降低細菌的毒力
多數情況是,溶原性噬菌體攜帶毒力基因,侵入宿主菌,從而增強宿主菌的毒力,而少有溶原性噬菌體使病原菌毒力減弱的情況,下面就介紹一下前噬菌體降低細菌毒力的研究。
5.1 前噬菌體的特異性整合降低了細菌的毒力
溶原性噬菌體整合到宿主細菌基因組的位置并非千篇一律。大多數噬菌體的整合位置是在非編碼RNA(Non-coding RNA)中,其中tRNA是最為常見的位置。少數溶原性噬菌體整合到細菌編碼蛋白質的基因中,從而破壞了該蛋白質的功能,如果這個蛋白質是毒力因子,那么細菌的毒力則會下降。
研究發現,支氣管敗血波氏桿菌(Bordetellabronchiseptica)菌株Bb01整合了溶原性噬菌體PHB09后,毒力下降。測序后發現,PHB09整合到了宿主基因組編碼菌毛蛋白的基因中。菌毛蛋白能形成毛發樣的菌毛,位于細菌表面,起黏附作用,是重要的毒力因子。前噬菌體PHB09插入到菌毛蛋白基因中,破壞了菌毛蛋白的合成,這可能就是導致菌株Bb01毒力降低的原因。用攜帶前噬菌體PHB09的溶原菌(相當于減毒菌株)對小鼠滴鼻免疫后,可以完全保護小鼠免受有毒力的支氣管敗血波氏桿菌的致死攻擊,顯示了前噬菌體減毒溶原菌作為疫苗的潛力[42]。
5.2 同一種前噬菌體對不同的菌株在毒力方面的影響不同
同一種前噬菌體對一種細菌中的不同菌株的毒力的影響效果不同,有的使其毒力增強,而有的則使其毒力減弱,這些現象體現出前噬菌體對細菌毒力影響的復雜性。
在腸道沙門氏菌(Salmonellaenterica)中,有一個bstA基因,其編碼一個功能尚未知的蛋白,位于前噬菌體BTP1上。對于鼠傷寒沙門氏菌序列型為313的菌株02-03/002,當bstA缺失后,菌株在巨噬細胞內的存活率下降,對小鼠的毒力也下降,顯然bstA是一個毒力基因[43]。但是,對都柏林沙門氏菌(S.entericaserovar Dublin)菌株3246來說,情況則相反,當bstA缺失后,菌株在巨噬細胞內的存活率上升,對小鼠的毒力增強,顯然bstA是一個抗毒力基因[44],與之相同的是,對鼠傷寒沙門氏菌ST313參考菌株D23580來說,不管是缺失bstA基因,還是缺失整個前噬菌體BTP1,菌株均表現出毒力增強[45]。從后面這種情況來看,攜帶有bstA的前噬菌體BTP1具有降低腸道沙門氏菌毒力的能力。為什么同一種前噬菌體對不同的菌株在毒力方面的影響截然相反,這還有待進一步的探究。
5.3 利用抗毒力前噬菌體阻遏細菌毒素的產生
利用抗毒力前噬菌體可以阻遏病原菌毒素的產生。腸出血性大腸桿菌(enterohemorrhagicE.coli, EHEC)是產志賀毒素大腸桿菌,Stx中的Stx2是導致危及生命的溶血性尿毒綜合征的重要毒素。Stx2的編碼基因位于λ噬菌體933W上。在溶原狀態下,細菌并不產生Stx2,因為前噬菌體933W通過表達阻遏蛋白cI,阻止了stx2基因和裂解基因的表達。但當發生誘導如自發誘導或有抗生素等誘導劑存在時,阻遏蛋白cI發生降解,對stx2基因和裂解基因表達的阻遏作用喪失,前噬菌體933W進入裂解循環并表達Stx2,導致菌體裂解并釋放Stx2[22]。由此可見,阻止Stx2產生的關鍵是維持cI的阻遏功能,保持噬菌體933W的溶原狀態。Hsu等利用基因工程技術構建了一個抗重復感染排斥(superinfection exclusion)的溫和性雜合噬菌體(hybrid phage)λBH2,λBH2帶有突變了的cI基因,該基因表達出的阻遏蛋白cIind-不可降解。用λBH2侵染含有前噬菌體933W的大腸桿菌即E.coli933W后,產生了含有兩個前噬菌體的雙溶原菌(double lysogen),這樣的細菌發生誘導時不產生Stx2,因為內源性前噬菌體933W產生的cI降解后,有λBH2表達的不可降解阻遏蛋白cIind-替補cI的阻遏作用,阻止stx2基因的表達,維持933W的溶原狀態[46]。像λBH2這種抗毒力前噬菌體具有預防和治療產毒病原菌導致的疾病的應用潛質,所以這類研究將會非常令人期待。
6 總結與展望
細菌基因組測序結果顯示,前噬菌體廣泛存在于細菌的基因組中。越來越多的研究表明,前噬菌體和細菌的毒力密切相關。本文從前噬菌體增強細菌的黏附性、前噬菌體編碼細菌毒素和調控毒素的產生與釋放、前噬菌體協助細菌逃避宿主防御、前噬菌體參與細菌生物被膜的形成和前噬菌體降低細菌的毒力方面論述了前噬菌體對細菌毒力的影響,以期增加人們對噬菌體的了解,同時為研究細菌的毒力提供參考,進而為人們制定從噬菌體的角度來消除病原菌的方針和策略提供依據。
前噬菌體對細菌的毒力既有增強作用也具有減弱作用。將來人們可以充分發揮前噬菌體的有益作用,以控制或消滅病原菌。如,對于攜帶前噬菌體的病原菌,采用誘導的方法,促使前噬菌體進入裂解循環,裂解菌體,從而使病原菌消亡;利用基因工程技術對溶原性噬菌體進行改造,使其整合到細菌基因組的毒力基因中,破壞毒力基因,降低或消除細菌的毒力;利用抗毒力前噬菌體可以降低或消除細菌毒力的作用,研發有抗毒力的前噬菌體治療劑,這種治療劑不破壞機體正常菌群,因為它不是去消滅機體內的病原菌,而是將病原菌轉化為無毒菌體,而傳統的噬菌體治療劑裂解體內病原菌時,可能會裂解與病原菌相近但屬于正常菌群的菌體。當前,對噬菌體的研究仍在不斷深入和擴展,相信將來會聽到噬菌體給人類健康帶來的福音。

