輕型顱腦損傷病人血清高遷移率族蛋白B1、泛素C末端水解酶L1和神經元特異性烯醇化酶水平變化及與預后的相關性分析
謝元潤 馬迎輝 葉繼業 陳超
輕型顱腦損傷(mild head injury,MHI)在顱腦損傷病人中占比遠多于中、重型顱腦損傷,且因癥狀較輕的原因,僅少數及時得到了醫治,常留下后遺癥[1]。目前,臨床主要通過格拉斯哥預后量表(Glasgow coma scale,GOS)評估顱腦損傷病人預后,但病人生理病理等基礎因素的影響具有一定局限性。研究發現,炎癥反應和神經組織損傷與顱腦損傷病人預后密切相關[2]。高遷移率族蛋白B1(high mobility group protein B1,HMGB1)是一種核蛋白,能激活核因子κB,引起一系列炎癥級聯反應[3]。泛素C末端水解酶L1(ubiquitin C-terminal hydrolase L1,UCH-L1)是一種半胱氨酸特異性水解酶,能通過結合單體泛素,延長泛素半衰期以對神經元進行調控,與神經系統功能密切相關[4]。神經元特異性烯醇化酶(neuron specific enolase,NSE)是神經元細胞的一種酶,在腦組織細胞中具有極高的活性,腦組織受損后,會大量釋放NSE[5]。本研究分析MHI病人血清HMGB1、UCH-L1、NSE水平變化情況,探討其與病人預后的關系。
對象與方法
一、對象
我院2017年1月~2019年1月收治的84例MHI病人為MHI組,均經顱腦CT檢查確診,其中男62例,女22例;年齡42~63歲,平均(48.82±3.87)歲;BMI為20~28 kg/m2,平均(24.18±3.13)kg/m2;入院時間為傷后2~8小時,平均(4.50±1.23)小時。納入標準:(1)符合《臨床診療指南.創傷學分冊》中顱腦損傷診斷標準[6];(2)GOS評分13~15分;(3)臨床資料完整者;(4)病人及家屬均知情研究;(5)無癡呆者。排除標準:溝通障礙;濫用精神藥物、長期酗酒;顱內感染、顱內占位、大面積腦梗死等其他類型腦部疾病者;嚴重心血管疾病;肝腎功能不全;合并其他部位損傷。另選取同時期57例來我院體檢健康者為對照組,男41例,女16例;年齡40~65歲,平均(47.35±4.83)歲;BMI為20~28 kg/m2,平均(23.97±3.23)kg/m2;兩組研究對象一般資料對比差異無統計學意義(P>0.05)。本研究經本院倫理委員會批準(倫理編號:EDYLJTHSSZXYY20161108008)。
二、方法
1.基礎資料收集:收集MHI病人性別、年齡、BMI、吸煙、飲酒、病史、致傷原因、損傷類型、并發癥(包括感染、顱內血腫、腦疝、腦梗塞、壓瘡等),入院后24小時收縮壓(systolic pressure,SP)、舒張壓(diastolic pressure,BP)水平。測定總膽固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白膽固醇(low density lipoprotein cholesterin,LDL-C)、超敏C反應蛋白(high-sensitivity C-reactive protein,hs-CRP)水平。
2.血清HMGB1、UCH-L1、NSE水平測定:取入院后24小時內5 ml靜脈血,3 000 r/min離心10分鐘,半徑8 cm,酶聯吸附法測定HMGB1、UCH-L1、NSE水平。
3.預后評估:對所有病人隨訪6個月,采用GOS評估病人預后狀況。將MHI組分為預后不良組(Ⅰ~Ⅲ級,23例)和預后良好組(Ⅳ~Ⅴ級,61例)。
三、統計學處理
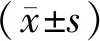
結果
1.MHI組和對照組血清HMGB1、UCH-L1、NSE水平對比:MHI組血清HMGB1、UCH-L1、NSE水平高于對照組,差異有統計學意義(P<0.05)。見表1。
2.MHI病人預后不良影響因素的單因素分析:預后不良組復合損傷、并發癥比例和血清hs-CRP、HMGB1、UCH-L1、NSE水平高于預后良好組,差異有統計學意義(P<0.05)。見表2。
3.MHI病人預后不良影響因素的多因素Logistics回歸分析: 以損傷類型、并發癥、hs-CRP、HMGB1、UCH-L1、NSE為自變量,以預后情況為因變量(不良=1,良好=0),多因素Logistic回歸分析顯示,復合損傷、HMGB1、UCH-L1、NSE為MHI病人預后不良獨立影響因素(P<0.05)。見表3。
4.血清HMGB1、UCH-L1、NSE水平對MHI不良預后的預測價值:以血清HMGB1、UCH-L1、NSE水平為自變量,MHI預后情況為因變量(不良=1,良好=0),進行Logistic回歸,建立MHI不良預后預測模型,Log=P/(1-P)=9.265+1.059×HMGB1-5.964×UCH-L1+0.287×NSE,預測概率作聯合ROC曲線,HMGB1+UCH-L1+NSE預測MHI不良預后的AUC明顯大于HMGB1、UCH-L1、NSE單獨預測(Z=3.894、3.833、4.341,均P<0.05)。見表4、圖1。

圖1 血清HMGB1、UCH-L1、NSE水平預測MHI不良預后的ROC曲線
討論
MHI為顱腦損傷中最為常見的類型,但由于很多病人并沒有明顯的影像學和臨床表現,且很少有殘疾和死亡的結果,因此臨床重視度不高。目前,MHI的預后主要依據GOS評分評估,但即便13~15分的病人也可能出現病變惡化甚至死亡等事件,因此迫切需要一種能幫助MHI診斷及評估病人預后的指標。
HMGB1為含量最豐富的HMG蛋白,生理狀態下,HMGB1參與DNA復制、轉錄等功能,病理狀態下,則會作為損傷信號分子和炎性因子,通過炎性反應刺激免疫系統,誘導釋放多種炎性因子[7]。創傷性腦損傷病人血漿中HMGB1濃度提高,可激活天然免疫系統,釋放大量炎癥因子,加重病情[8]。本研究結果顯示,MHI組血清HMGB1水平高于對照組,顱腦損傷是一個復雜過程,組織、血管損傷會導致HMGB1大量釋放,同時組織、血管損傷還會導致腦細胞缺氧、死亡,繼發炎癥反應,炎癥因子刺激細胞導致HMGB1被動釋放,并通過受損血腦屏障(blood brain barrier,BBB)進入血液,故MHI病人血清HMGB1水平明顯升高[9]。結果顯示,預后不良組血清HMGB1水平高于預后良好組,為MHI病人預后不良獨立影響因素。Li等[10]通過阻斷中風大鼠HMGB1發現,阻斷HMGB1信號能減輕BBB損傷和炎癥反應。預后不良組血清HMGB1水平升高可能通過加重BBB損傷和炎癥反應,加重組織缺血性損傷和神經功能退變進而降低病人預后。
UCH-L1為泛素蛋白酶體系統重要組成分,廣泛參與細胞凋亡、細胞周期調控等生理病理反應過程[8]。UCH-L1僅存在于腦部神經元,且分子量僅24 kDa,很容易透過BBB進入外周血液。研究表明,UCH-L1活性改變與帕金森、阿爾茨海默病等神經退行性疾病有關,近年研究發現,腦梗死病人血清中UCH-L1表達明顯提升,與病人病情嚴重程度密切相關[11]。Metzger 等[12]研究也發現,顱腦損傷后腦脊液中UCH-L1表達明顯升高,且隨著預后變差而提升。本研究結果顯示,MHI組血清UCH-L1水平明顯高于對照組,顱腦損傷后UCH-L1可從受損神經元中漏出,再經受損BBB進入血液,因此MHI病人血清UCH-L1水平明顯提升。研究發現,UCH-L1可通過蛋白激酶A-cAMP反應元件結合蛋白信號途徑調節大腦海馬組織神經細胞,并通過泛素途徑調節應激介導細胞凋亡,加重腦組織損傷[13]。本研究結果也顯示。預后不良組血清UCH-L1水平明顯高于預后良好組,為MHI病人預后不良獨立影響因素,說明血清UCH-L1水平越高,MHI病人預后越差,符合上述報道。
NSE特異性存在神經元胞漿內,生理狀態下,能催化α-磷酸甘油裂解為磷酸烯醇式丙酮酸,促進機體糖代謝和控制神經細胞多種功能,病理狀態下,多種因素破壞神經元細胞結構則會大量釋放NSE,并參與BBB基膜的纖黏蛋白和層黏蛋白降解,損壞BBB并經此進入血液[14]。研究發現,顱腦損傷后12小時內血清中NSE水平即可達高峰,若無繼發損害則會在6~12天后降低,與顱腦損傷程度密切相關[15]。同時,NSE還能促進細胞外基質降解、肌動蛋白重構、炎性膠質細胞增殖,使活化小膠質細胞和巨噬細胞遷移至受損部位,加速神經細胞死亡,釋放更多NSE[16]。本研究結果顯示,MHI組血清NSE水平高于對照組,顱腦損傷后神經元細胞受損,釋放NSE并透過BBB進入血液循環。結果顯示,預后不良組血清NSE水平高于預后良好組,為MHI病人預后不良獨立影響因素,說明NSE水平越高病人預后越差。ROC曲線顯示,HMGB1、UCH-L1、NSE均對MHI不良預后具有一定預測價值,三項聯合AUC顯著增加。聯合檢測血清HMGB1、UCH-L1、NSE水平能提升MHI不良預后預測價值。

