近紅外自體熒光成像對術中甲狀旁腺實時識別的初步研究
張穎超 陳承坤 伍波 于凡 鄧先兆 郭伯敏 康杰 樊友本
在過去的30年里,全世界甲狀腺癌(thyroid cancer,TC)的發病率顯著增長[1]。據2018年全球癌癥統計,甲狀腺癌新發病例56.7萬,占女性腫瘤負荷的5.1%[2]。在甲狀腺手術量激增的同時,術中甲狀旁腺(parathyroid gland,PG)誤切或血運損傷這一最常見且較嚴重的手術并發癥難題亟待解決。它導致了甲狀旁腺功能減退(hypoparathyroidism,HypoPT),主要特征是低鈣血癥,其中暫時性HypoPT的發生率為6.9%~49%,永久性為0.4%~33%[3],需長期口服鈣劑或活性維生素D,劑量控制不佳則造成高鈣或低鈣血癥,遠期則可能出現異位鈣化或腎結石等[4]。在甲狀腺全切術中,保留所有的PGs是一個非常重要的手術目標,但由于甲狀腺疾病的程度、PG的數目特別是解剖位置和血供的差異,很難全部發現和完整保留。盡管手術技巧、納米炭負顯影、亞甲藍染色、快速冰凍病理、自體移植等各個方面均已有相當廣泛的的研究,但最佳的PG保護方法仍沒有定論,現階段主要依靠手術醫生的肉眼辨識,要求醫師有相當豐富的專業知識和經驗累積。近期研究發現,PG組織暴露于近紅外光下表現出增強的自體熒光(autofluorescence,AF),文獻報道識別率可達到90%以上[5-6],無需注射造影劑,客觀且直觀,檢測到的腺體數量增加到3.5枚(肉眼識別2.6枚)[7]。本研究擬初步探索近紅外自體熒光(near-infrared autofluorescence imaging,NIRAF)成像對術中PG實時識別的臨床效果。
對象與方法
一、對象
2020年6~8月在我院甲狀腺外科行甲狀腺手術的病人59例,其中男性21例,女性38例。年齡22~80歲,平均年齡(53.1±13.6)歲。雙側甲狀腺手術20例,單側39例。病理診斷為甲狀腺乳頭狀癌46例,嗜酸細胞癌2例,結節性甲狀腺腫8例,甲狀腺腺瘤2例,濾泡性腫瘤1例。病人既往均無頸部外傷及放療病史。手術由同一治療組醫師完成,手術醫師均具有10年以上甲狀腺專科手術經歷。根據術前專家超聲/穿刺及術中冰凍切片,對惡性腫瘤病人行中央區清掃,部分病人附加側區清掃。
二、方法
1.甲狀腺手術:均采用開放術式,取頸部正中切口,切開皮膚后,常規游離皮瓣,切開頸白線直達甲狀腺固有被膜,上下鈍性分離,暴露甲狀腺。超聲刀離斷甲狀腺峽部,“脫帽法”處理甲狀腺上極。牽引甲狀腺,暴露甲狀腺背側。然后緊貼甲狀腺固有被膜精細化解剖PG并保留其血供。甲狀腺及氣管旁淋巴結清掃后,觀察甲狀腺床。手術標本送檢前再次檢查是否有PG誤切。
2.PG辨識陽性判斷標準:默認PG分別位于甲狀腺背側的左上、左下、右上、右下,且各有一個,即理論上雙側甲狀腺手術應找到4個PG,單側者則應為2個。故本研究將檢出PG總數158枚。先進行PG肉眼辨識,由兩名高年資手術醫師同時確認方為陽性;再進行NIRAF辨識,除檢測到AF外,還需符合PG常見大小、形態等相關特點才可判斷為陽性。當肉眼和NIRAF判別情況不一致時,對可疑組織再采用免疫膠體金(佰奧達PTH免疫檢測儀及檢測試劑)驗證是否PG。
3.NIRAF成像方式與探測時機:(1)NIRAF成像設備:設備整體觀見圖1。打開設備開關,進入控制界面,探頭與設備主體進行無線或有線連接。關閉無影燈(僅亮手術室環境燈),長按調節按鈕,打開激發光,探測端垂直于手術區,距離10~15 cm左右,在顯示器上進行動態顯像。術野呈灰色,PG自發熒光呈現亮色或白色。(2)PG尋找及識別時間節點:分別在甲狀腺被膜解剖前及標本切除后進行兩次識別,必要時據手術醫師的需求可增加成像次數。若離體標本檢出PG,經免疫膠體金確認后則行同側胸鎖乳突肌自體移植。

A:整體觀;B:激光探頭(自上而下依次為探測端、激發光調節按鈕、握持端)
4.免疫膠體金快速檢測PTH流程:用含有0.1 ml生理鹽水的1ml注射器穿刺可疑PG組織3~5次,1ml生理鹽水洗滌注射器及針頭3~5次,加入試劑進樣孔,10 min后將試劑條插入機器檢測孔,讀取結果。PTH >63.99 pg/ml,即判定為PG組織。
三、統計學處理
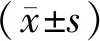
結果
1.PG總體識別結果見圖2。59例病人,共計切除79葉甲狀腺,將檢出上位、下位、總PG分別為79、79、158枚,實際分別檢出74、70、144枚,PG檢出率分別為93.6%、88.6%、91.1%。兩種方法均未辨識到的PG有14枚。

圖2 PG組織辨識流程
2.兩種方法檢出率的比較見表1。NIRAF成像與肉眼對于上位PG的檢出率分別為93.7%(74/79)、88.6%(70/79),下位PG分別為87.3%(69/79)、84.8%(67/79),總體的PG檢出率分別為90.5%(143/158)、86.7%(137/158),差異均無統計學意義(P>0.05)。

表1 59例病人的PG檢出情況及兩種方法檢出率比較
3.兩種方法準確率的比較見表2。NIRAF成像與肉眼對于PG識別準確率分別為98.6%(143/145)、100%(137/137),差異無統計學意義(P>0.05)。
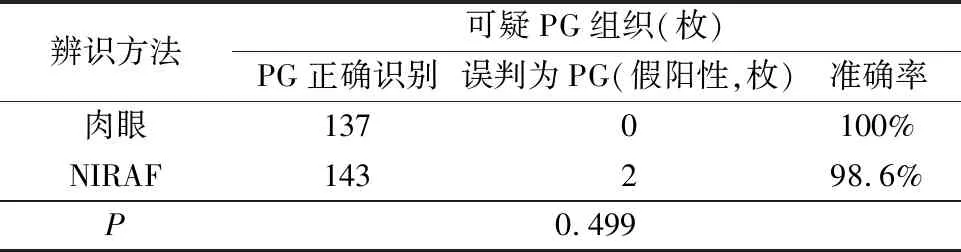
表2 兩種方法準確率比較(Fisher確切概率法)
4.PG誤切與自體移植的情況:本研究中6例病人進行了PG的同側胸鎖乳突肌自體移植,同時進行右側上位及下位PG移植1例,進行右側下位PG移植3例,右側上位、左側下位PG移植各1例。PG總體移植率4.4%(7/158)。移植的原因:1枚PG術中全程未檢出,導致誤切,離體組織中僅由NIRAF辨識到。6枚PG術中找到,其中4枚因操作或腫瘤/PG位置特殊導致PG血供離斷,主動自體移植;2枚則因術中解剖變化,PG保護不佳致手術誤切,后移植。
5.NIRAF成像與肉眼PG識別差異性與一致性比較見表3。就甲狀腺被膜解剖前這一重要階段而言,配對χ2檢驗,NIRAF的檢出率為55.7%(88/158),肉眼為31.6%(50/158),NIRAF檢出率顯著高于肉眼(P<0.05);Kappa=0.514,P<0.05,Kappa在0.41~0.6之間,一致性中等。最終識別結果,配對χ2檢驗提示兩種方法的識別結果差異無統計學意義(P>0.05);Kappa=0.750,P<0.05,Kappa在0.61~0.8之間,有較高度的一致性。

表3 兩種方法識別差異性與一致性比較(枚)
6.NIRAF成像的PG位置預見性及優越性見表3。甲狀腺被膜解剖前,NIRAF檢出率為55.7%(88/158),肉眼為31.6%(50/158),有38枚(24.1%,38/158)PG為NIRAF先于肉眼提前發現,且差異有統計學意義(P<0.05)。NIRAF成像可在術中進行PG的實時識別(圖3),而不受解剖階段的限制。同時,對于與胸腺組織、脂肪組織混雜或難以區分的PG,或組織破碎、解剖辨識困難的離體組織,NIRAF成像更為直觀且客觀(圖3G~J)。
討論
研究發現,PG與背景組織平均熒光強度的比率為4.78,且在所有情況下均大于1[6],故PG在近紅外光下表現為低熒光背景上的高熒光點。NIRAF成像的實際益處,需要回答兩個問題:術中是否通過熒光對比提高了外科醫生識別PG的能力,降低誤切和自體移植率;是否保護了PG功能,降低甲狀腺全切術后低鈣血癥的發生率。

A:甲狀腺被膜解剖前-室燈下術野;B:甲狀腺被膜解剖前-NIRAF成像;C:甲狀腺被膜解剖后-室燈下術野;D:甲狀腺被膜解剖后-NIRAF成像;E:甲狀腺床-室燈下術野;F:甲狀腺床-NIRAF成像;G:離體標本-室燈下術野;H:離體標本-NIRAF成像;I:胸甲韌帶旁腺室燈下術野;J:胸甲韌帶旁腺NIRAF成像
一組前瞻性研究報道,173例甲狀腺術中發現98.6%(496/503)的PG存在AF,137例甲狀旁腺術中發現AF的比例為96.4%(451/468)。550例標本經病理驗證,NIRAF預測PG的敏感度、特異性、陽性預測值和陰性預測值分別為98.5%、97.2%、95.1%和99.1%,總體準確性為97.6%(537/550)[5]。其他多中心研究也發現NIRAF檢測PG中AF的總體靈敏度為98%(584/594)[8]。其準確性甚至可達到100%[6]。259張疑似PG組織的NIRAF圖像均經肉眼檢查證實[9]。本研究中,NIRAF成像的PG檢出率為90.5%,準確率為98.6%,NIRAF與肉眼識別結果的一致性較高。這可能是由于本研究嚴格規定以PG大小、形狀、常見位置特點為前提判斷AF(+),減少了假陽性率,然而很可能降低了檢出率;肉眼識別PG的準確性達到了100%,一方面得益于三級醫院甲狀腺中心手術醫師的技能與經驗豐富,另一方面是我們規定了兩名高年資手術醫師同時確認PG才判定陽性的前提。但值得肯定的是NIRAF辨識PG的良好可行性,不遜于甚至優于肉眼識別的能力,可達到甲狀腺專科優秀手術醫生肉眼識別的水平,且它的應用將外科醫師術中識別PG的信心從4.1分提高到4.4分(0~5分)[10]。故預計將對經驗相對不足的專科甚至非專科醫師產生更好的輔助效果,提高辨識率,縮短學習曲線,實現更好的PG原位保留。
據報道,32%(162/503)的PG在外科醫生被膜解剖前,僅被NIRAF識別,而未被肉眼識別[5]。甲旁亢術中20%(12/59)的病人使用術中NIRAF成像幫助識別了肉眼未檢出的PG[10]。總體而言,手術全過程中77%(245/320)的PG可在肉眼識別之前先由NIRAF發現[9]。由于AF通過上覆組織的穿透性只有幾毫米,在甲狀腺被膜解剖前可能無法檢測到來自所有PG的AF信號,但隨著解剖的深入,暴露愈加充分,這些PG隨后被檢測到。本組病例在外科醫生被膜解剖前,通過AF可以識別55.7%(88/158)的PG,最終識別率達90.5%(143/158)。當被脂肪和結締組織覆蓋時,可能影響干擾肉眼識別,采用熒光輔助早期識別,目的是盡早判別PG大致方位以便于尋找保護其潛在的血供,盡可能避免無意識的PG損傷或血流離斷,防患于未然,故提前預判PG位置可能比最終識別的PG數目更重要。
PG誤切、血運損傷或自體移植可導致術后低鈣血癥[3,11],甲狀腺手術中發生PG誤切的比例為5.2%~21.6%[12],暫時性低鈣血癥的發生率為5%~35%,永久性低鈣血癥的發生率為0.5%~4.4%[13-14]。有前瞻性多中心RCT研究表明,241例甲狀腺全切術中應用NIRAF,將術后暫時性低鈣發生率從22%降到9%,而PG自體移植和誤切率分別從13.3%降到3.3%和11.7%降到2.5%[15]。其他對照研究表明,NIRAF組PG誤切、移植率和術后低鈣血癥發生率分別為1.1%,2.1%和5.3%,而肉眼識別組分別為7.2%,15%和20.9%[9]。在5%(7/137)的病人中,NIRAF在甲狀腺手術標本中鑒別到被誤切的PG,從而挽救性進行了PG自體移植[5]。本研究中PG總體移植率4.4%(7/158),其中2例類似,為手術醫師肉眼未察覺的誤切;另有1枚PG術中全程肉眼和熒光均未檢出,在手術標本中由NIRAF意外發現。故對于缺乏解剖標志參考、組織成分混雜的離體組織,NIRAF可以清晰客觀地展示是否存在AF,對誤切或甲狀腺床未找到的PG進行“撿漏”,指導自體移植,作為PG功能保護的“最后一道防線”。總之,應用NIRAF識別PG,提高了識別率及原位保留率,并降低自體移植率及術后低鈣血癥發生率。

A:離體標本-離體組織正面,NIRAF見自體熒光(藍色箭頭均指示甲狀旁腺);B:離體標本-離體組織反面,NIRAF熒光不明顯;C:甲狀腺床-室燈下術野;D:甲狀腺床-NIRAF成像(綠色箭頭均指示線結); E:甲狀腺床-室燈下術野;F:甲狀腺床-NIRAF成像(黃色箭頭均指示線結)
有研究發現,年齡、性別、BMI、PG大小和PG位置(上/下)與AF表現無相關性,甚至越小的PG越易被肉眼忽略,而被NIRAF捕捉到[8]。本研究也發現,NIRAF成像對于上位、下位PG的檢出無明顯差異。此外,探測到了手術區域的非特異性熒光顯影:在離體組織標本中發現,同一標本正反兩面成像效果不同(圖4A、B),術中多次發現線結有明顯的熒光成像(圖4C、D);甲狀旁腺區域呈現片狀熒光顯影,組織指向性不強(圖4E、F);皮膚毛孔、手術器械存在反光現象。這可能與介質反光、PG包膜不完整有關,造成假陽性。被覆組織的厚度也影響了NIRAF成像效果:部分病例甲狀腺腺體本身或腫瘤較大,離斷上極后,甲狀腺背側無法完全暴露,可能影響AF的充分探測,造成假陰性。可以借助拉鉤向對側拉開腺體,側向探測,旋轉手術床以升高便于探測甲狀腺床。故NIRAF(+)的定義應該為“AF信號比周圍組織亮,并且符合PG的典型大小和形狀標準”。因此,雖然在甲狀腺和其他頸部組織中可檢測到AF,但由于信號的亮度、形狀和大小的不匹配,很少會與PG的AF混淆。對于大多數腺瘤而言,熒光也是均勻的,少數情況出現不均勻的斑片狀,可能與病理表現的PG組織硬化或部分退化有關[16]。
每次NIRAF的探測過程一般需耗時2~3分鐘,術中需進行2~4次探查,且需關閉手術室燈光,理論上造成手術暫時中斷及手術時間輕微延長,但既往報道表明,應用NIRAF與常規手術的平均手術時間基本一致[9],甚至可以節省手術時間。在傳統的甲狀腺手術中,外科醫生必須持續集中精力以避免損傷這些微小、難以區分的PG腺體,往往無意切除和自體移植反而會延長手術時間。因此,NIRAF在提高外科醫生尋找辨認PG信心、改善預后的同時,并不明顯造成手術時間延長。
Paras等[17]首次報道了PG在近紅外光下的自熒光特性,國外研究多集中于臨床應用及效果評估。基于組織含量的差異,猜測可能與鈣敏感受體或者維生素D受體有關。
國內對于NIRAF的研究剛剛起步[18-20]。本研究病例數也相對偏少,未進行雙側甲狀腺術后低鈣血癥的詳細分析。初步結果表明,NIRAF與肉眼識別有較好的一致性,肯定了其高靈敏度、無需造影劑、實時、客觀、直觀等優越性,也在具體操作過程中對于拍攝角度、距離、陽性確認方式等細節把握更加精準,簡化了操作流程,在此基礎上將進行更為高質量的RCT研究,充分發揮NIRAF對于PG的預判優勢及進行離體PG的挽救性移植,更好地輔助佐證肉眼定位PG腺體,明顯減少術后HypoPT。

