全反式維甲酸暴露對斑馬魚的神經毒性效應
楊玉瑩,李平燈,金英偉,丁 強,戶業麗
1.武漢工程大學環境生態與生物工程學院,湖北 武漢430205;2.宜昌三峽制藥有限公司,湖北 宜昌 443004
全反式維甲酸(all-trans-retinoic acid,atRA)是膳食維生素A的代謝衍生物,又名維甲酸、維A甲酸等[1]。atRA作為哺乳動物中的內源性維生素A活性代謝物,它是脊椎動物發育必不可少的形態形成因子,能夠調節身體軸的形成和許多器官系統的發育[2]。由于atRA對干細胞具有很強的誘導分化以及免疫調節作用,被廣泛應用于包括急性早幼粒白血病等各種血液惡性疾病的治療中[3-4]。此外,atRA可以抑制角化過程,減少皮膚溢脂,具有抗炎殺菌作用,是臨床上治療痤瘡、銀屑病、魚鱗病等皮膚角質化異常等疾病的首選藥物[5-6]。同時,也有研究發現,過量atRA對人體具有較大的副作用,主要包括肝臟毒性[7]、發育毒性[8]、生殖毒性[9]等。Borracci P和Coluccia A研究指出成年大鼠孕期暴露atRA會造成后代長期的認知障礙[10-11],提示人類孕期應遠離atRA。atRA作為過量使用的藥物,無疑會造成水生環境的污染,通過長期接觸可能進入體內并進而影響人類和野生動物的健康。
目前,關于atRA的神經發育毒性機制僅在人胚胎干細胞與大鼠中進行了初步研究[8,10-11],atRA在水生動物中的神經毒性研究鮮見報道。相較于哺乳類動物,斑馬魚繁殖力高、胚胎發育快速且特征明確,與人類大腦組織區域具有高度相似性,具有豐富的社會學行為,是毒理學中研究神經毒性的良好體外動物模型[12-13]。因此,本研究以斑馬魚為水生動物模型,探討atRA暴露對斑馬魚胚胎及幼魚的神經毒性和相關機制。
1 實驗部分
1.1 試劑和儀器
atRA,二甲基亞砜(dimethyl sulfoxide,DMSO),甲基纖維素(methyl cellulose),多聚甲醛(美國Sigma公司);乙醇,氯仿,異丙醇(國藥集團化學試劑有限公司);逆轉錄試劑盒,SYBR-GREEN熒光染料,焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水(美國Thermo Scientific公司)。
斑馬魚養殖系統(TMG3000,武漢漢科實驗設備公司),斑馬魚行為分析儀(DanioVison,瑞士Noldus公司),體視顯微鏡(Stereo,德國ZEISS公司),光學顯微鏡(S22-ST,日本Olympus公司),純水儀(Milli-Q Advantage A10,法國Merck Millipore公司),恒溫培養箱(Blue pard,上海一恒科技公司),萊卡熒光倒置顯微鏡(Leica Application Suite,美國Leica公司),熒光定量聚合酶鏈式反應(polymerase chain reaction,PCR)儀(CFXconnec,美國Bio-Rad公司)。
1.2 實驗動物
本實驗所用斑馬魚為AB系野生魚及轉基因斑馬魚Tg[mbp(myelin basic protein):EGFP],均購買于國家斑馬魚資源中心中國科學院水生生物研究所。飼養條件如下:光照周期14 h(光)/10 h(暗)(電腦自動控制),水溫(28±0.5)℃,水體溶氧6 mg/L,水中含鹽0.25%。實驗前一晚,將成年的斑馬魚按照雌魚和雄魚2∶2(個體數目比)的比例放置于產卵缸內,次日清晨完成交配和產卵,挑選發育正常的斑馬魚胚胎用于藥物暴露實驗。
1.3 斑馬魚胚胎暴露實驗
將atRA溶解于DMSO中,配置成1 mol/L的母液,4℃避光保存,待用。實驗共設4個atRA濃度梯度:對照(0 nmol/L,DMSO質量分數0.01%),5,10和20 nmol/L,暴露液現配現用。取已受精1 h(hour post fertilization,1 hpf)的斑馬魚胚胎置于恒溫培養箱進行暴露,6孔板每孔含30枚胚胎,每個濃度設置3個平行孔,每24 h更換暴露液。
1.4 胚胎自發運動測定
從不同濃度暴露組中挑選15枚發育至24 hpf的斑馬魚胚胎,于顯微鏡下視頻記錄斑馬魚胚胎的自發胎動情況,每次1 min,重復觀察3次,使用DanioScope軟件統計單位時間內胚胎的活躍度。采用單位時間內胚胎運動時間占總測量時間的百分比作為活躍度的分析指標,以自發運動活力百分比表示。
1.5 幼魚運動行為測定分析
經atRA暴露后,每組隨機取出12條發育至120 hpf的斑馬魚幼魚進行運動行為分析測定。將選取的幼魚置于24孔板內,每孔1尾幼魚。完成準備工作后,將24孔板置于斑馬魚行為分析儀,給予光照刺激。刺激條件:5 min光照/5 min黑暗循環,測試3個循環,共30 min。各組斑馬魚平均運動速率以及總移動距離由斑馬魚行為分析儀的Ethovision軟件統計并計算。
1.6 轉基因斑馬魚形態學分析
實驗用轉基因斑馬魚Tg(mbp:EGFP),轉基因斑馬魚的髓鞘被標記綠色熒光蛋白,可用于研究斑馬魚神經組織特異性。取不同濃度組發育至72 hpf的轉基因魚Tg(mbp:EGFP),通過萊卡熒光顯微鏡,采用單熒光通道(綠色熒光激發)觀察并拍攝轉基因斑馬魚的形態變化,評估atRA不同暴露濃度對斑馬魚神經組織的毒性作用(評價指標:大腦及脊椎熒光強度)。
1.7 總RNA提取
斑馬魚胚胎暴露至72 hpf時,不同濃度組各取30條幼魚于1.5 mL EP管內,吸干水分,使用高通量組織研磨器破碎研磨斑馬魚。隨后,按照總核糖核酸(ribonucleic acid,RNA)提取試劑盒操作說明提取總RNA。利用NanoDrop 2000測定提取RNA的純度(A280/A260值1.8~2.0)和濃度,并使用逆轉錄試劑盒[revertaid first strand cdna(complementary deoxyribonucleic acid)synthesis kit]逆轉錄RNA,獲得cDNA,?20℃,保存備用。
1.8 qRT-PCR檢測基因的表達
使 用SYBRTM Select Master Mix(Thermo Fisher Scientific,USA)進行實時定量聚合酶鏈式反應(real-time quantitative polymerase chain reaction,qRT-PCR)。熒光定量PCR總反應體系10.0μL:上下游引物各0.8μL,cDNA模板1.0μL,SYBR GREEN染料酶5.0μL,無菌水2.4μL。PCR反應程序如下:95℃預變性3 min;95℃變性10 s;55℃退火10 s;72℃延伸20 s(循環40次)。以擴增循環數(cycle threshold,CT)值表示達到閾值的循環數,β-actin為內參,利用2-ΔΔT來計算mRNA轉錄水平的相對變化。
qRT-PCR實驗使用的引物序列如表1所示。
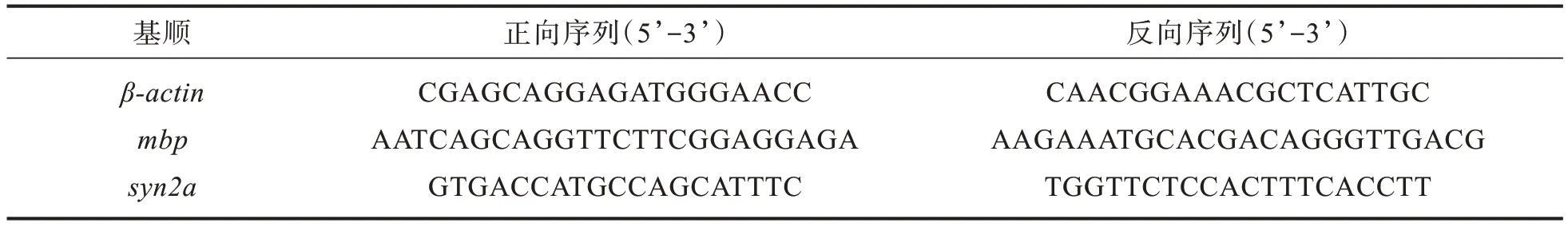
表1 qPCR的引物序列Tab.1 Primer sequence for qPCR
1.9 統計與分析
實驗數據使用SPSS 16.0(SPSS Company,Chicago,IL,USA)軟件進行統計,并在Graphpad Prism 7(Graphpad Software,La Jolla,CA,USA)軟件中進行數據分析。顯著性差異由單因素方差分析法(One way-ANOVA)計算,其中*p<0.05代表有顯著性差異,實驗結果用平均值±標準誤差表示。
2 結果與討論
2.1 atRA暴露對胚胎自發運動的影響
斑馬魚自主胎動是胚胎尾部的自主擺動,不受大腦神經元的控制,是能夠檢測到的最早神經行為[14],常常被作為評估斑馬魚早期神經發育毒性的指標之一。對照組及不同atRA濃度暴露24 hpf斑馬魚胚胎的自發運動活力測定結果如圖1所示。與對照組相比,atRA暴露可顯著抑制斑馬魚早期自發的神經活動,且具有濃度依賴性,當暴露濃度在10和20 nmol/L時,自發運動活力百分比相對于對照組分別下降25.6%和50.8%(p<0.05)。這提示atRA對斑馬魚幼魚具有神經毒性,可通過影響斑馬魚脊柱區域的一些神經細胞,從而改變斑馬魚胚胎的自主胎動行為。
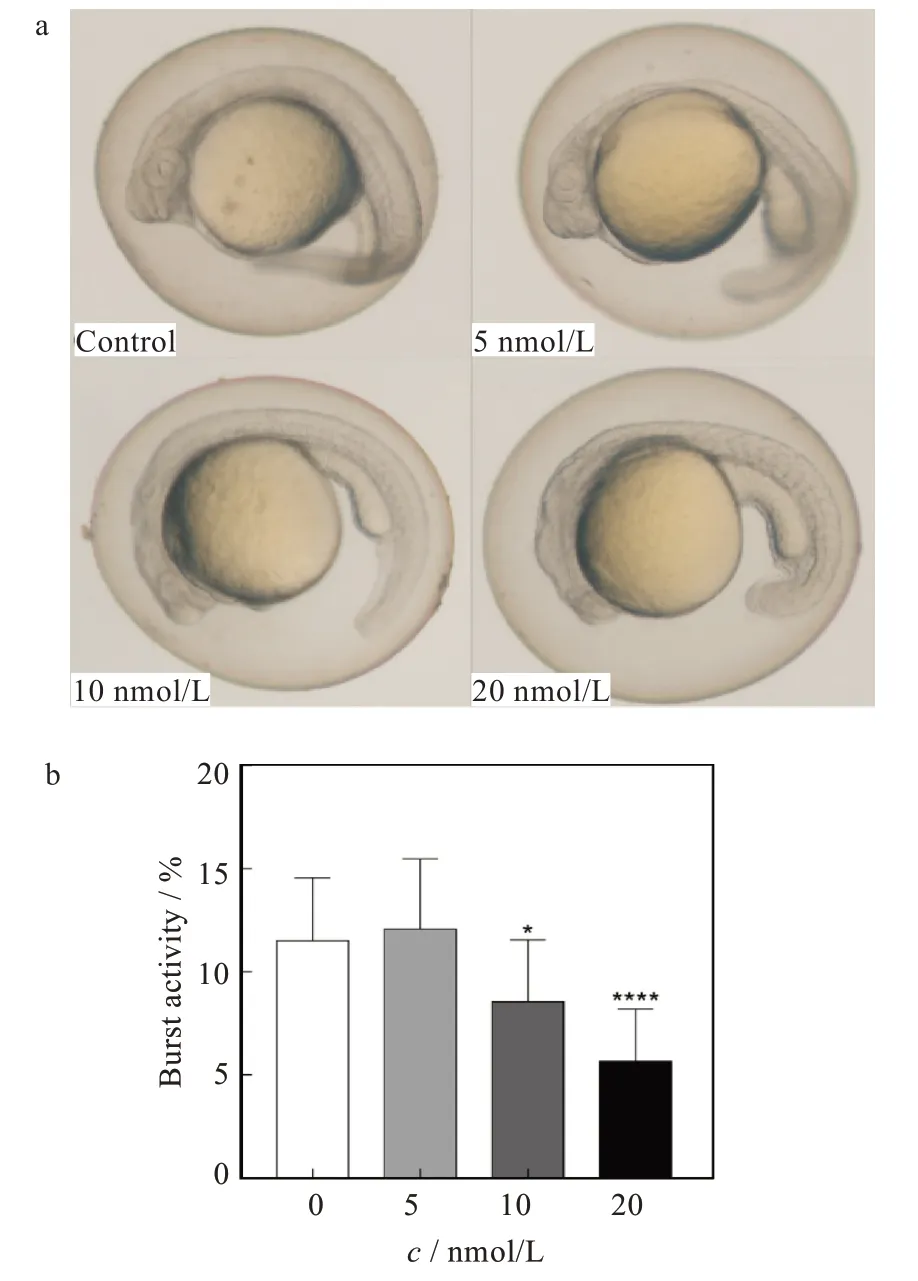
圖1 不同濃度atRA暴露對胚胎自發運動的影響:(a)胚胎自發運動,(b)胚胎自發運動活力百分比Fig.1 Effects of exposure to ATRA with different concentrations on embryo spontaneous movement:(a)embryo spontaneous movement,(b)percentage of embryo spontaneous movement
2.2 atRA暴露對幼魚運動行為的影響
在30 min檢測時間內,120 hpf的幼魚在不同濃度暴露組以及不同光暗周期的運動活力如圖2所示。結果顯示幼魚對光暗轉換的刺激較為敏感,表現出運動活力交替上升和下降。在明亮期,20 nmol/L組斑馬魚幼魚的游動速率為0.5 mm/s,對照組為1.3 mm/s;在黑暗期,20 nmol/L組斑馬魚幼魚的游動速率為0.6 mm/s,對照組為1.5 mm/s。且幼魚游動速度在暗環境下降趨勢表現得更加明顯,表明幼魚對暗刺激反應更為強烈;而在同一光暗周期內,其運動活力隨著atRA暴露濃度的增加出現明顯下降,且降低程度具有一定的濃度依賴性。低濃度暴露劑量對斑馬魚的運動速率影響較低,無論是光環境還是暗環境,其運動距離和運動速率變化均不明顯;而隨著atRA暴露濃度的升高,幼魚平均運動距離和運動速度均出現下降趨勢,這可能是因為atRA的暴露造成了斑馬魚幼魚神經組織受損,引發神經肌肉協調性的中斷,從而造成幼魚行為異常且反應遲鈍。
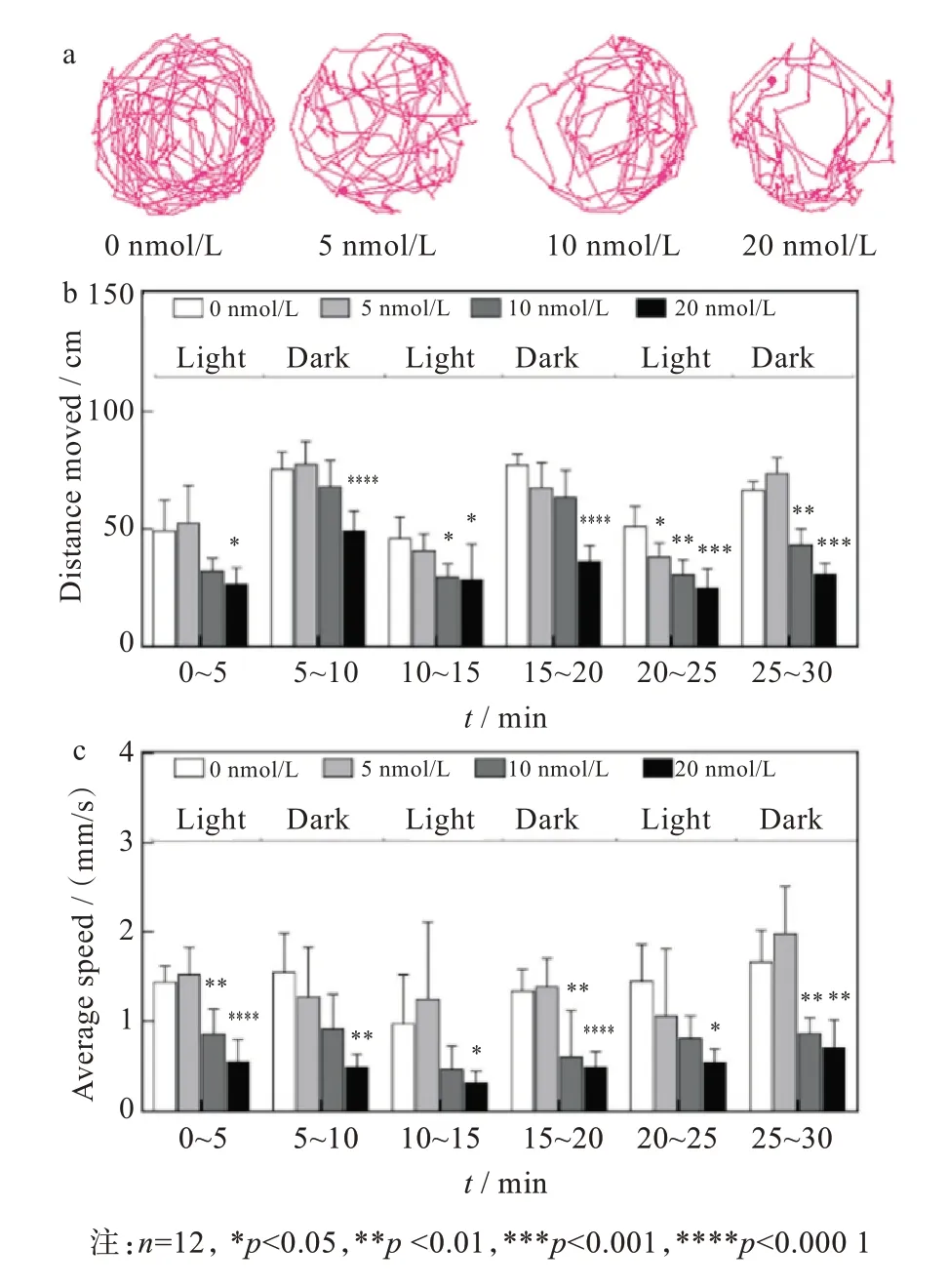
圖2 不同濃度atRA暴露對幼魚運動行為的影響:(a)幼魚的運動軌跡,(b)幼魚游動距離的變化,(c)幼魚游動平均速度的變化Fig.2 Effects of exposure to atRA at different concentrations on motor behavior of larval fish:(a)movement trajectory of larval fish,(b)variation of swimming distance of larval fish,and(c)variation of average swimming speed of larval fish
2.3 atRA暴露誘導斑馬胚胎神經毒性
MBP是中樞神經系統髓鞘中的主要蛋白,具有神經組織特異性[15],熒光標記轉基因魚Tg(mbp:EGFP)神經元可以直接觀測斑馬魚的神經系統發育情況。在atRA(20 nmol/L)暴露至72 hpf,轉基因斑馬魚Tg(mbp:EGFP)胚胎神經系統發育狀況如圖3所示。結果顯示,斑馬魚神經發育出現明顯異常,主要表現為腦部神經中樞的形態缺陷和結構復雜程度的顯著減少。整體熒光強度定量結果顯示,20 nmol/L atRA暴露組胚胎的總熒光強度相對對照組下降38.7%,表明mbp蛋白表達減少,這些結果進一步證實了atRA可以導致斑馬魚神經發育畸形。
圖3 atRA暴露對斑馬魚胚胎具有神經發育毒性:(a)斑馬魚胚胎神經發育畸形,(b)mbp熒光蛋白表達強度Fig.3 Neurodevelopmental toxicity of exposure to atRA over zebrafish embryos:(a)neurodevelopmental malformations in zebrafish embryos,(b)expression intensity of mbp fluorescent protein
2.4 atRA對斑馬魚胚胎神經發育相關基因表達的影響
有研究[16-17]報道,有毒化合物通過抑制斑馬魚神經發育關鍵基因mbp和突觸蛋白基因syn2a的表達來誘導神經毒性。本研究利用熒光PCR儀測定了mbp與syn2a基因的相對表達量,結果如圖4所示,syn2a的表達量在高濃度(20 nmol/L)暴露組中出現明顯下調,僅為對照組的41.2%;mbp的表達也明顯受到了atRA的抑制,為對照組的54.6%,這與atRA暴露mbp標記熒光蛋白轉基因斑馬魚的總體熒光強度變化是一致的。揭示atRA可能通過調節這些神經基因的表達,從而影響斑馬魚的運動,誘導了神經毒性。

圖4 atRA暴露對斑馬魚神經發育相關基因表達的影響Fig.4 Effects of exposure to atRA on expression of neurodevelopmental genes in zebrafish
3 結 論
atRA暴露斑馬魚胚胎后,能顯著抑制斑馬魚胚胎自主運動、幼魚游動的總運動距離和平均運動速度,并且在分子水平上抑制神經相關基因mbp與syn2a的表達,從而干擾斑馬魚胚胎早期的神經發育及行為活力,具有典型的神經毒性,更深入的內在機制有待進一步研究。本研究可為atRA在水生動物體內的神經毒性作用機制提供有價值的理論依據,并為atRA臨床使用的劑量及安全性提供一定的參考作用。

