可注射型富血小板纖維蛋白對人根尖牙乳頭干細胞生物學行為的影響
潘 菁,曹子蔚,管 贇,蔣備戰(zhàn)
年輕恒牙易受齲病、外傷、感染等因素影響導致牙髓壞死甚至是根尖周炎。牙髓再生作為治療年輕恒牙牙髓壞死的新方法,有誘導根管壁增厚、根尖閉合、神經(jīng)血管再生等優(yōu)勢,可以獲得較為理想的治療效果[1]。
富血小板纖維蛋白(platelet rich fibrin,PRF)是二代血小板濃縮產品,具有調節(jié)免疫應答和促進組織愈合的作用,Choukroun等[2]在此基礎上提出可注射型富血小板纖維蛋白(injectable platelet rich fibrin,iPRF)。iPRF的三維纖維蛋白網(wǎng)中富含血小板、白細胞、Ⅰ型膠原蛋白、骨鈣素和多種生長因子,可成為促進軟硬組織愈合的良好載體[3]。
本實驗擬探究iPRF的生長因子含量及其對根尖牙乳頭干細胞的增殖、遷移和成骨/成牙向分化的影響,為后續(xù)的牙髓再生治療提供實驗基礎。
1 材料與方法
1.1 主要材料和儀器
胰酶、α-MEM不完全培養(yǎng)基、青霉素/鏈霉素、PBS、茜素紅染色液(凱基,中國);胎牛血清(Gibco,美國);細胞培養(yǎng)皿、離心管、細胞培養(yǎng)板、Transwell板(Coring,美國);CCK-8試劑盒(翊圣,中國);ELISA試劑盒(博士德,中國);倒置顯微鏡(Nikon,日本);細胞總RNA提取試劑盒、實時定量熒光聚合酶鏈反應(quantitative real time polymerase chain reaction,qRT-PCR)試劑盒(TaKaRa,日本);膠原酶、地塞米松、抗壞血酸、β-甘油磷酸鈉(Sigma,美國)。
1.2 細胞培養(yǎng)
收集因阻生拔除的第三磨牙(根尖孔未閉合),剪碎根尖部軟組織并用胰蛋白酶消化處理,置于37 ℃、5% CO2的培養(yǎng)箱中培養(yǎng)獲得人根尖牙乳頭干細胞(human stem cells from apical papilla, hSCAPs)。培養(yǎng)基由10%胎牛血清、1%青霉素/鏈霉素和α-MEM不完全培養(yǎng)基制成。本實驗所獲取的hSCAPs已經(jīng)過課題組前期鑒定[4],選取第4代hSCAPs用于后續(xù)實驗。
1.3 可注射型富血小板纖維蛋白提取液(injectable platelet rich fibrin extracts,iPRFe)的制備
本實驗經(jīng)過同濟大學倫理委員會批準(倫理審查編號:2018-012),所有志愿者知情同意。選取健康男性8例,年齡25~40歲,血常規(guī)示血小板計數(shù)正常。分別抽取志愿者10 mL靜脈血,以700 r/min的速率低溫離心3 min,上層即為iPRF,吸取上層液體狀物質凍干成膜,研磨成粉,浸入50 mL α-MEM不完全培養(yǎng)基中,24 h后通過0.22 μm濾器過濾,得到液體定義為1×iPRFe,放入-20 ℃冰箱待用。
1.4 ELISA法測定iPRFe相關因子含量
取出待用iPRFe,按ELISA試劑盒說明書分別檢測iPRFe中血小板衍生生長因子-BB(platelet derived growth factor-BB,PDGF-BB)、胰島素樣生長因子1(insulin-like growth factor 1,IGF1)和轉化生長因子β1(transforming growth factor β1,TGFβ1)的含量。測定450 nm吸光度值,并根據(jù)曲線計算相應結果。
1.5 iPRFe對hSCAPs增殖的影響
將1×iPRFe用α-MEM不完全培養(yǎng)基分別稀釋至1/2×、1/4×和1/8×濃度,并加入10%胎牛血清和1%青霉素/鏈霉素制成條件培養(yǎng)液,對照組不含iPRFe。將hSCAPs以2×103個/孔接種于96孔板,待細胞貼壁24 h后換用條件培養(yǎng)液。每組設置6個復孔,每孔200 μL液體,于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng),隔天換液。分別于第1、3、5天取出檢測,棄去原培養(yǎng)液,PBS清洗3次,加入含有10% CCK-8試劑的100 μL PBS,孵育1 h后取出,酶標儀測定各孔450 nm處吸光度值,記錄結果。選取促進hSCAPs增殖最佳濃度的iPRFe進行后續(xù)實驗的比較。
1.6 Transwell實驗檢測iPRFe對hSCAPs遷移的影響
實驗分為2組:對照組(由10%胎牛血清、1%青霉素/鏈霉素和89% α-MEM不完全培養(yǎng)基制成的培養(yǎng)基培養(yǎng))和iPRFe組(含10%胎牛血清、1%青霉素/鏈霉素和促進增殖最佳濃度的iPRFe培養(yǎng)液培養(yǎng))。常規(guī)將hSCAPs細胞懸液以2×105個/mL的密度接種至6孔Transwell板的上室,下室加入各組條件培養(yǎng)基,于37 ℃、5%的CO2培養(yǎng)箱中培養(yǎng)24 h。取出Transwell小室,PBS沖洗,4%多聚甲醛溶液固定,棉拭子擦去膜上面未遷移的細胞,PBS沖洗,0.1%結晶紫染色。顯微鏡觀察并拍照。3%醋酸溶液脫色,酶標儀測定各孔570 nm處吸光度值,記錄結果。
1.7 茜素紅檢測iPRFe對hSCAPs礦化的影響
配制礦化誘導條件培養(yǎng)基(osteogenic medium,OM):α-MEM不完全培養(yǎng)基、10%胎牛血清、1%青霉素/鏈霉素、終濃度分別為10 mmol/L的β-甘油磷酸鈉、0.05 mmol/L的抗壞血酸和0.1 μmol/L的地塞米松。實驗分為3組:對照組(空白細胞培養(yǎng)液)、OM組(僅含OM)和iPRFe組(OM+iPRFe)。將hSCAPs接種至6孔細胞培養(yǎng)板內,待細胞融合至80%,分別加入各組誘導培養(yǎng)基,每2 d換液,分別培養(yǎng)7、14、21 d。取出細胞培養(yǎng)板,PBS沖洗,4%多聚甲醛溶液固定,茜素紅染色,PBS沖洗,拍照。1 mmol/L氯化十六烷基吡啶脫色,紫外分光光度儀檢測562 nm處吸光度值,記錄結果。
1.8 qRT-PCR檢測成骨/成牙向分化相關基因的表達
實驗分組同1.7。按1.7方法礦化誘導培養(yǎng)7、14、21 d后用TRIzol分別提取OM組、iPRFe組與對照組hSCAPs的總RNA,逆轉錄合成cDNA。檢測堿性磷酸酶(alkaline phosphatase,ALP)、牙本質基質蛋白1 (dentin matrix protein 1,DMP1)、牙本質涎磷蛋白(dentin sialophosphoprotein,DSPP)和骨鈣素(osteocalcin, OCN)的mRNA表達情況。所用引物由生工生物工程(上海)股份有限公司合成,引物序列見表1。

表1 GAPDH、ALP、DSPP、DMP1、OCN引物序列Tab.1 Primer sequences of GAPDH, ALP, DSPP, DMP1, OCN
1.9 統(tǒng)計分析
相同實驗重復3次,實驗數(shù)據(jù)為均值±標準差,由SPSS 20.0軟件進行單因素方差分析,P<0.05為差異具有統(tǒng)計學意義。
2 結 果
2.1 iPRFe的因子含量
ELISA結果顯示,iPRFe中有PDGF-BB、TGFβ1和IGF1等細胞因子,且TGFβ1和IGF1的含量較高,而PDGF-BB的含量則相對較低(圖1)。
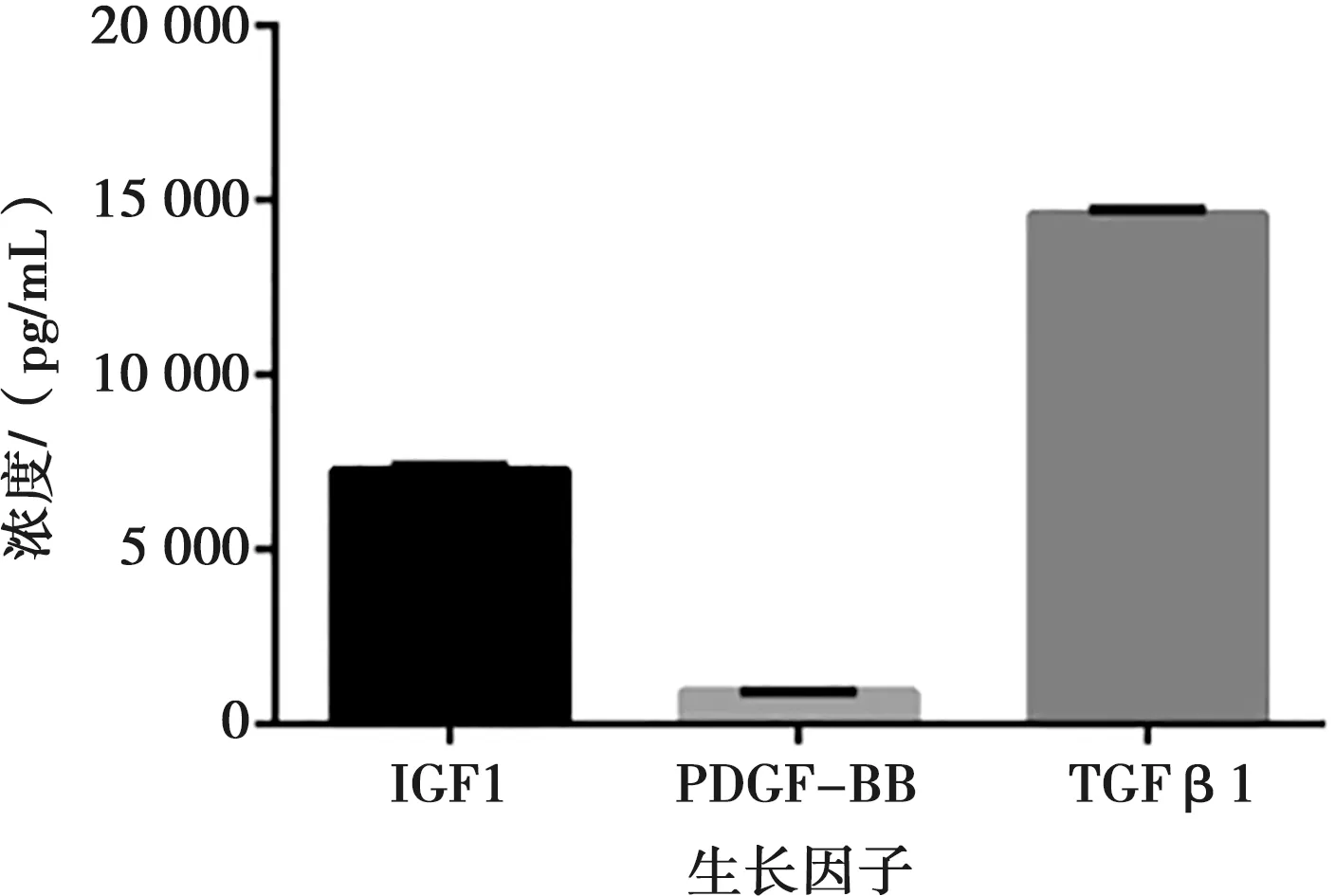
圖1 iPRFe生長因子含量Fig.1 The content of growth factors in iPRFe
2.2 iPRFe對hSCAPs增殖的影響
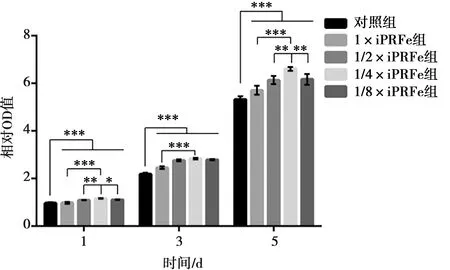
將hSCAPs培養(yǎng)1、3、5 d后發(fā)現(xiàn),所有濃度的iPRFe均明顯促進細胞增殖;與對照組相比,濃度為1×組明顯促進細胞增殖,但低于1/4×組(P<0.05),與其余組間無差異(P>0.05)。1 d和5 d時,在iPRFe濃度1/4×時,細胞增殖量較濃度為1/2×明顯增加(P<0.05);而濃度為1/8×時,細胞增殖量比濃度為1/4×時稍低,差異有統(tǒng)計學意義(P<0.05)。因此在所有濃度中,1/4×iPRFe對hSCAPs的增殖促進效果最佳(圖2)。
2.3 iPRFe對hSCAPs遷移的影響
將hSCAPs置于1/4×濃度的iPRFe中培養(yǎng)24 h,觀察細胞遷移量。結果可見iPRFe組(圖3B)細胞遷移數(shù)目明顯多于對照組(圖3A)。定量結果顯示,iPRFe組的細胞遷移量明顯高于對照組,差異具有統(tǒng)計學意義(P<0.05)(圖3C)。
*:P<0.05,**:P<0.01,***:P<0.001
2.4 iPRFe對hSCAPs礦化的影響
hSCAPs在經(jīng)過礦化誘導培養(yǎng)后,7 d可見iPRFe組的礦化結節(jié)染色均比對照組和OM組的更深。隨著時間推移,OM組的染色逐漸變深,且比對照組明顯;iPRFe組的礦化結節(jié)染色比對照組和OM組的深染更明顯。定量結果顯示,7、14、21 d時OM組和iPRFe組的染色均明顯高于對照組,差異具有統(tǒng)計學意義(P<0.05),且相同時間點,iPRFe組比OM組深染(圖4)。
2.5 iPRFe對成骨/成牙向分化相關基因表達的影響
hSCAPs經(jīng)過礦化誘導7 d,OM組和iPRFe組的ALP、DMP1和DSPP的表達均升高,iPRFe組的OCN表達明顯升高,但OM組OCN表達與對照組相比無明顯差異;除DSPP和OCN外,iPRFe組的升高量明顯高于OM組(P<0.05)。誘導培養(yǎng)中后期14 d及21 d時,iPRFe組的ALP、DMP1、DSPP和OCN的表達均明顯升高,且高于OM組(P<0.05)(圖5)。
3 討 論
成功的牙髓再生,離不開三個基本要素,即種子細胞(干細胞)、支架材料和生長因子。目前已有多種血小板濃縮制品,包括PRF、濃縮生長因子等,含有各種活性因子,同時具有三維網(wǎng)狀支架結構,且無需添加任何其他生物來源制劑,避免了倫理道德爭議和疾病傳播的風險,可以作為牙髓再生較為理想的選擇。研究表明,PRF和濃縮生長因子均能促進牙髓再生[5-6]。PRF是凝膠狀,應用于根管內需要經(jīng)過一定的修剪,而iPRF在具有PRF和濃縮生長因子相似優(yōu)點的同時,臨床操作的便利性大大提升。
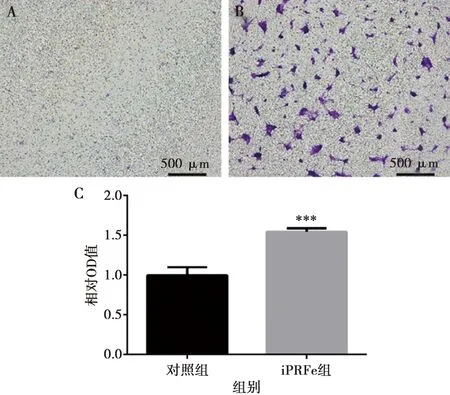
A:對照組Transwell結果;B:iPRFe組Transwell結果;C:對照組和iPRFe組hSCAPs細胞遷移結果分析;***:與對照組相比,P<0.001
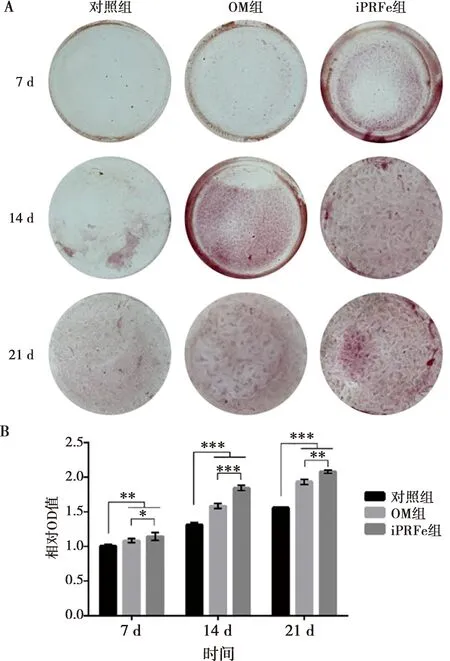
A:不同培養(yǎng)液培養(yǎng)hSCAPs茜素紅染色結果;B:茜素紅染色結果的礦化水平分析,*:P<0.05,**:P<0.01,***:P<0.001
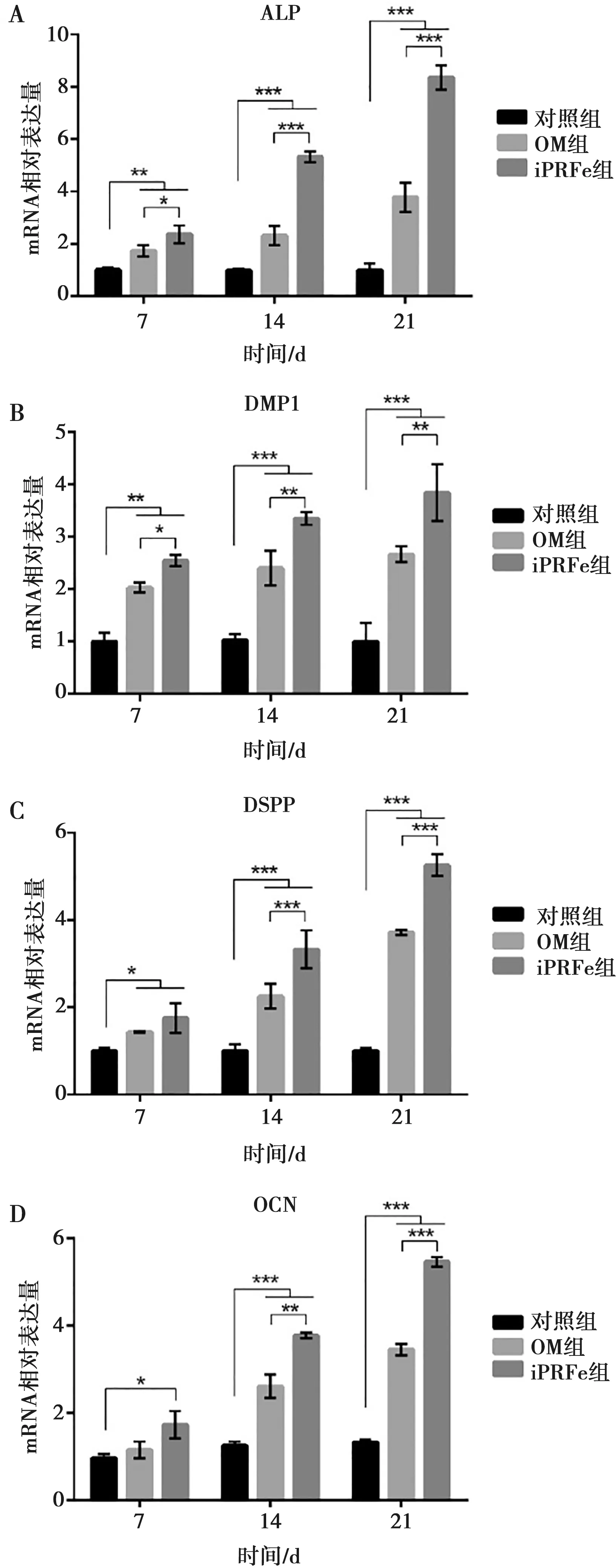
A:ALP表達水平;B:DMP1表達水平;C:DSPP表達水平;D:OCN表達水平;*:P<0.05,**:P<0.01,***:P<0.001
hSCAPs是基于內源性細胞歸巢模式牙髓再生治療中的主要干細胞來源之一,存在于未發(fā)育完全的恒牙根尖周組織中,是一種具有自我更新能力和多向分化潛能的成體間充質干細胞。與其他牙源性干細胞相比,hSCAPs的增殖率高于人牙髓干細胞和人牙周膜干細胞[7-8]。基質細胞衍生因子-1、TGFβ1等趨化因子可促進hSCAPs的遷移,在基于細胞歸巢再生的根管治療中均可能得到臨床應用[9-10]。因此,本實驗研究了iPRFe對hSCAPs增殖、遷移和礦化的影響,結果表明iPRF在牙髓再生中可能有較為理想的效果。
PDGF-BB是一種重要的促有絲分裂因子,對單核細胞、中性粒細胞、間充質干細胞及成骨細胞產生趨化作用,促進組織愈合。IGF1是牙體及骨組織修復的關鍵生長因子,可調控間充質干細胞的成牙及成骨向分化[11]。TGFβ1作為骨形成和吸收的調節(jié)因子,可通過上調ALP水平促進鈣化沉積[12],也能促進細胞進一步分泌細胞外基質相關成分。本實驗中,iPRFe含有較高濃度的TGFβ1和IGF1,推測其與iPRFe促進hSCAPs的成牙及成骨向分化有關,但PDGF-BB含量相對較低,提示hSCAPs的增殖、遷移可能還與其他生長因子相關。
在本實驗中,iPRF能促進hSCAPs的增殖和遷移。1、5 d時,1/8×濃度的iPRFe促增殖效果低于1/4×濃度的iPRFe,可能與VEGF、PDGF、堿性成纖維細胞生長因子等生長因子含量下降有關[13]。在所選濃度中,濃度為1/4×的促增殖效果最佳,表明生長因子的含量并非越高越好,而是在一個合適的濃度的情況下,作用效果最佳。有學者猜測血小板濃縮制品濃度過高產生的抑制作用是因為其不僅含有促進組織愈合的生長因子,也含有一些炎癥因子,如血小板反應蛋白、血小板因子4等,濃度過高時則會反向抑制[14]。總之,iPRF含有多種細胞因子,作用復雜多樣,其作用機制還有待進一步研究。
成骨分化過程的關鍵步驟包括細胞增殖、胞外基質形成以及基質礦化[15]。在骨形成中,ALP是起關鍵作用的標志物,并與早期細胞的成骨分化有關[16]。Chen等[17]將PRF和牙髓干細胞植入裸鼠體內,成功得到牙髓牙本質樣組織,ALP的mRNA表達水平在7、14 d均有明顯的升高。同樣本實驗中,7、14、21 d中iPRFe組ALP的mRNA表達水平均比對照組和OM組有明顯地升高,提示iPRF早期就能促進hSCAPs的成骨向分化。Saeed等[18]研究表明,PRF可以促進人牙髓干細胞的成骨分化,茜素紅染色礦化結節(jié)更明顯。此實驗中,與正常組和礦化誘導組相比,iPRFe組hSCAPs的茜素紅染色顯示礦化結節(jié)相對更明顯,且在14 d和21 d時,OCN的mRNA表達水平均比OM組更明顯,表明iPRF可促進細胞成骨分化。牙髓損傷和修復的機制包括干細胞成牙本質向分化和第三期牙本質的分泌[19]。成牙本質細胞是分泌牙本質的關鍵細胞,特異性地表達一些標記分子,如DSPP和DMP1[20]。Chen等[17]研究PRF在體外對牙髓干細胞分化的影響中,發(fā)現(xiàn)培養(yǎng)7 d和14 d的DSPP的表達無差異,DMP1在7、14和21 d均持續(xù)升高,但在本研究中iPRFe組DSPP的表達從14 d開始較OM組有明顯升高,可能是由于細胞種類不同;而DMP1的表達趨勢與本研究一致,表明iPRF能夠促進hSCAPs的成牙向分化。因此,iPRF可以促進hSCAPs的成牙/成骨向分化。
綜上所述,本研究證明了iPRF能促進hSCAPs的增殖、遷移和成骨/成牙向分化,為可注射型富血小板纖維蛋白應用于牙髓再生提供了一定的前期基礎,但具體的機制以及應用于體內牙髓再生的效果仍需進一步探究。

