新型磁性螯合納米材料對水中Cd2+的吸附性能
郭曉婧 張志毅 郭掌珍
(山西農業大學資源與環境學院,山西 太谷 030801)
隨著城市工業化的發展,大量的廢水排放使得重金屬污染已經發展成為普遍存在的全球性問題。鎘(Cd)是一種具有較強毒性的重金屬,易通過食物鏈富集,并可在環境中經代謝轉化或與其他污染物通過聯合作用表現出復雜的毒性作用[1-2]。因此,水體Cd污染控制引起了科學家的廣泛關注。目前,廢水中重金屬的去除方法主要有化學沉淀法、混凝法、離子交換法、膜過濾法、生物法和吸附法等[3-4],其中,吸附法因處理工藝簡單、吸附效能高、能耗少、成本低等優點,得到了廣泛應用[5],開發高效吸附劑成為近年研究的熱點。常見的吸附劑包括生物炭[6]、粘土礦物[7]、離子交換樹脂[8]等。而理想的吸附劑應具備環境友好、吸附性能高、選擇性好的特點,并且易于從環境介質中移除,同時具有一定的再生性能[3]。
Fe3O4等磁性納米粒子比表面積大、易于分離,可通過表面修飾或包裹等方法改善性能,接枝多種官能團,用于吸附水體中的生物分子[9]、有機污染物[10]和重金屬離子[11]等,成為當前環境修復材料的熱點。當前,主要采用表面活性劑、聚合物、天然礦物、生物炭等材料,以及多材料復合等方式對磁性材料進行修飾[12-14],其中,SiO2因易于功能化,且具有良好的熱穩定性和化學穩定性常被用于包覆納米Fe3O4,改善Fe3O4易團聚、易氧化等缺點[15]。同時為提升SiO2包覆的核殼結構磁性納米Fe3O4材料吸附的性能、效率和選擇性,通常會進一步進行表面修飾或功能化,如氨基功能化、羧基功能化和硫醇功能化等[16-17]。二乙基二硫代氨基甲酸鈉(diethyldithiocarbamate,DDTC)是一種含硫原子的重金屬捕集劑,可與金屬元素形成穩定的螯合物,常被用于水中重金屬的感應或檢測[18-19]。近年來,DDTC也被用于吸附材料的修飾和改性,以增強吸附材料對重金屬的選擇吸附性能[19-20]。有研究表明,DDTC和聚苯胺修飾可有效提高納米Fe3O4對水介質中Hg、As和Pb的吸附去除能力[19];海泡石-DDTC復合體被證明是一種潛在的土壤重金屬鎘修復材料[21]。但有關Fe3O4@SiO2經DDTC改性后形成的磁性螯合納米材料對Cd吸附性能的報道尚鮮見。
本研究采用螯合劑DDTC對Fe3O4@SiO2進行表面修飾,制備一種新型磁性螯合納米吸附劑(Fe3O4@SiO2-DDTC),采用掃描電鏡(scanning electron microscope,SEM)、X射線衍射(X-ray diffraction,XRD)、振動磁強計(vibrating sample magnetometer,VSM)及傅里葉紅外(fourier transform infrared spectrometry,FT-IR)等對材料進行表征,結合X射線光電子能譜分析(X-ray photoelectron spectroscopy,XPS)吸附機理,并進行批次試驗研究不同吸附條件對吸附過程的影響,以期為磁性材料應用于Cd污染廢水處理提供參考,為水中Cd2+的去除提供一種高效、經濟的解決途徑。
1 材料與方法
1.1 試驗材料
FeCl2·4H2O、FeCl3·6H2O、氨水、正硅酸乙酯(tetraethyl orthosilicate,TEOS)、聚乙二醇 4000(macrogol 4000,PEG 4000)、NaOH、HNO3、NaCl、KCl、MgCl2、CaCl2和無水乙醇均為分析純,購自天津市科密歐化學試劑有限公司;DDTC,優級純,購自上海展云化工有限公司。
1.2 試驗設計
1.2.1 Fe3O4@SiO2-DDTC的制備 參考文獻[22],采用堿性共沉淀法制備得到Fe3O4。取20 g PEG 4000溶于100 mL去離子水中,11.68 g FeCl3·6H2O和4.3 g FeCl2·4H2O分別溶于50 mL去離子水中,并與50 mL PEG 4000溶液混合,移入反應瓶中,在90℃氮氣保護條件下,逐滴加入氨水與剩余PEG 4000溶液至pH值為堿性,劇烈機械攪拌(200 r·min-1)2 h得到黑色懸濁液,在外加磁場作用下將黑色Fe3O4顆粒從溶液中分離,并先后用超純水和無水乙醇清洗數次,最后放入真空干燥箱中60℃烘干,研磨保存備用。
稱取0.5 g Fe3O4超聲分散于175 mL醇/水(V/V=6∶1)溶液中,滴加3 mL氨水,控制反應溫度為30℃,轉速為200 r·min-1,攪拌30 min后,緩慢滴加2.5 mL TEOS,得到由硅層包覆的Fe3O4(Fe3O4@SiO2)。最后,逐滴加入50 mL 0.09 mol·L-1DDTC(1.0 g)溶液進行改性,反應6 h,將得到的黑褐色顆粒用去離子水和無水乙醇分別清洗6次以上,60℃真空烘干備用。
1.2.2 吸附試驗 將Cd(NO3)2溶于去離子水中,配制得到濃度為1 g·L-1的Cd2+貯備液,用HNO3和NaOH調節溶液pH值為7.0,配置40 mL 20 mg·L-1的Cd2+使用液于50 mL離心管中,加入20 mg Fe3O4@SiO2-DDTC或Fe3O4@SiO2后在氣浴恒溫振蕩箱內以180 r·min-1的速度持續振蕩12 h,強磁分離,并取上清液測定溶液中Cd2+的剩余濃度。
批次試驗中用控制變量法考察不同反應條件對吸附的影響。溶液pH值設定為3、4、5、6、7、8;選用Na+、Mg2+兩種離子,離子強度分別設置為0(CK)、0.005、0.01、0.05、0.1 mol·L-1,考察共存離子強度對吸附性能的影響;在不同時間點取樣(5、10、25、40、60、120、240、480、720、1 440 min)進行吸附動力學試驗探究;在不同溫度條件下(25、35、45℃),探究不同Cd2+溶液初始濃度(5、10、20、30、50、100 mg·L-1)對吸附性能的影響。
1.2.3 Fe3O4@SiO2-DDTC再生試驗 按1.2.2所述方法進行吸附試驗,用含4%硫脲的0.5 mol·L-1HNO3溶液作為洗脫劑,對磁回收得到吸附材料進行解吸,并用去離子水洗滌數次,烘干后再次吸附,重復4次吸附-脫附試驗考察其重用性能。
1.3 測定項目與方法
1.3.1 材料表征 SEM分析:采用SU8220型場發射掃描電子顯微鏡(日本,日立)掃描Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-DDTC三種材料,樣品噴金處理,觀察結構特征和粒徑大小;FT-IR分析:采用溴化鉀粉末壓片法,用Tensor 27型傅里葉紅外儀(德國,布魯克)對材料表面官能團進行表征,分辨率4 cm-1,掃描范圍500~4 000 cm-1;XRD分析:采用D8 Advance型X射線衍射儀(德國,布魯克)分析材料晶體結構,以2°·min-1掃描,角度范圍10~90°;VSM分析:用Ppms Dynacool型振動樣品磁強計系統(美國,Quantum Deign)記錄材料的磁滯回線;XPS分析:采用EscaLab 250Xi型X射線光電子能譜儀(美國,Thermo Fisher)對樣品元素進行測定分析[22]。
1.3.2 重金屬含量測定 用5300DV電感耦合等離子體發射光譜儀(美國,PerkinElmer)測定溶液中Cd2+的濃度[12]。試驗設置3個平行,取算術平均值根據公式計算吸附試驗中Cd2+的去除率(R,%)和吸附量(qe,mg·g-1):
(1)
(2)
式中,C0為溶液中Cd2+的初始質量濃度,mg·L-1;Ce為吸附達到平衡時溶液中Cd2+的濃度,mg·L-1;V為溶液體積,mL;m為吸附劑的重量,mg。
1.4 數據分析
1.4.1 吸附動力學模型 為了研究Fe3O4@SiO2和Fe3O4@SiO2-DDTC吸附材料對Cd2+的吸附過程的吸附機制,用準一級動力學(3)和準二級動力學模型(4)進行擬合:
qt=qe(1-e-tK1)
(3)
(4)
式中,qe為吸附平衡時的吸附容量,mg·g-1;qt為吸附時間為t時的吸附容量,mg·g-1;t為吸附時間,min;K1為一級吸附速率常數,min-1;K2為二級吸附速率常數,g·mg-1·min-1。
1.4.2 吸附等溫線模型 采用Langmuir(5)和Freundlich(6)等溫吸附模型對試驗數據進行擬合:
(5)
(6)
式中,Ce為吸附達到平衡時溶液中Cd2+的濃度,mg·L-1;qe為吸附平衡時吸附劑對溶液中Cd2+的吸附量,mg·g-1;qm為吸附劑單層最大吸附量,為mg·g-1;KL和KF分別為Langmuir和Freundlich的吸附常數,單位分別為L·mg-1和(mg·g-1)(L·mg-1)1/n;n為非均質系數,隨材料的不均勻性發生變化。
以上試驗數據均用Origin軟件擬合并作圖。
2 結果與分析
2.1 材料的表征
2.1.1 XRD分析 由圖1可知,吸附劑具有較高的結晶性,Fe3O4在30.1°、35.4°、43.1°、53.4°、56.9°、62.5°處出現特征衍射峰,證實了Fe3O4的方尖晶石結構,且這些特征衍射峰在Fe3O4@SiO2、Fe3O4@SiO2-DDTC樣品中均可觀察到。
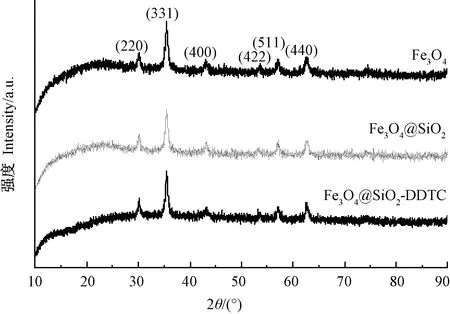
圖1 不同納米材料的XRD
2.1.2 SEM分析 由圖2可知,3種材料均呈球狀顆粒,且因具有超順磁性,有明顯的團聚現象,這與類似研究結果一致[23-24]。為定量分析3種材料的粒徑大小,運用Imagej軟件統計60顆以上顆粒,繪制粒徑分布直方圖,得到Fe3O4@SiO2-DDTC的粒徑為115~125 nm,標準差為13 nm,約75%的顆粒在該粒徑范圍內。Fe3O4和Fe3O4@SiO2的粒徑依次為19~23 nm和37~47 nm。由Fe3O4@SiO2的EDS光譜圖(圖2-d)可知,Fe3O4@SiO2含有C、O、Fe、Si等元素,證實材料中硅層的存在。由圖2-e可知,Fe3O4@SiO2-DDTC中形成了新的S元素峰,可能與DDTC改性作用有關[20]。
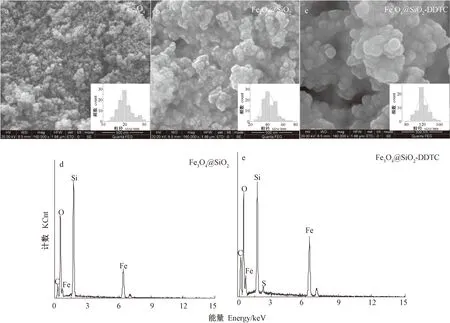
圖2 不同納米材料的SEM和EDS
2.1.3 FT-IR分析 納米材料Fe3O4、Fe3O4@SiO2及Fe3O4@SiO2-DDTC在吸附前FT-IR分析結果如圖3所示。527和1 635 cm-1附近的振動帶歸屬于Fe-O鍵的拉伸振動[22, 25],與Fe3O4相比,Fe3O4@SiO2的Fe-O吸收峰強度減弱,可能是由于官能團負載到Fe3O4表面。3 430 cm-1附近的寬峰為-OH的彎曲振動峰[26],與樣品表面吸附水有關。Fe3O4@SiO2光譜圖顯示在1 098 cm-1附近出現Si-O-Si的反對稱伸縮振動峰,470 cm-1附近出現Si-O-Si的彎曲振動峰[27],進一步表明Fe3O4表面成功包覆SiO2。Fe3O4@SiO2-DDTC光譜圖中出現DDTC的特有官能團,1 010 cm-1附近的增強峰歸屬于C=S振動峰,931 cm-1附近對應C-S的拉伸振動吸收峰,1 512 cm-1附近的弱振動峰對應C=N振動峰[20, 28-29],表明DDTC成功連接到Fe3O4@SiO2表面;而吸附了Cd2+的Fe3O4@SiO2-DDTC光譜圖顯示931和1 010 cm-1處的特征吸收峰強度降低,表明Cd2+離子可能和材料中的-CSS形成了多硫螯合物[29]。
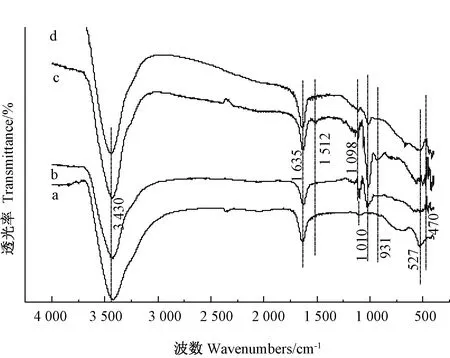
注:a:Fe3O4;b:Fe3O4@SiO2;c:Fe3O4@SiO2-DDTC;d:吸附Cd后的Fe3O4@SiO2-DDTC。
2.1.4 磁滯回線分析 由圖4可知,Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-DDTC的飽和磁化強度分別為61.06、42.45和25.74 emu·g-1[30],且3種材料在室溫下無磁滯效應和矯頑力,表明材料具有超順磁性,易于在外加磁場作用下從溶液中分離出來[31]。
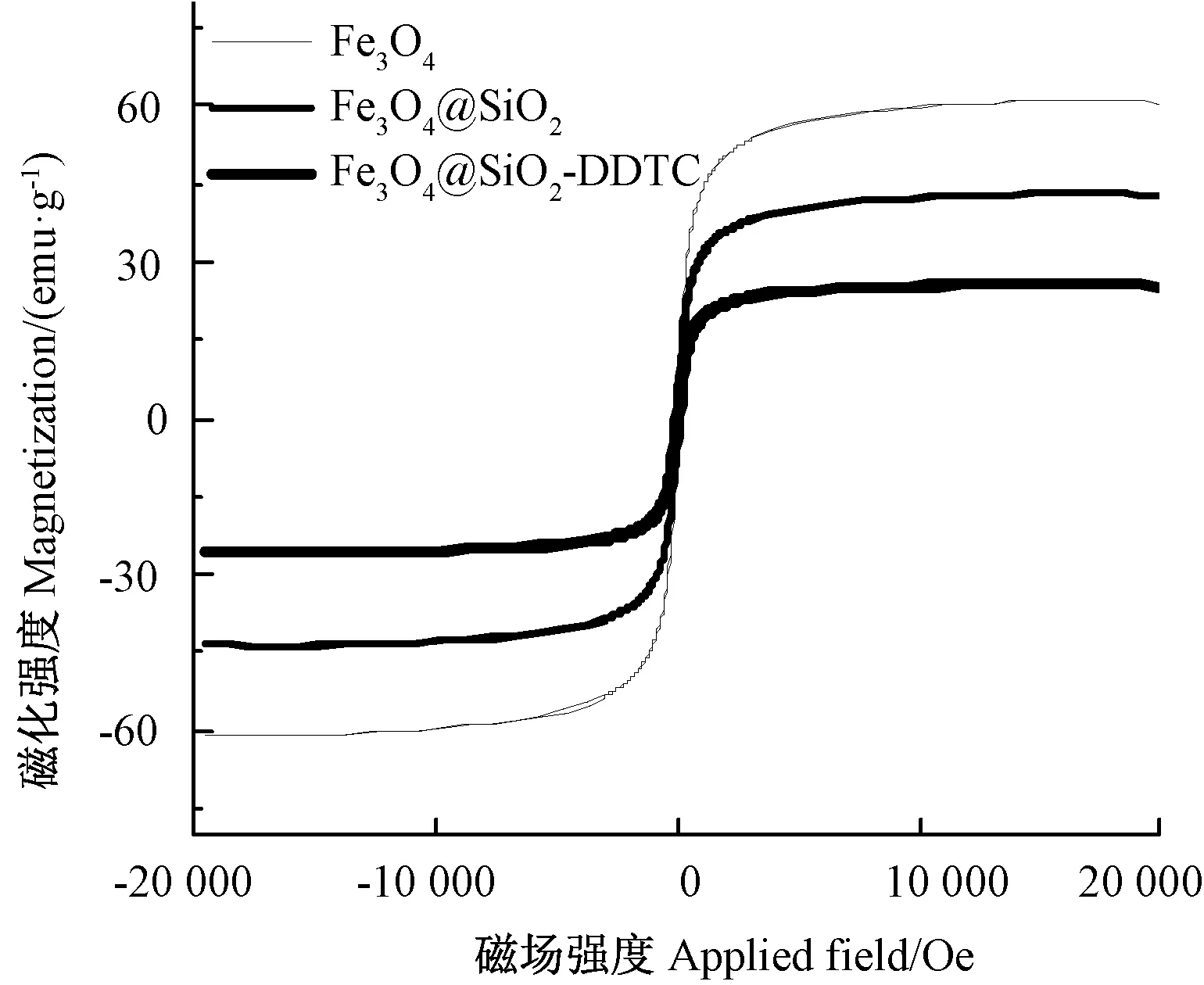
圖4 不同納米材料的磁滯回線
2.2 初始溶液pH值對吸附的影響
由圖5可知,pH值從3增加到4,Fe3O4@SiO2-DDTC對Cd2+的吸附量從3.41 mg·g-1迅速增加到24.01 mg·g-1。pH值在4~7范圍內,吸附量呈緩慢增加趨緩,且在pH值接近7時達到最大吸附量(31.76 mg·g-1)。此后,隨著pH值的增加,吸附量開始下降。吸附去除率在pH值3時最小(3.41%),pH值7時最大(80.63%)。Fe3O4@SiO2對Cd2+的吸附也存在類似趨勢。在低pH值(3~4)范圍內,吸附劑的吸附能力較弱可能是因為pH值較低時,溶液中過多的H+導致功能基團的質子化,進而通過靜電排斥作用,阻止了Cd2+與吸附劑的接觸配合;隨著pH值升高,H+濃度相應降低,官能團質子化降低,進而導致官能團中可用結合位點增加,因此吸附量增加;但當pH值進一步增加并達到8時,溶液中的Cd2+逐漸水解沉淀為Cd(OH)2、Cd(OH)3-、Cd(OH)4-,影響了Cd2+的吸附去除[23, 32]。
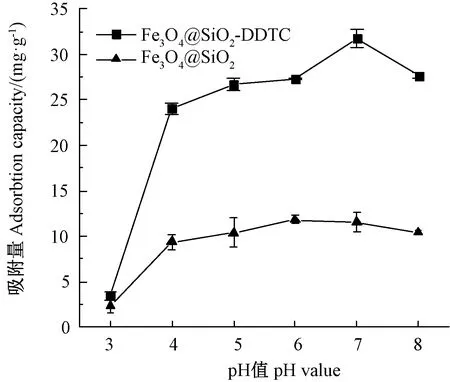
圖5 pH值對Fe3O4@SiO2和Fe3O4@SiO2-DDTC吸附效果的影響
2.3 共存離子強度對吸附的影響
不同種類、不同濃度干擾離子(Na+、Mg2+)對吸附的影響見圖6。結果表明,不同離子存在條件下,Fe3O4@SiO2和Fe3O4@SiO2-DDTC的平衡吸附量均略低于無干擾離子的空白組(CK),且Mg2+的抑制作用比Na+略明顯,這可能是因為Mg2+與Cd2+離子結構相似,有一定競爭吸附作用[33]。總體來說,這2種陽離子與Cd2+的競爭吸附能力較小,即在Na+和Mg2+等干擾離子存在的條件下,材料優先吸附Cd2+。
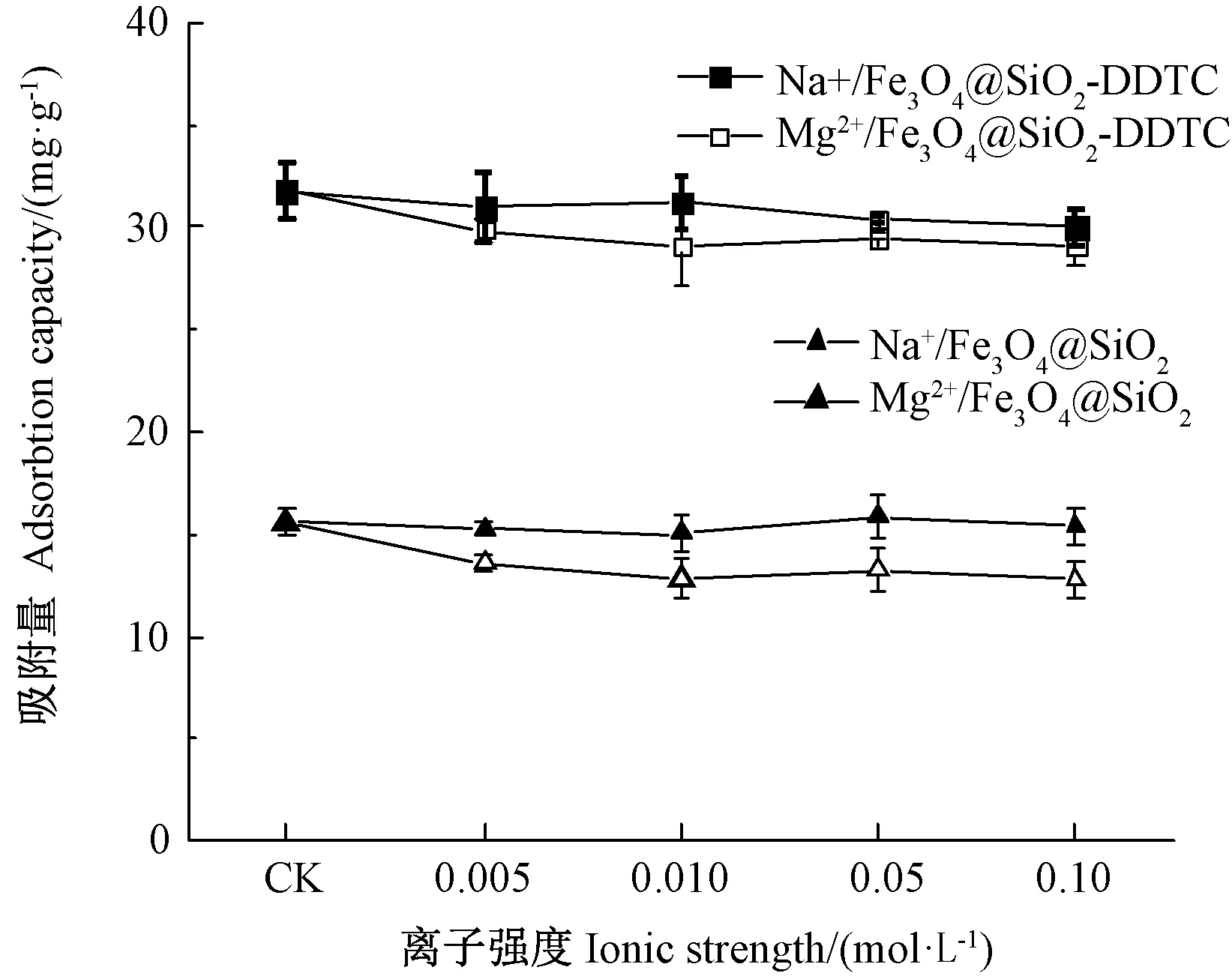
圖6 干擾離子種類及強度對Fe3O4@SiO2和Fe3O4@SiO2-DDTC吸附Cd2+的影響
2.4 吸附動力學特征
由圖7可知,Fe3O4@SiO2和Fe3O4@SiO2-DDTC 2種材料對Cd2+的吸附量先隨反應時間增加而增加,后趨于平衡。在反應開始5 min內吸附量分別達到吸附平衡量的72%、82%以上,并分別在反應1和2 h后基本達到吸附平衡。這是因為在反應初期材料表面有大量的空置吸附點位,溶液中的Cd2+快速與活性點位結合;隨著吸附反應的進行,材料表面的活性點位被填滿,加之材料在水中的集聚現象也會增加Cd2+與活性點位結合的難度[31],因此吸附速率逐漸降低后達到平衡。Fe3O4@SiO2-DDTC的最大吸附量是31.79 mg·g-1,約為Fe3O4@SiO2的2倍,說明DDTC的改性作用明顯。
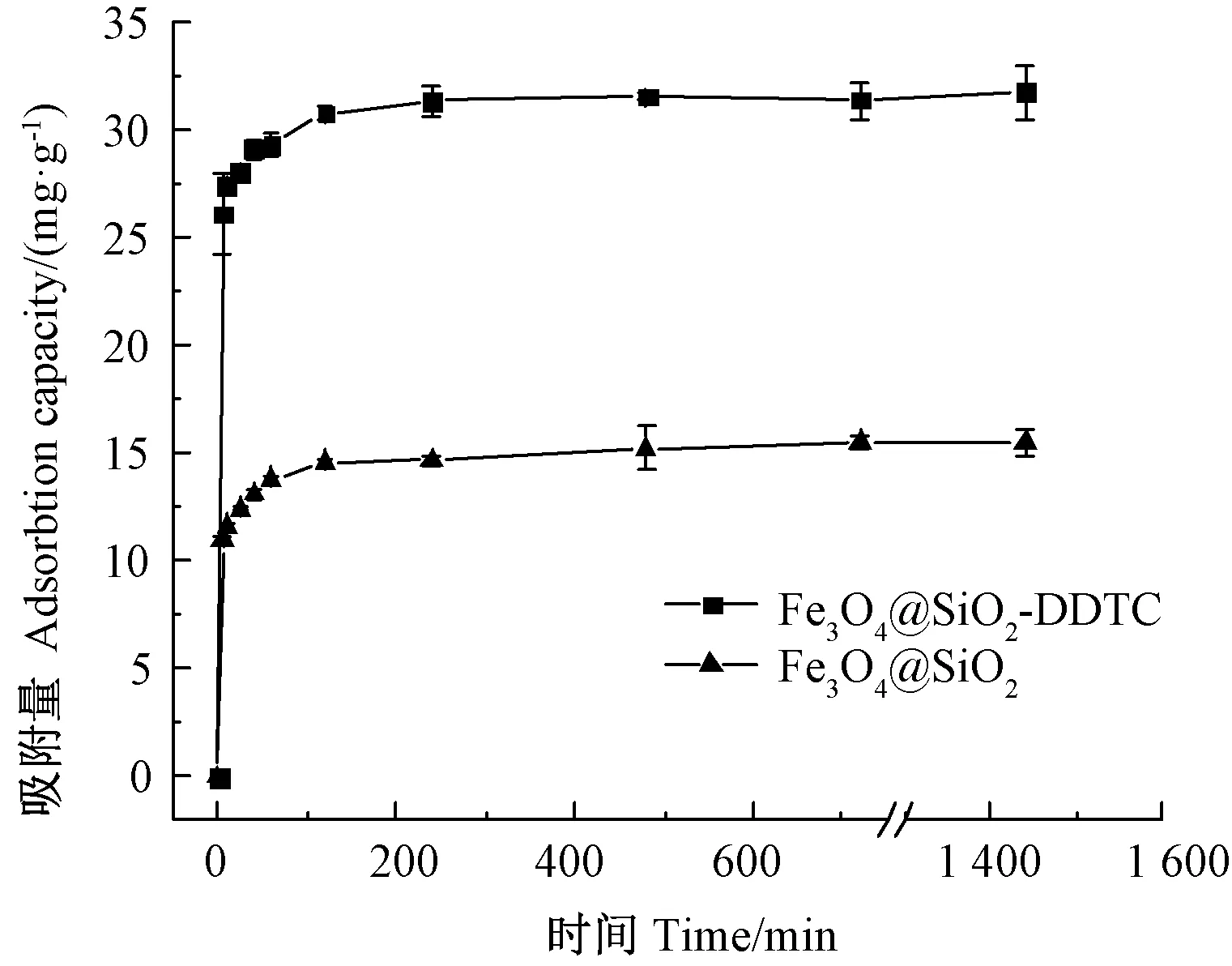
圖7 吸附時間對Fe3O4@SiO2和Fe3O4@SiO2-DDTC吸附性能的影響
2種動力學模型的擬合結果如表1所示,準二級動力學模型的R2(>0.99)高于準一級動力學模型R2,且準二級動力學模型得到的理論最大吸附量(31.81 mg·g-1) 更接近試驗結果(31.79 mg·g-1),因此,Fe3O4@SiO2-DDTC對水中Cd2+的吸附更符合準二級動力學模型,說明化學吸附為其主要吸附機理,吸附過程受準二級動力學過程控制[34-35]。另外,材料表面具有多個官能團,可以作為螯合反應的配體與Cd2+結合,表明該材料的吸附過程是以絡合為主的化學吸附。

表1 準一級和準二級吸附動力學擬合參數
2.5 等溫吸附曲線
納米材料對Cd2+的吸附等溫線見圖8,吸附參數見表2。由圖8可知,隨著吸附平衡時Cd2+濃度的增加,吸附量先快速增加后趨于平衡。由表2可知,Langmuir和Freundlich擬合模型均與Fe3O4@SiO2和Fe3O4@SiO2-DDTC吸附Cd2+試驗數據具有良好的相關性,其中Fe3O4@SiO2-DDTC模型擬合R2均大于0.9,但Langmuir模型的R2相較于Freundlich更高,說明前者更適合用來描述Fe3O4@SiO2-DDTC對Cd2+的吸附行為。結果提示吸附劑對Cd2+的吸附主要以均質吸附劑表面的單分子層吸附為主,與近期類似材料的研究結果一致[12, 36]。根據Langmuir模型擬合得到不同溫度下(25、35、45℃)Fe3O4@SiO2-DDTC的最高吸附量分別為37.20、41.13、45.52 mg·g-1。Freundlich等溫吸附模型吸附強度變量(1/n)<1,說明吸附反應容易進行。

圖8 Fe3O4@SiO2-DDTC吸附Cd2+的等溫模型擬合
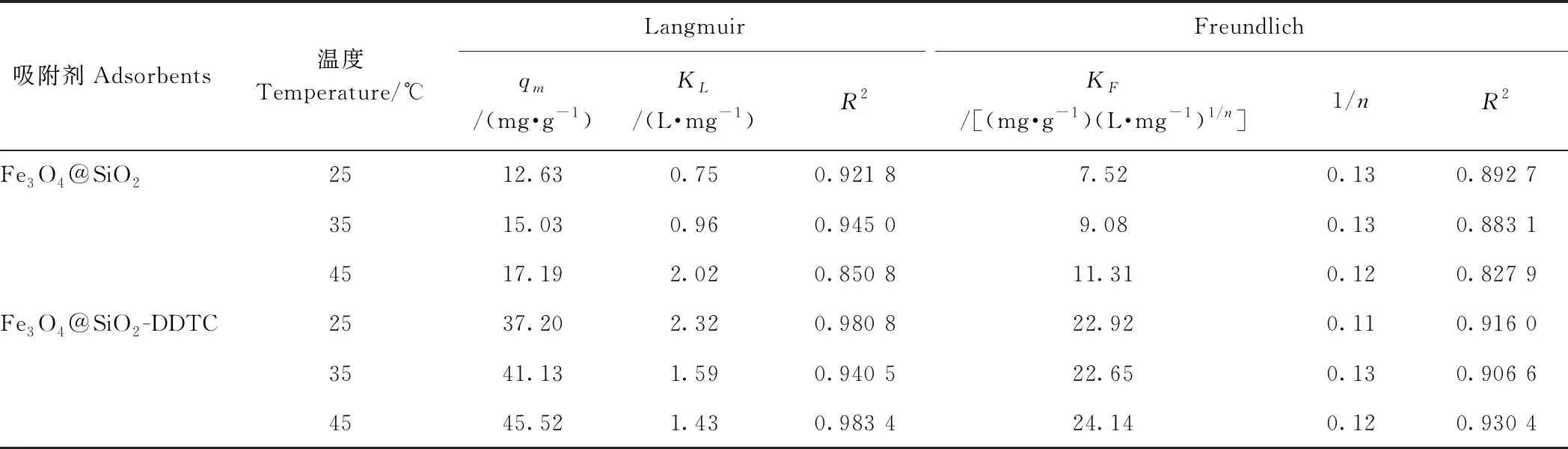
表2 Langmuir和Freundlich等溫吸附模型擬合參數
2.6 再生試驗
本研究選用硫脲-硝酸溶液作為洗脫液,4次吸附-脫附試驗結果如圖9所示。隨著循環次數的增加,Fe3O4@SiO2-DDTC對Cd2+的吸附能力有所下降,重復使用4次后吸附量仍可達到25.84 mg·g-1,與初次吸附相比下降了20%。表明硫脲對Cd2+有較強的螯合能力,對研究材料具有良好的洗脫效果。此外,吸附能力的下降可能與解吸過程中材料的損失或材料吸附的Cd2+未能被完全洗脫有關。
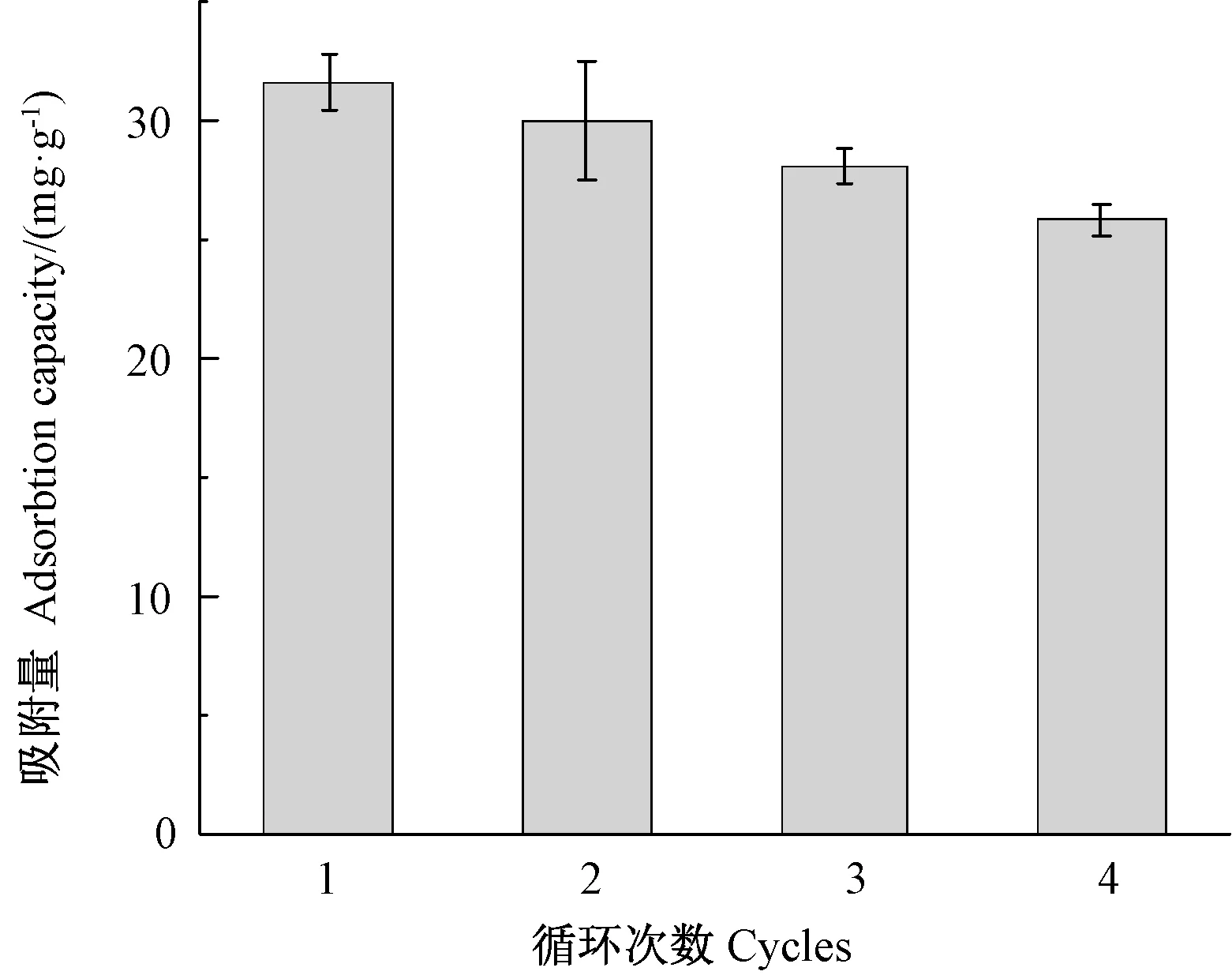
圖9 Fe3O4@SiO2-DDTC的重復使用性能
2.7 XPS分析
為深入分析Fe3O4@SiO2-DDTC對Cd2+的吸附機理,對吸附前后的樣品進行XPS分析,如圖 10所示。除檢測到Fe3O4@SiO2-DDTC中C、O、S、Si等的特征峰外,Cd/Fe3O4@SiO2-DDTC的全譜圖中還出現信號較強的Cd3d軌道特征峰,說明Fe3O4@SiO2-DDTC材料表面含有Cd2+,即Fe3O4@SiO2-DDTC成功吸附了Cd2+;同時吸附后材料的Na1s峰消失,證明DDTC中的Na+與Cd2+發生了離子交換。為進一步探索吸附材料可能的活性點位,對S2p峰進行分峰擬合,如圖10-b所示,材料吸附Cd2+后,C=S和C-S中S2p1/2和S2p3/2的結合能均增加0.1 eV,證明-CSS中的2個S原子都參與了配位,形成了多硫螯合物[37]。
3 討論
本試驗XRD分析表明,Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2-DDTC 3種材料均存在Fe3O4的特征衍射峰,表明TEOS和DDTC的修飾保留了Fe3O4的立方尖晶石結構,這與Ren等[38]和Liu等[22]的研究結果類似。SEM圖顯示3種材料粒徑大小排序為Fe3O4 本研究中,Fe3O4@SiO2-DDTC在反應5 min內即可實現對溶液中Cd2+的快速吸附,為應急快速處理水體Cd污染提供了可能。且Fe3O4@SiO2-DDTC對Cd2+的理論最大吸附量為45.52 mg·g-1,高于表3中所列的部分材料,吸附性能較好,具有較大的研究潛力。吸附特征研究表明,Fe3O4@SiO2-DDTC對Cd2+的吸附符合準二級動力學模型和Langmuir等溫吸附方程,以單分子層化學吸附為主,并伴隨有靜電相互作用。為提高材料利用率,進一步探究其再生性能。硫脲是一種有機含硫化合物,所具有的硫代羰基(C=S)與重金屬有較強的螯合作用[28, 41],因此本研究選用硫脲-硝酸溶液作為洗脫液,解吸試驗表明硫脲酸溶液對Fe3O4@SiO2-DDTC吸附的Cd2+洗脫效果良好,說明該材料能夠實現再生利用。Fe3O4@SiO2-DDTC對水中Cd2+具有良好的吸附性能,今后可進一步試驗用于實際污水或土壤重金屬處理的研究中。 表3 各種吸附劑對Cd2+吸附能力的比較 本研究制備了一種新型磁性螯合納米材料(Fe3O4@SiO2-DDTC),呈均勻球狀顆粒,粒徑約為115~125 nm。磁滯回線分析表明該材料具有良好的磁響應性,可通過外加磁場實現固液快速分離。Fe3O4@SiO2-DDTC對Cd2+的吸附過程符合準二級動力學模型和Langmuir等溫吸附方程;吸附機制包括絡合螯合反應、離子交換和靜電相互作用。Fe3O4@SiO2-DDTC再生效果良好,經硫脲-硝酸溶液解吸4次后仍有較高吸附能力,可以實現重復利用。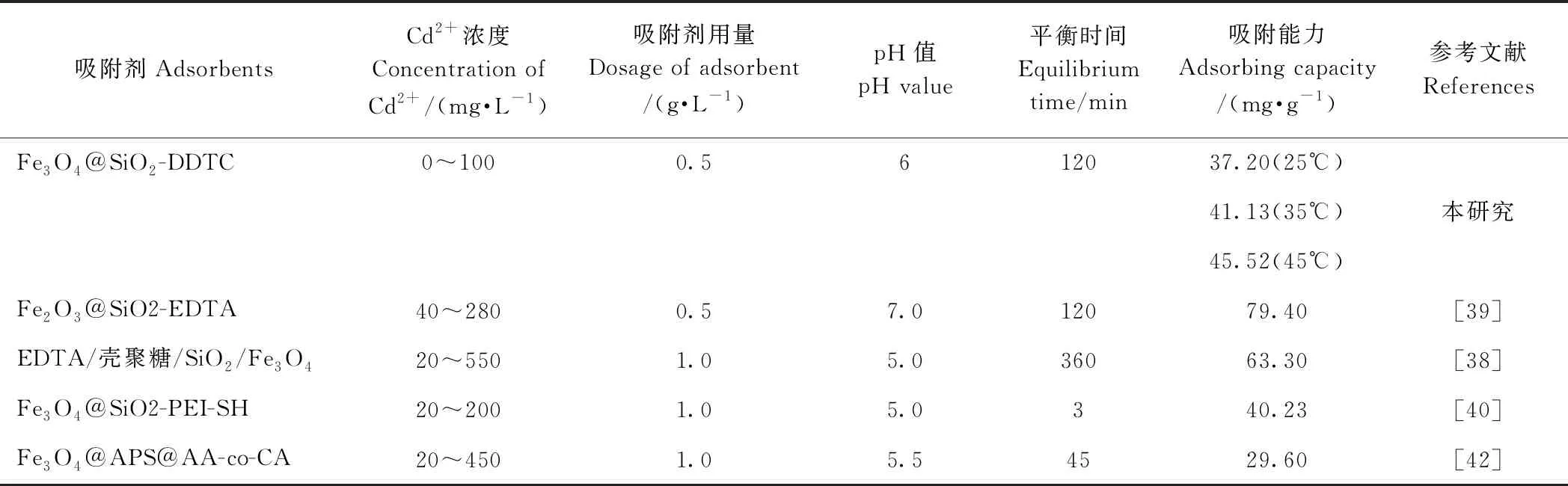
4 結論

