TTC36蛋白在缺氧復氧誘導的肝臟缺血再灌注損傷中的表達
聶芳,李可,王媛,許穎
(1.成都醫學院臨床醫學院第一附屬醫院檢驗科; 2.成都醫學院臨床醫學院;3.成都醫學院檢驗醫學院,四川 成都 610500)
肝臟缺血再灌注損傷(hepatic ischemia reperfusion injury,HIRI)指肝臟組織器官由于多種原因導致缺血,造成細胞組織器官的損傷,而缺血之后進行再灌注,細胞組織器官相關功能仍無法恢復,并且使其損傷更為嚴重,這也是肝臟切除和肝移植手術、低血容性休克、毒性肝損傷、靜脈阻塞性病變等疾病過程中最常見的病理生理現象[1]。HIRI 可導致10%早期肝臟移植后器官衰竭、45%器官損傷和急慢性組織排異現象[2-3]。然而,目前仍然缺乏對于HIRI的有效監測指標和防治措施。TTC36是一個新發現的具有3個連續C端四肽重復(tetratricopeptide repeat,TPR)結構域的蛋白分子, Liu等[4]報道通過 TPR 結構域與熱休克蛋白70(HSP70)的C端相互作用發揮分子伴侶的功能,Jiang等[5]報道TTC36作為抑癌基因參與調控肝癌細胞的凋亡,Xie等[6]報道TTC36參與4-羥苯基丙酮酸雙加氧酶(4-hydroxyphenylpyruvic acid dioxygenase,HPD)的降解導致酪氨酸血癥和神經損傷。本實驗擬研究TTC36在缺氧復氧誘導的肝細胞損傷中的動態變化規律,為進一步深入探討TTC36在肝臟缺血再灌注損傷中的作用奠定基礎。
1 材料與方法
1.1 材料
人正常肝細胞LO2由華西科技園腫瘤分子靶向治療研究室夏洪偉博士惠贈;TTC36鼠源性單克隆抗體由深圳市龍華區人民醫院檢驗科劉運洪博士惠贈;辣根過氧化物酶標記的羊抗鼠二抗購自北京中杉金橋生物技術有限公司;0.25%乙二胺四乙酸(EDTA)的胰酶、胎牛血清、高糖Dulbecco改良的Eagle培養基(DMEM)培養基、磷酸緩沖鹽溶液(PBS)(Gibco公司);乳酸脫氫酶 (LDH)、谷丙轉氨酶(ALT )、谷草轉氨酶 (AST )試劑(四川邁克生物科技股份有限公司,配套儀器為日立全自動生化分析儀7060);無糖DMEM培養基、超氧化物歧化酶(SOD)、還原型谷胱甘肽(GSH)、丙二醛(MDA)試劑盒(北京索萊寶科技有限公司);ST8R型高速冷凍離心機(賽默飛世爾公司);HR40-IIA2型生物安全柜(青島海爾特種電器有限公司);GENbag厭氧產氣袋(梅里埃公司);SM-150A超聲細胞破碎儀(南京舜瑪儀器設備有限公司);ST-360型酶標儀(上海科華生物公司);Trans-Blot轉印槽(美國Bio-Rad 公司);UVP凝膠成像分析儀(美國UVP公司)。
1.2 方法
1.2.1 LO2肝細胞復蘇、傳代、保種 肝臟LO2細胞復蘇,將其轉入10 cm2細胞培養皿中,再用含10% 胎牛血清(FBS)的DMEM培養基,在37 ℃、5% CO2、95%濕度條件下無菌培養。當細胞貼壁長滿后,棄去培養基,以PBS洗滌細胞,傳代,取對數生長期的細胞用于后續實驗。
1.2.2 缺氧復氧誘導實驗 (1)細胞分組分盤:棄去培養皿內的培養液,用 PBS 洗兩次后棄去,加入 0.25%胰酶置于培養箱內消化2 min;在離心機中 800 g離心力,離心5 min。后棄去上清液;離心沉淀中加入完全培養液,并以無菌吸管輕輕反復吹打使細胞分散成單細胞懸液;將細胞懸液均分加入培養皿,實驗分為對照組N組(正常條件下培養);A3組、A6組、A9組(在缺氧環境下分別培養3、6、9 h之后進行復氧2 h);R0組、R2組、R4組、R6組(在最適缺氧時間6 h后復氧0、2、4、6 h)。(2)缺氧復氧細胞模型建立:當細胞長到對數生長期時,將實驗組培養基更換為無糖無血清培養液,實驗組均放入GENbag厭氧產氣袋中(GENbag厭氧產氣袋,型號:45534)可在1 h左右提供殘余氧濃度低于1%,和CO2濃度大約20%,在脫氧過程中不產生壓差及溫度變化),置于37 ℃二氧化碳培養箱中繼續培養,分別缺氧培養6 h后,棄去厭氧袋,培養基更換為之前含10%FBS的完全培養基,放入二氧化碳培養箱中繼續培養2、4、6 h后收集細胞。對照組在正常條件下培養、換液,無缺氧復氧處理。(3)臺盼藍染色檢測細胞活力:各組細胞消化后吸取0.1 mL細胞懸液經過臺盼藍染色5 min后,取一滴置于高倍顯微鏡下計數,死細胞著淺藍色并膨大無光澤,或細胞不著色并保持正常形態,有光澤。細胞活力(%)=未染色的細胞數/觀察到細胞總數×100%。(4)細胞總蛋白的提取:實驗組和對照組在不同缺氧復氧時間后,開始收集細胞總蛋白。LO2細胞吸走細胞上清液,PBS 緩沖液清洗兩遍細胞后,加入800 uL蛋白裂解液,超聲波破碎(功率20%或200 V,超聲3 s,間隔10 s,重復30次),12 000 rpm 4 ℃離心10 min,取上清液,置冰上待測。
1.2.3 檢測肝功能損傷酶學指標ALT、AST的含量 收集缺氧復氧處理前后的細胞上清液,在7060型日立全自動生化分析儀上進行檢測,記錄各組數據。
1.2.4 檢測肝損傷標志蛋白SOD、GSH、MDA的活性含量 將提取好的各組的細胞總蛋白參照Solarbio試劑盒說明書經過相應處理后,在酶標儀上檢測吸光度,并按照試劑盒說明書上的公式進行計算,計算出SOD、GSH和MDA 三種蛋白質活性含量。
1.2.5 蛋白印跡法檢測細胞TTC36蛋白水平 提取好的總蛋白加loading buffer后煮沸10 min變性處理,然后進行聚丙烯酰胺凝膠電泳分離蛋白,電轉移至聚偏氟乙烯[poly(1,1-difluoroethylene),PVDF]膜上。封閉后,一抗孵育過夜,再用二抗體偶聯物孵育,化學發光試劑(electrochemiluminescence,ECL)顯跡,在UVP凝膠成像分析儀中采集圖像并進行灰度比值分析。
1.3 統計學分析
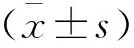
2 結果
2.1 肝缺血再灌注損傷細胞模型的建立
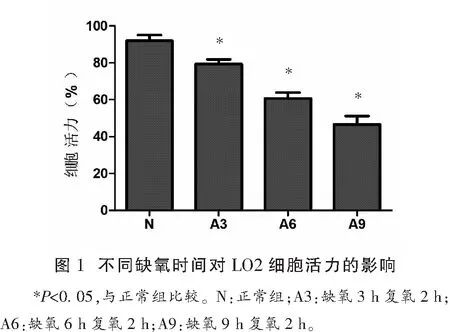
選取最適宜的缺氧條件:LO2細胞在Genbag厭氧袋中培養0.5~1 h,厭氧指示條由藍色逐漸變為無色,說明此時氧氣濃度<0.1%(有氧環境下為藍色,無氧環境下為無色),說明缺氧環境已建立。缺氧培養3、6、9 h復氧2 h后,A3、A6、A9組細胞活力較正常組有顯著性差異(P<0.05),見圖1。通過鏡下觀察LO2細胞缺氧復氧損傷后的形態學變化,正常組細胞生長良好,大部分細胞貼壁擴展,呈梭形,細胞密度高。隨缺氧時間增加,貼壁細胞數目減少,細胞密度降低,細胞間間隙增大,部分細胞可見明顯的結構破壞,鏡下出現更多的細胞碎片或脫落漂浮的細胞,提示LO2細胞損傷程度隨缺氧時間的延長而加重,細胞存活率下降,證明厭氧袋/厭氧罐法能夠建立有效的細胞缺氧復氧損傷模型,可以有效地模擬肝缺血再灌注損傷,后續實驗中選取缺氧6 h后分別復氧0、2、4、6 h收集細胞及細胞外液進行檢測分析。
2.2 肝缺血再灌注損傷細胞模型的驗證
2.2.1 構建的缺氧復氧模型LO2細胞外液中的肝損傷標志物ALT、AST含量變化 與正常組比較,R0、R4組ALT、AST活性增高(P<0.05);與R0組(ALT=10.3±3.2 U/L、AST=15.4±3.1 U/L)比較,R2組ALT(25.4±2.5 U/L)、AST(39.2±3.4 U/L)表達水平更高(P<0.05),提示肝細胞復氧后比缺氧時損傷更嚴重了;隨著復氧時間延長,R6組(ALT=10.2±3.6 U/L、AST=18.8±5.0 U/L)逐漸降低恢復正常(P>0.05)。見表1。
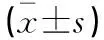
表1 缺氧復氧模型LO2細胞外液中ALT、AST含量變化
2.2.2 構建的缺氧復氧模型LO2細胞中MDA、GSH、SOD活性變化 與正常組比較,R0(1.46±0.313 nmol/mg)、R4組(1.49±0.327 nmol/mg)細胞MDA活性含量較正常組(1.43±0.123 nmol/mg)升高(P<0.05),而GSH(R0=4.26±1.463 μg/mg、R4=4.22±0.738 μg/mg)和SOD(R0=342±34 U/g、R4=325±63 U/g)活性含量下降(P<0.05);與R0組比較,R2組MDA(1.52±0.294 nmol/mg)活性含量更高(P<0.05),GSH(3.92±0.829 μg/mg)和SOD(268±48 U/g)活性含量更低,同樣提示肝細胞復氧后比缺氧時損傷更嚴重;隨著復氧時間延長,R6組(MDA=1.45±0.285 nmol/mg、GSH=4.43±1.137μg/mg、SOD=389±84 U/g)逐漸恢復正常(P>0.05)。見表2。
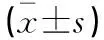
表2 缺氧復氧模型LO2細胞中MDA、GSH、SOD活性變化
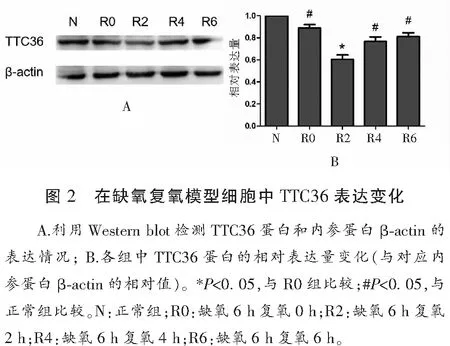
2.3 LO2細胞構建的缺氧復氧模型細胞中TTC36表達差異
LO2細胞缺氧6 h后分別復氧0 h、2 h、4 h、6 h,提取細胞蛋白,通過Western Blot 檢測TTC36的表達,結果顯示正常組、R0組、R2組表達逐漸降低,R4、R6組表達又逐漸增高,提示復氧1 h的細胞發生二次損傷,較缺氧未復氧時TTC36蛋白表達明顯下調,隨著肝功能恢復,TTC36蛋白的表達也恢復正常。見圖2。
3 討論
我國的肝臟外科是一個迄今不到50年的新崛起的領域,其中肝缺血再灌注損傷的理論研究至今僅十幾年[7]。現階段,雖然HIRI的研究范圍廣,但是我國對此的研究較少,迄今對該損傷診斷的仍無統一標準,主流觀點認為肝缺血再灌注損傷的主要檢測方法是生化和影像學指標。生化方法主要是檢測傳統的損傷生化標志物,包含天冬氨酸氨基轉移酶(aspartate aminotransferase,AST)、堿性磷酸酶 (alkaline phosphatase,ALP)和丙氨酸氨基轉移酶(alanine aminotransferase,ALT) 等。另外,還有一些未廣泛運用的新型肝損傷生物標志物,如蛋白質分子、血液生物標記、尿液中的生物標記和循環RNA等[8]。這些方法均是對于肝損傷的大范圍的檢測和術后評估,對于肝缺血再灌注損傷這一特定的肝臟損傷的特異性和針對性較低。傳統的損傷標志物對于肝缺血再灌注損傷無法作出較準確和快速的反應[9]。因此,本研究分析TTC36蛋白在肝缺血再灌注損傷中的表達差異,從而探索HIRI的新的早期檢測指標。
將細胞置于無糖無血清的DMEM培養基中,然后放置在厭氧袋里,在此環境培養后,細胞處于缺氧狀態;缺氧后培養基由無糖無血清更換為正常培養基,再造成復氧環境,通過檢測細胞活力和肝損傷指標反映該模型建立成功。LO2細胞經過不同缺氧時間處理,細胞活力發生改變。分別缺氧3 h 、6 h、9 h后復氧2 h,A9組可能由于缺氧時間過長已經超出了細胞的承受范圍,對細胞造成了不可逆的損傷,細胞大量死亡,說明在缺氧的環境下,機體應激能力是有限的;較A9組,A6組在復氧2h后細胞死亡數減少,可能需要更長的時間才能恢復;A3組損傷輕微,細胞存活率較A6組高,肝細胞功能恢復時間較短。為研究缺氧復氧誘導的缺血再灌注損傷,選取損傷適中的缺氧時間6 h進行復氧實驗,并通過檢測幾種肝損傷標志物ALT、AST、MDA、GSH和SOD驗證此細胞模型的有效性。缺氧復氧2 h的肝細胞損傷程度要高于缺氧未復氧時,表明該模型可以模擬手術中肝缺血后恢復血供,肝臟正常生理功能并沒有因此恢復,反而造成損傷加重的情況。此方法具有成模快速、結果穩定、操作簡單等優點,在實際應用中可根據實驗條件進行合適的選擇。在機體中的缺氧再灌注損傷情況更為復雜,涉及到各種激素調節,神經調節等[10],建立細胞模型,可控制變量,研究某一特定因素,減少或避免其他因素的干擾,讓實驗結果的可信度、準確性更高。肝細胞缺血再灌注損傷模型的建立為缺血再灌注損傷的預防及治療奠定了一定的臨床基礎。
TTC36蛋白在哺乳動物體內保守表達,并且在肝臟中TTC36可作為分子伴侶與多種蛋白協助發揮作用[11]。本研究中ALT、AST以及MDA、GSH、SOD等肝損傷指標顯示,在缺氧復氧模擬的細胞模型中缺氧后細胞受到一定程度的損傷,但缺氧復氧后的細胞較缺氧未復氧時損傷嚴重,但隨著復氧時間延長,細胞逐漸恢復正常。另外,正常組、R0組、R2組TTC36的表達逐漸降低,R4、R6組TTC36的表達又逐漸增高,但缺氧復氧后的細胞較缺氧未復氧時TTC36蛋白表達明顯下調,隨著肝功能恢復,TTC36蛋白的表達也恢復正常。
綜上所述,TTC36蛋白在缺氧復氧誘導的肝缺血再灌注損傷過程中表現出明顯差異,其表達量的變化能夠較好地反映細胞缺氧性損傷-再灌注損傷-細胞損傷后修復這一動態變化過程。因此, TTC36的表達水平可以反映機體肝缺血再灌注損傷程度的早期判斷和預后情況,也預示著TTC36有望成為肝缺血再灌注損傷一個新的早期監測指標和預后指標。

