鴉膽子苦醇對人非小細胞肺癌H1299 細胞輻射增敏作用研究?
張 芳,楊蓉佳,付朝霞
1 華池縣人民醫院,甘肅 華池745600;2 甘肅省人民醫院
從天然產物中篩選輻射增敏藥物成為癌癥放射治療研究的熱點[1]。近年來,一種源于苦木科植物鴉膽子種子的活性提取物——鴉膽子苦醇(brusatol,BRU)逐漸進入了研究人員的視野,因為BRU 能夠抑制核轉錄因子2(nuclear transcription 2,Nrf2)的表達,產生抗腫瘤和抗氧化應激等作用[2]。腫瘤細胞通過Nrf2途徑產生輻射耐受性是目前癌癥放療的棘手問題,而BRU 對Nrf2 具有抑制作用,無疑為癌癥的放療以及輻射聯合藥物治療研究提供了新契機,國內學者首次證實BRU可通過抑制Nrf2 而增加腫瘤細胞的輻射敏感性,是一種潛在天然增敏藥物[3]。然而BRU 聯合輻射通過何種途徑抑制Nrf2 表達,進而誘導腫瘤細胞凋亡至今尚未闡明。本研究探討BRU抑制Nrf2以及增加非小細胞肺癌H1299細胞輻射敏感性的可能途徑,揭示BRU聯合輻射誘導H1299細胞凋亡的內在機制。
1 材料與方法
1.1 試劑和儀器二甲基亞砜(dimethyl
sulfoxide,DMSO,批號:08371)、BRU 和4',6-二脒基-2-苯基吲哚(DAPI,批號:C0065,美國Sigma 公司提供);細胞增殖檢測試劑盒(Cell Counting Kit-8,CCK-8,批號:C0038)、細胞凋亡檢測試劑盒(Annexin V-FITC/PI,批號:C1062S)和胞內活性氧檢測試劑盒(Reactive Oxygen Species Assay Kit,批號:S0033S,碧云天公司提供);PI3K(Tyr458,批號:4292)、PI3K(Tyr458,批號:17366)、Akt(Ser473,批號:9272)、Akt(Ser473,批號:4060)、p70S6K(Thr389,批號:9202)、p70S6K(Thr389,批號:97596)由美國Cell signal 公司提供;其他抗體(美國Abcam 公司);DMEM培養基和胎牛血清(美國Gibco公司),其他試劑均由國內公司提供。流式細胞儀(德國默克密理博公司);凝膠成像系統(美國Protein sample 公司);酶標儀(上海閃譜生物科技有限公司);電泳儀、電泳槽(美國Biorad公司);激光共聚焦顯微鏡(德國Zessi公司)。
1.2 細胞人非小細胞肺癌H1299 細胞在含10%胎牛血清DMEM 培養液中,在37℃、含5%CO2培養箱中培養,細胞生長密度達到80%時傳代,取對數期細胞開展實驗。
1.3 實驗方法
1.3.1 CCK-8 法檢測細胞活性 調整H1299 細胞密度為1.5×104個/孔,接種于96孔板。培養24 h后,加入經培養液稀釋的不同濃度BRU,繼續培養2、6、12、24、48 h,收樣。設定酶標儀吸光值為450 nm,測定各孔吸光值(A),根據細胞增殖抑制實驗得出BRU的IC50,根據公式計算抑制率。
抑制率(%)=[A450(陰性)-A450(給藥)]/[A450(陰性)-A450(空白)]×100%
1.3.2 BRU 抑制Nrf2 表達的最佳作用時間 用IC50的BRU 處理H1299 細胞2、4、6、12、24、48 h 后,收集細胞,提取全蛋白,定量、變性后用12% SDSPAGE 凝膠電泳分離蛋白質,經轉膜、封閉、一抗4℃過夜和二抗孵育,用化學發光法顯色,用凝膠成像系統拍照記錄,分析灰度值。
1.3.3 輻射增敏實驗 將細胞分為對照組、BRU組(IC50)、X 射線組(2 Gy)和BRU 聯合X 射線組(BRU+2 Gy)。其中BRU組和BRU+2 Gy組用100 nmol/L(IC50)的BRU 預處理24 h。調整H1299 細胞密度為5×104個/mL,接種于6孔板,細胞經100 nmol/L的BRU 預處理24 h,采用醫用直線加速器提供的X 射線一次性照射細胞,劑量均為1 Gy/min,室溫條件下照射劑量為2 Gy,照射24 h后收細胞樣。
1.3.4 胞內活性氧實驗 調整細胞密度為1×105個/mL,將細胞重懸浮于含有10μmol/LDCFH-DA的無血清培養基中,37°C孵育20 min,再用無血清培養基洗3 次,經流式細胞儀檢測細胞熒光強度,平均熒光強度值(mean fluorescence intensity,MFI)代表ROS含量。
1.3.5 細胞凋亡實驗 調整細胞密度為1×105個/mL,將細胞重懸浮于預冷的結合緩沖液,加入5 μL Annexin V-FITC 和5 μL PI 輕輕混勻后室溫避光孵育15 min,經流式細胞儀檢測細胞凋亡率。
1.3.6 平板克隆形成實驗 以每孔200 個細胞密度接種于6 孔板,同時設無藥對照組,每組3 個重復,在37°C、5%CO2條件下持續培養14 天。經洗滌、甲醇固定、吉姆薩(Giemsa)染色后,晾干、拍照,計算肉眼可見的集落數。
克隆形成率(%)=(克隆集落數/接種細胞數)×100%
1.3.7 蛋白表達分析 細胞經處理后用蛋白裂解液提取總蛋白,用BCA 蛋白定量試劑盒測定蛋白濃度后,用10%和12%SDS-PAGE凝膠電泳分離蛋白,并經轉膜、封閉、孵一抗和二抗后,用化學發光法檢測蛋白條帶,最后用Protein sample 凝膠成像儀拍照并計算蛋白灰度值。
1.3.8 Nrf2 蛋白免疫熒光定位 將每組經細胞爬片處理的蓋玻片用PBS 清洗3 次,用0.2%的Triton X-100 透化細胞10 min,PBS 清洗3 次,每次5 min,用5%的BSA 封閉細胞30 min,經一抗4℃過夜和熒光二抗孵育。用終濃度為0.5μg/mL 的DAPI染色10 min,PBS清洗3 次,將蓋玻片置于載玻片,用抗淬滅封片劑封片,用激光共聚焦顯微鏡觀察拍照。
1.4 統計學方法用SPSS 19.0軟件分析數據,計量資料以±s表示,采用單因素方差分析,組間多重比較采用LSD-t法,P<0.05表示差異有統計學意義。
2 結果
2.1 BRU對H1299細胞和Nrf2表達的抑制作用從6 h開始細胞生長呈時間和劑量依賴性被抑制,在12、24 和48 h 的IC50值 分 別 是350.2、102.4 和100.9 nmol/L,表明100 nmol/L左右的BRU可以顯著抑制H1299 細胞增殖,因此選用該濃度作為研究濃度。100 nmol/L的BRU作用H1299細胞6、12、24和48 h后,Nrf2表達不具有時間依賴性,BRU處理后24 h,Nrf2 的表達最低,因此,選取24 h 作為以下研究的時間點。見圖1。
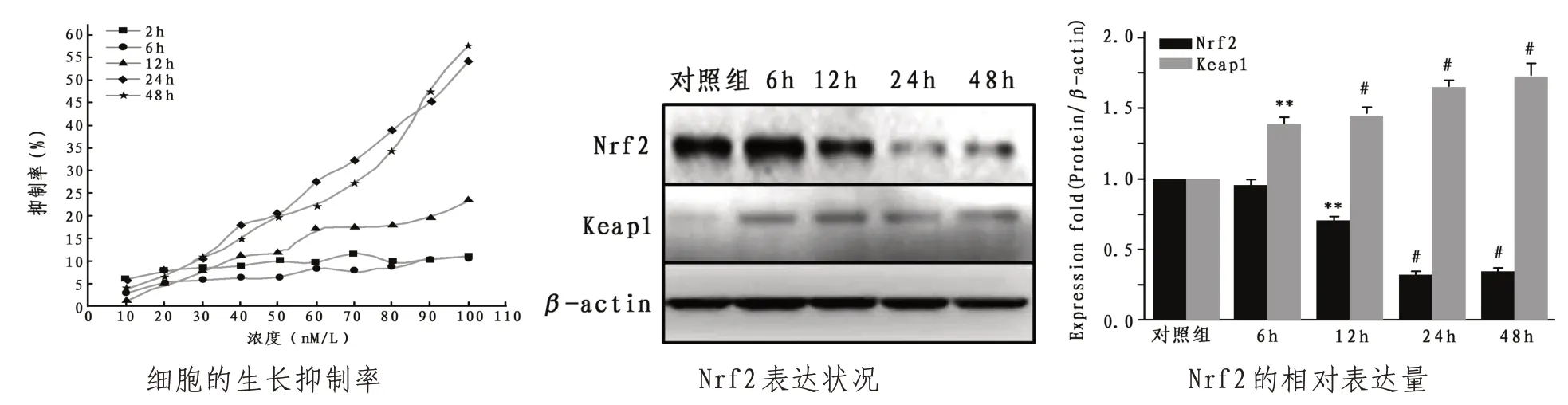
圖1 BRU對H1299細胞和Nrf2表達的抑制作用
2.2 各組H1299 細胞克隆存活能力與對照組相比,BRU 組(P<0.05)、2 Gy 組(P<0.01)和BRU+2 Gy組(P<0.001)H1299細胞的克隆形成率降低;與2 Gy 組相比,BRU+2 Gy 組細胞形成率差異具有統計學意義(P<0.01)。見圖2。
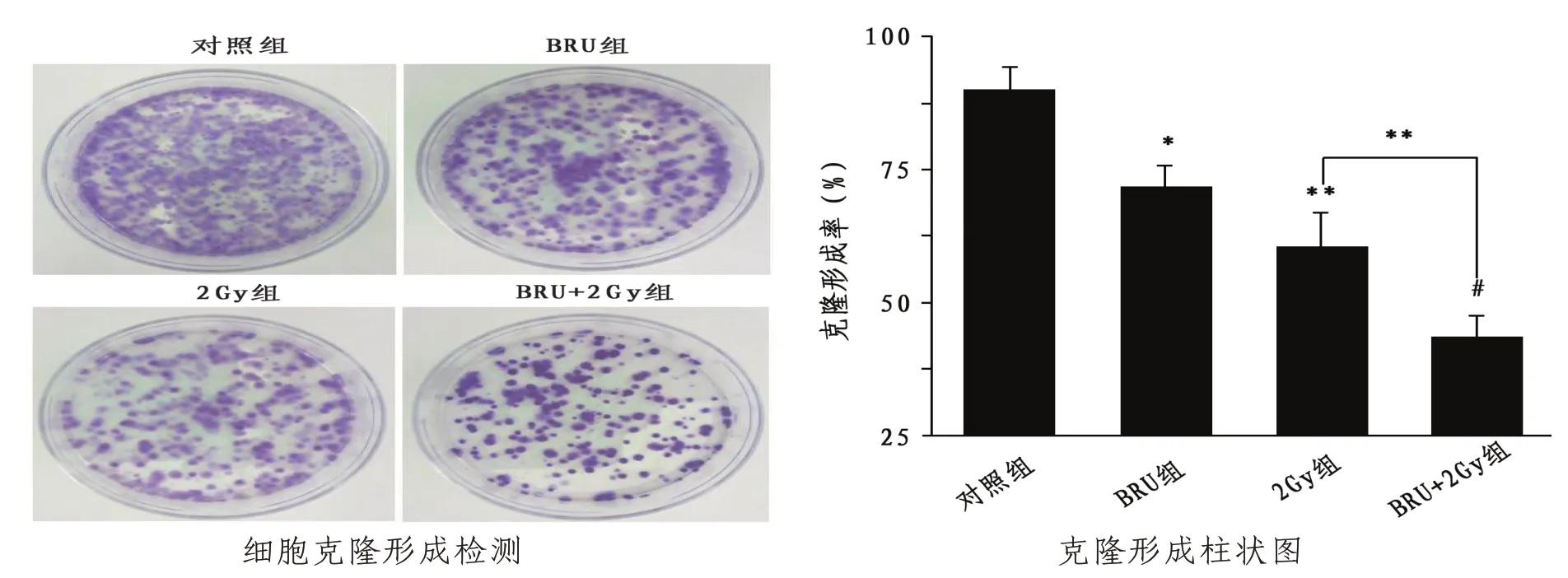
圖2 各組H1299細胞克隆存活能力
2.3 各組H1299 細胞凋亡情況與對照組相比,BRU 組(P<0.01)、2 Gy 組(P<0.001)和BRU+2 Gy組(P<0.001)細胞凋亡率升高;2 Gy 與BRU+2 Gy組細胞凋亡率比較差異有統計學意義(P<0.001)。見圖3。凋亡率(%)=(R4+R5)/R1×100%,R1=1000。
2.4 各組H1299細胞胞內ROS情況與對照組相比,BRU 組(P<0.05)、2 Gy 組(P<0.05)和BRU+2 Gy 組(P<0.01)MFI 升高;2 Gy 組與BRU+2 Gy 組MFI比較差異有統計學意義(P<0.01)。見圖3。
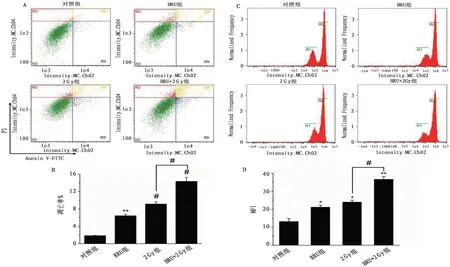
圖3 各組H1299細胞胞內ROS含量及H1299細胞凋亡率
2.5 BRU 聯合X 射線抑制H1299 細胞PI3K/Akt/Nrf2/HO-1信號通路與對照組相比,BRU組(p-PI3K,P<0.05;p-Akt,P<0.01;p-p70S6K,P<0.05)、2 Gy組(P<0.01)和BRU+2 Gy 組(P<0.001)的磷酸化PI3K、Akt 和p70S6K 水平降低(圖4B);BRU 組Nrf2(P<0.001)、HO-1(P<0.001)和NQO-1 表達降低(圖4D);BRU+2 Gy組Nrf2(P<0.001)、HO-1(P<0.01)和NQO-1(P<0.01)表達降低(圖4D);2 Gy組Nrf2、HO-1 和NQO-1 表達升高(圖4D),說明2 Gy 劑量的X 射線照射會使H1299 細胞Nrf2 表達升高,產生抗氧化應激作用;BRU 組和BRU+2 Gy 組細胞核中Nrf2 的核位移程度減弱(圖5),2 Gy 組細胞核中Nrf2的核位移程度增強(圖5);2 Gy組與BRU+2 Gy組磷酸化PI3K(P<0.05)和Akt(P<0.05)水平比較差異具有統計學意義(圖4B),Nrf2(P<0.001)、Keap1(P<0.05)、HO-1(P<0.01)和NQO-1(P<0.01)的表達降低。
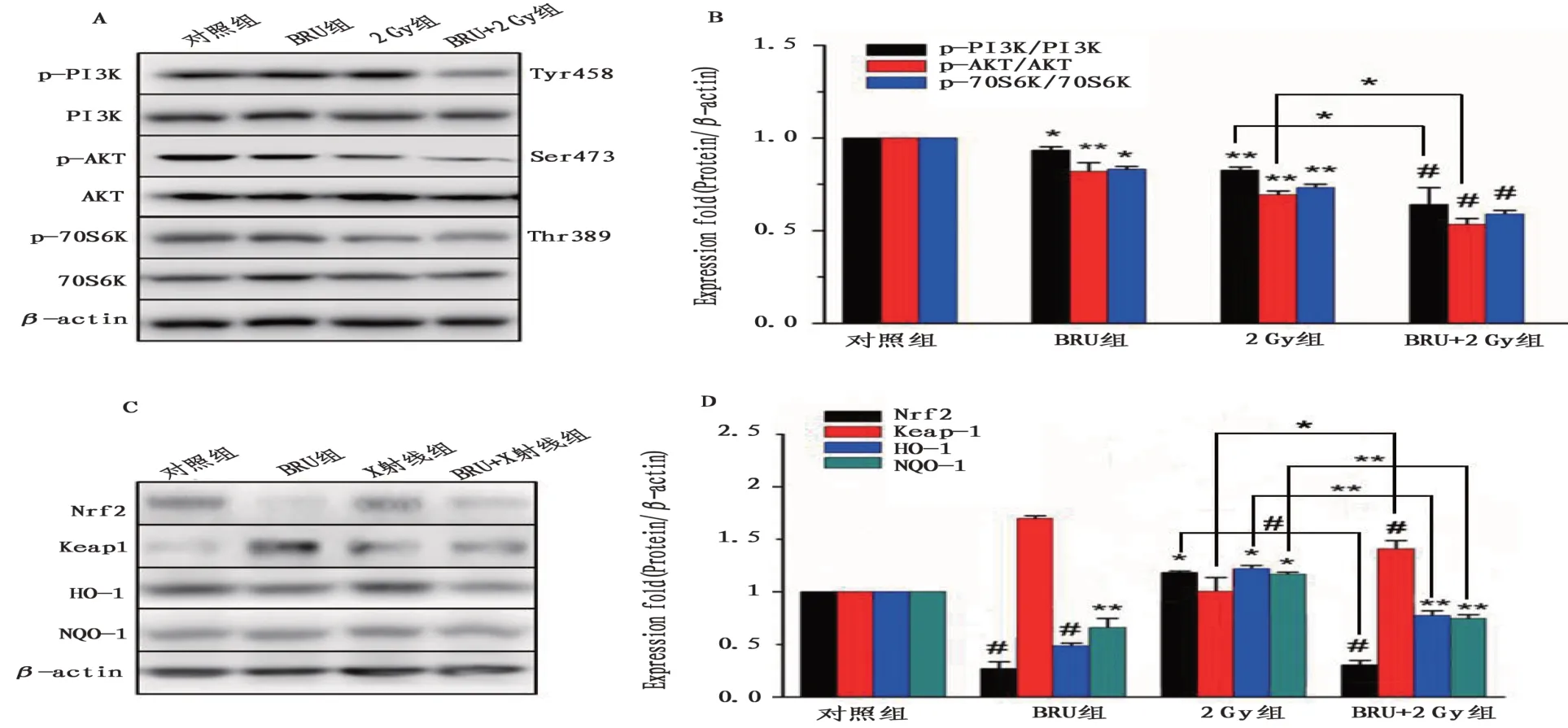
圖4 各組H1299細胞PI3K/Akt/Nrf2/HO-1信號通路相關蛋白表達情況
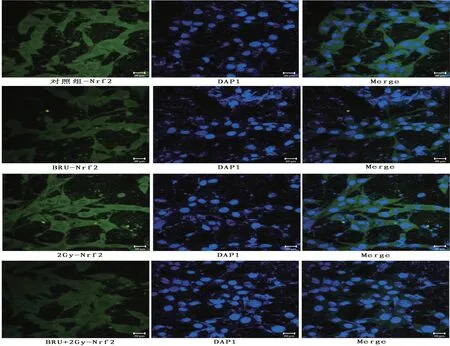
圖5 各組H1299細胞線粒體凋亡情況
2.6 各組H1299 細胞線粒體凋亡情況與對照組相比,BRU組(P<0.05)、2 Gy組(P<0.05)和BRU+2 Gy 組Apaf-1(BRU 組P<0.01;2 Gy 組P<0.01;BRU+2 Gy組P<0.001)、bax/bcl-2(BRU組P<0.01;2 Gy組P<0.01;BRU+2 Gy組P<0.01)、cytochrome C(BRU 組P<0.05;2 Gy 組P<0.01;BRU+2 Gy 組P<0.001)和cleaved-caspase 3的表達升高(BRU組P<0.05;2 Gy組P<0.05;BRU+2 Gy組P<0.001)(圖6B);2 Gy 組與BRU+2 Gy 組Apaf-1(P<0.05)、bax/bcl-2(P<0.05)和cleaved-caspase 3(P<0.001)比較差異有統計學意義。見圖6。
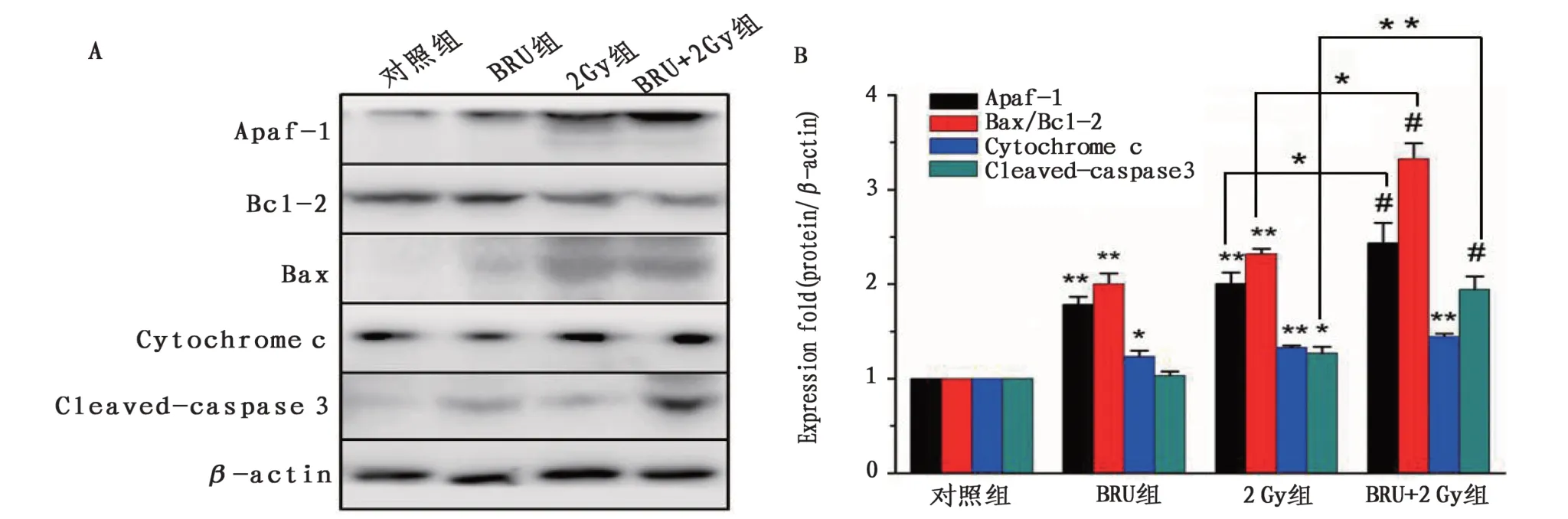
圖6 各組線粒體凋亡通路蛋白表達情況
3 討論
從中醫藥提取的天然產物在抑制腫瘤方面具有獨特優勢,因此,從天然產物對腫瘤細胞的作用機制入手,探討天然產物聯合放療對腫瘤組織的作用方式和途徑,對促進中醫藥發展具有重要意義[4]。有研究[5]表明,BRU能夠通過抑制Nrf2表達有效抑制多種腫瘤細胞增殖,誘導腫瘤細胞凋亡,是具開發價值的天然抗腫瘤藥物之一。有研究[6]發現,輻射可以抑制PI3K/Akt/Nrf2 信號通路,誘導腫瘤細胞ROS 含量升高,誘導腫瘤細胞凋亡,這對理清BRU通過抑制Nrf2增加腫瘤細胞輻射敏感性研究提供了思路。本研究以p53 缺失具有輻射耐受性的人非小細胞肺癌H1299 細胞為研究對象,從PI3K/Akt/Nrf2信號通路出發探討BRU的輻射增敏作用,揭示其內在分子機制。
本研究結果表明,BRU 對H1299 細胞生長和Nrf2 蛋白表達具有抑制作用。BRU 對H1299 細胞生長的抑制作用具有時間和劑量依賴性,經IC50處理的H1299 細胞,Nrf2 表達呈時間依賴性。表明BRU可通過抑制Nrf2表達從而抑制細胞增殖,y該結果與文獻報道一致[7-8]。BRU 或X 射線都能抑制H1299 細胞增殖、促進凋亡,研究結果與文獻報告一致[3]。而BRU聯合X射線能夠更好抑制H1299細胞增殖、促進凋亡,提示BRU 可增強H1299 細胞輻射敏感性,進而提高放療療效。
Nrf2 是一個轉錄因子,在控制氧化反應中發揮關鍵作用,對抑制炎癥反應和細胞蛋白酶以及維持線粒體功能具有重要作用[9]。正常狀況下,只有小部分Nrf2 進入細胞核啟動轉錄,大部分Nrf2 與Keap1 結合形成復合物,便于被泛素蛋白酶體降解[10-11]。Nrf2被認為是重要的細胞保護因子之一,腫瘤細胞Nrf2 的異常激活,與癌癥的藥物治療和輻射耐受性有關,目前研究人員還未就Nrf2 的調控機制達成一致[12]。有研究[13]發現,PI3K/Akt 信號通路是腫瘤細胞重要的存活通路,該通路的激活能夠增加腫瘤細胞蛋白合成,參與調節細胞增殖、遷移、凋亡等過程,PI3K/Akt 信號通路已被證實與多種癌癥的發生、轉移、惡化等過程相關。相關研究[14]證實Nrf2是Akt的靶蛋白之一,Akt 或其上游PI3K 被抑制均可抑制Nrf2 活性,這為揭示BRU 輻射增敏作用的內在分子機制提供了契機。
本研究結果表明,BRU 能抑制PI3K 和Akt 磷酸化水平,降低Nrf2 及其下游蛋白表達,在2 Gy組和BRU+2 Gy 組都能觀察到相似結果,表明BRU可通過抑制PI3K/Akt信號通路抑制Nrf2活性,增加H1299 細胞的輻射敏感性。Nrf2 表達降低使H1299細胞抗氧化能力減弱,一方面使ROS含量升高,誘發DNA 損傷應答,激活ROS 下游凋亡信號通路,誘導細胞凋亡[15],本研究中BRU 組、BRU+2 Gy組和BRU+2 Gy 組高ROS 含量和細胞凋亡率能夠證明這一過程;另一方面,Nrf2 活表達降低能夠減少其靶蛋白Bcl-2表達,導致Bax/Bcl-2比例失衡,激活Apaf-1,釋放細胞色素c,活化Caspase-3,激活線粒體凋亡通路[16],導致H1299 細胞凋亡,本研究中線粒體凋亡途徑的Western blotting 結果能夠證明這一過程。
綜上所述,BRU 通過抑制PI3K/Akt/Nrf2 信號通路增強H1299細胞的輻射敏感性,該結果為BRU的輻射增敏作用機制研究提供了依據。

