瘦素對綿羊卵泡顆粒細胞增殖/凋亡的影響
賈凱琪,郭翔宇,黨文慶,李雅婷,馬曉燕,王 鍇,呂麗華
(山西農業大學動物科學學院,山西太谷030801)
原始卵泡庫的大小決定了雌性哺乳動物的生殖能力,卵泡發育在雌性生殖中起著重要的作用。研究發現,脂肪因子在卵巢生理活動中發揮著重要作用,尤其是瘦素,由肥胖基因編碼[1]。研究發現,瘦素缺陷小鼠的卵泡受損,卵泡顆粒細胞凋亡增強,繁殖異常[2]。顆粒細胞(GCs)在卵泡形成和發育過程中發揮重要作用,通過間隙連接為卵母細胞提供營養[3],其增殖和凋亡影響著卵巢功能的維持和發揮。目前,在人類[4]、小鼠[3]、牛[5]、豬[6]和羊[7]等動物的卵泡膜細胞和GCs 中發現了瘦素受體。瘦素受體的選擇性剪接可產生 6 種形式的受體(OB-Ra 至 OB-Rf)[8],其中,OB-Rb 是一種功能性的瘦素受體,介導細胞內信號轉導。瘦素受體酪氨酸位點突變的Y123F 小鼠血清E2水平下降、生殖器官不成熟導致不孕以及發生代謝異常[9]。近年來研究表明,瘦素不僅通過下丘腦/垂體參與促性腺激素的分泌,而且循環或局部產生的瘦素也可以直接調節卵巢功能[10]。瘦素信號結合跨膜受體OB-Rb 通過Janus 激酶信號轉導和轉錄激活因子(JAK/STAT)途徑發揮作用[11-12]。當Janus 激酶 2(JAK2)被激活時,OB-Rb 在不同的酪氨酸位點被進一步磷酸化,隨后信號轉導和轉錄激活因子3(STAT3)通過磷酸化活化形成二聚體,進而調控靶基因的表達[13-14]。目前,瘦素已經被證明可以通過JAK2/STAT3 通路抑制人卵泡GCs 中抗繆勒激素mRNA 的表達[15]。體外添加低濃度瘦素促進鵝體內GCs 的增殖和抑制GCs 的凋亡[16],抑制豬體內GCs 的凋亡[17]和水牛體內GCs 的凋亡[18]。然而,瘦素介導這些變化的機制以及JAK2/STAT3 是否在這一過程中發揮作用仍不清楚。
本研究通過添加不同濃度的瘦素處理綿羊卵泡GCs,探討瘦素通過JAK2/STAT3 信號通路對GCs 的調控作用,旨在為提高雌性動物的繁殖性能提供理論依據。
1 材料和方法
1.1 試驗材料
在發情季節從山西省太原市清徐縣綿羊屠宰基地采集成年、健康雌性綿羊的卵巢。
1.2 主要試劑
重組羊瘦素購自ProSpec 公司,胎牛血清FBS購自CellMax 公司,青鏈霉素混合液、SDS-PAGE 凝膠制備試劑盒、MTT 試劑盒、1×PBS 緩沖液(pH 值7.2~7.4)、DAPI、PMSF 均購自北京索萊寶科技有限公司,DMEM/F12 基礎培養液購自 HyClone 公司,EdU 細胞增殖檢測試劑盒購自RIBOBIO 公司,BSA、Triton X-100 購自 Sigma-Aldrich 公司,反轉錄試劑盒購自 TaKaRa,JAK2 抗體、P-STAT3 抗體購自 CST 公司,STAT3 一抗購自 ABclonal 公司,Bcl-2一抗、封閉蛋白奶粉、PMSF 均購自博士德生物工程有限公司,FSHR 一抗、β-actin polyclonal antibody購自BioWorld,OB-Rb 抗體購自生物工程(上海)股份有限公司,IRDye800CW Goat anti-Rabbit 購自LI-COR,RIPA 裂解液購自上海碧云天生物技術有限公司。
1.3 細胞收集
收集卵巢,經消毒后置于DPBS 溶液中,在短時間內盡快運回實驗室。不同直徑的卵泡中卵泡顆粒細胞具有不同轉錄組譜[19],在體外培養時,根據卵泡的發育階段,本試驗僅從2~5 mm 的卵泡中分離卵泡顆粒細胞。分離的卵泡用酒精浸泡后置入預冷的DPBS 中,將卵泡在表面皿中(含DPBS)剪開,沿卵泡內壁輕刮,獲取壁層顆粒細胞,用15 mL 的離心管收集。1 000 r/min 離心5 min,棄去上清,用完全培養基(DMEM/F12 基礎培養基+1%雙抗+10%FBS)重懸沉淀,離心洗滌2 次,用完全培養基重懸的細胞懸液鋪于培養皿,置于細胞培養箱(37 ℃,5%CO2)培養用于后續試驗。
1.4 試驗方法
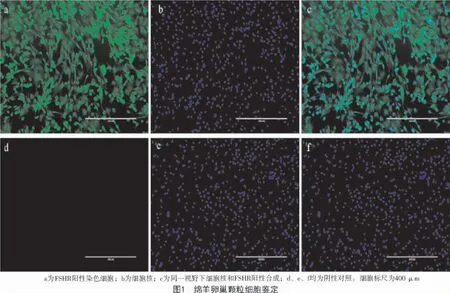
1.4.1 卵泡顆粒細胞鑒定 GCs 鋪于12 孔板中,達到50%左右細胞融合率時,棄液體,加入PBS 溶液輕輕晃動細胞板,洗去多余培養液。4%多聚甲醛固定液室溫孵育30 min,PBS 洗滌后每孔加入1%Triton X-100 溶液 37 ℃通透 30 min,PBS 溶液洗滌后每孔再加入 500 μL 1% BSA 37 ℃封閉 1 h,PBS溶液洗滌。試驗孔加入200 μL FSHR 一抗(1∶100稀釋),陰性對照加入200 μL PBS,4 ℃孵育 12 h。PBS 洗滌,綠色熒光二抗避光37 ℃孵育1 h(1∶200 稀釋)。PBS 避光洗滌。每孔滴加DAPI 原液100 μL,37 ℃避光孵育 20 min,PBS 避光洗 4 次,每次5 min。熒光顯微鏡進行拍照記錄。
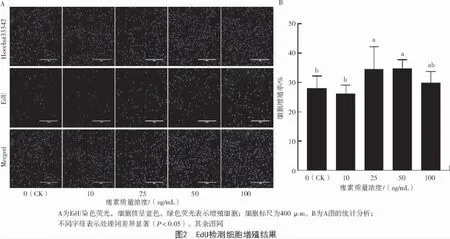
1.4.2 卵泡顆粒細胞增殖 取生長狀態旺盛的細胞接種于24 孔板中,鋪勻,貼壁后,用加入不同濃度瘦素(0、10、25、50、100 ng/mL) 的無血清培養基(DMEM/F12 基礎培養基+1%雙抗)培養細胞24 h后,按 1 000∶1 稀釋 EdU 溶液,配制為 50 μmol/L的 EdU,向每孔中加入 500 μL,孵育 2 h,PBS 洗滌1~2 次;4%多聚甲醛固定30 min,棄去液體;添加2 mg/mL 的甘氨酸于試驗孔,脫色搖床洗脫5 min,棄去;加入PBS,脫色搖床孵育5 min,棄去;再加入滲透劑(0.5%Triton X-100 的 PBS)搖床孵育 10 min,PBS 洗去多余滲透劑;添加 500 μL1×Apollo 染色反應液于試驗細胞孔中,置于搖床上避光處理30 min,棄去反應液;加入滲透劑脫色搖床清洗10 min,重復2~3 次,棄去滲透液;每孔再加入1×Hoechst33342反應液,室溫條件下避光搖床孵育30 min,棄去反應液;PBS 洗滌1~3 次,使用熒光顯微鏡進行觀測拍照。
1.4.3 qPCR 擴增 在6 孔中培養細胞,細胞貼壁后,用加入不同濃度瘦素(0、10、25、50、100 ng/mL)的無血清培養基培養24 h 后,收集細胞,向培養孔中加入1 mL Trizol,通過抽提、沉淀、溶解等步驟提取RNA。用NanoDrop ND-1000 儀器評估RNA 的質量,RNA 樣品的 OD260/OD280值在 1.8~2.0 范圍內可使用。使用TaKaRa 公司反轉錄試劑盒將所提取的RNA 反轉錄為cDNA。將該cDNA 作為模板進行qPCR 擴增。引物序列如表1 所示,由華大基因合成,β-actin作為內參基因。依據Prime ScriptTMRTreagent Kit with gDNA Eraser 說明書,反應體系為 10 μL。反應程序為:95 ℃ 30 s 進行預變性;95 ℃ 5 s,60 ℃30 s,72 ℃ 15 s,進行 45 個循環(PCR 反應階段);95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s(熔解曲線階段)。

表1 基因引物序列
1.4.4 Western blotting 收集不同濃度瘦素處理24 h后的顆粒細胞,向每孔加入含有蛋白酶抑制劑PMSF的蛋白裂解液200 μL,低溫裂解30 min,收集樣品。向樣品中加入蛋白上樣緩沖液(體積比4∶1),將樣品混勻離心,在金屬浴中變性10 min,取出后放在冰上等待加樣。通過SDS-PAGE 電泳分離蛋白,依據Maker 大小,切下含目的蛋白的凝膠,通過轉膜程序將其轉移至NC 膜上,5%脫脂奶粉室溫封閉90 min,用 TBST 稀釋一抗 β-actin(1∶10 000)、JAK2(1∶1 000)、STAT3(1∶500)、Bcl-2(1∶500)、BAX(1∶1 000)、P-STAT3(1∶1 000),4 ℃孵育過夜。用TBST 稀釋羊抗兔 IgG(1∶18 000),孵育 1 h。采用Odyssey CLX 遠紅外掃描系統檢測NC 膜結果,β-actin作為內參蛋白進行結果分析。
1.5 數據分析
EdU 結果用Image J 軟件計數和分析細胞增殖數。qPCR 結果采用 2-ΔΔCt法計算靶基因 mRNA 的相對豐度表達,β-actin為內參基因。Western blotting蛋白條帶的灰度值由Image J 軟件分析得出。在保證正態性和方差齊性后,采用SPSS 22.0 單因素方差分析(ANOVA)對數據進行分析,GraphPad Prism 7.0 軟件用于繪圖。試驗數據用平均值±標準差表示,P<0.05 顯示差異顯著。
2 結果與分析
2.1 免疫熒光結果
卵泡激素受體(FSHR)特異性表達于卵泡顆粒細胞,經免疫熒光染色的卵泡顆粒細胞如圖1 所示。由圖1 可知,95%以上的顆粒細胞表達FSHR受體,可用于后續試驗。
2.2 顆粒細胞增殖能力
EdU 檢測細胞增殖情況如圖2-A 所示。通過Image J 分析表明,與對照組(0 ng/mL)相比,25、50 ng/mL 瘦素處理24 h 后細胞增殖率顯著升高(P<0.05)(圖 2-B)。
2.3 瘦素對相關基因表達的影響
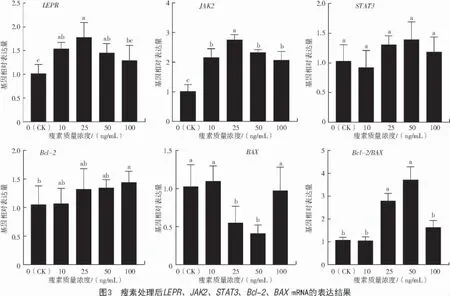
由圖3 可知,與對照組(0 ng/mL)相比,添加不同濃度瘦素后,LEPR、JAK2的mRNA 表達均顯著提高(P<0.05),抑凋亡基因Bcl-2在添加100 ng/mL瘦素后表達升高(P<0.05),促凋亡基因BAX在添加 25、50 ng/mL 瘦素后表達顯著降低(P<0.05)。Bcl-2/BAX在 25、50 ng/mL 瘦素時表達顯著升高(P<0.05)。
2.4 瘦素對相關蛋白表達的影響
在蛋白水平,與對照組(0 ng/mL)相比,加入不同濃度瘦素后,LEPR 在 25、50 ng/mL 時表達顯著升高,JAK2 在50 ng/mL 時表達顯著升高,STAT3在 25、50 ng/mL 時表達顯著升高,P-STAT3 表達在50 ng/mL 時顯著增加(P<0.05),Bcl-2 在 50 ng/mL時表達量顯著升高(圖4)。

3 結論與討論
卵泡GCs 是卵泡的功能細胞,GCs 凋亡可引發卵泡閉鎖的發生。當發生卵泡閉鎖時,GCs 凋亡率明顯升高,在小卵泡中表現明顯[20-21],凋亡相關基因Bcl-2 和BAX 的比值呈現顯著下降趨勢[22],進一步說明GCs 凋亡可用于評價卵泡健康狀況。卵泡GCs具有強大的分泌功能。卵母細胞可以通過它們之間的間質連接獲得必要的營養,以發育成熟[23]。
本研究表明,外源瘦素對綿羊GCs 的生長有促進作用。EdU 結果顯示,與對照組相比,25 ng/mL 或50 ng/mL 瘦素促進 GCs 增殖。據報道,10 ng/mL 瘦素可促進鵝卵泡GCs 增殖[16],這與本試驗結果一致,但瘦素濃度略有不同,可能是由于物種差異所致。100 ng/mL 瘦素促進Bcl-2基因的表達,研究發現,細胞凋亡過程中Bcl-2/BAX值可間接反映細胞的凋亡被抑制程度,25 ng/mL 或50 ng/mL 瘦素作用于GCs 時,Bcl-2/BAX值升高,證明細胞凋亡被抑制。瘦素的抑凋亡作用也在OVCAR-3 卵巢癌細胞上被證實,這可能是由于增殖相關基因表達的增加和促凋亡相關基因表達的降低[24]。轉染Leptin-siRNA 于人卵巢 GCs 24 h 后,GCs 增殖減弱,Bcl-2表達受到抑制,BAX表達增強[25],與本研究結果相反,沉默瘦素基因表達后,凋亡基因表達改變,從相反的角度驗證了本研究的結果。當細胞培養液中添加25 ng/mL瘦素培養綿羊腔前卵泡時,可提高卵泡的發育以及卵母細胞成熟率[26-27],卵泡體外存活率的提高可能與瘦素對卵泡GCs 的作用有關。體外培養液中添加25 ng/mL 瘦素與本試驗結果得出的25 ng/mL 的瘦素對GCs 的增殖作用一致。牛卵母細胞體外培養液中加入1 000 ng/mL 瘦素,受精后第5 天成熟卵母細胞發育到8- 細胞期的百分率高于對照組[28]。PANDA 等[27]也研究表明,在水牛卵母細胞體外培養基中添加瘦素可提高卵裂率和囊胚率,獲得高質量的卵母細胞。短期優化飼養綿羊血清中瘦素水平提高,可增加卵泡GCs 中OB-Rb 的表達,使卵泡在最后一個非排卵波中的存活時間延長[29]。本試驗也證明,體外培養體系中瘦素濃度的增加可增加LEPR的表達。綜上所述,目前和以往的研究表明,瘦素在調節卵巢GCs 生長中起著重要作用。
研究發現,在細胞發生增殖、凋亡或進行免疫調節過程中,JAK2/STAT3 通路都參與其中[30]。瘦素通過JAK2/STAT3 途徑調節針對視前黑素皮質素(POMC)神經元 mRNA 的 miRNAs 的表達[31]。瘦素還通過JAK2/STAT3 途徑對小鼠腦缺血再灌注損傷和氧糖剝奪(OGD)原代皮層神經元培養具有神經保護作用[32]。瘦素通過JAK2/STAT3 信號途徑促進肝細胞癌細胞的生長和遷移[33]。本研究對綿羊GCs 增殖過程中瘦素與JAK2/STAT3 信號通路之間的相互作用進行了驗證。通過檢測與JAK2/STAT3通路相關的JAK2 和STAT3 信號分子的表達,發現 LEPR、JAK2、STAT3 和 P-STAT3 在 mRNA 和蛋白表達上增加,說明外源性瘦素處理激活了綿羊GCs 中的JAK2/STAT3 信號通路,可以進一步進行驗證。
綜上所述,瘦素促進卵泡GCs 的增殖,提高了Bcl-2/BAX值,其中,50 ng/mL 瘦素對 GCs 的促增殖抑凋亡作用最佳。同時,瘦素提高了GCs 中瘦素受體的表達,激活了JAK2/STAT3 通路。

