miR-92a靶向調控STARD13表達促進前列腺癌DU145細胞侵襲和遷移的實驗研究
辛以軍 徐蓬永 欒建波
前列腺癌是一種男性常見的惡性腫瘤,近年來其發病率有明顯升高趨勢[1,2]。隨著醫學技術的不斷發展,雖然在手術、放化療和內分泌等治療方面取得了很大進步,但對于發生轉移的中晚期患者的治療效果并不理想[3]。因此,深入了解腫瘤細胞轉移的分子機制有利于為前列腺癌治療提供新的治療靶點和方向。研究顯示,在前列腺癌中部分異常表達的miRNA可通過影響腫瘤細胞生物學功能發揮著重要的抑癌或促癌作用[4,5]。miR-92a是miRNAs家族成員,被證實在胃癌和肺癌等多種腫瘤中異常高表達,且具有促進細胞增殖、侵襲和遷移的作用[6]。有研究指出,miR-92a在前列腺癌中呈現高表達,且其表達水平與腫瘤分期、淋巴結轉移等密切相關[7];盡管miR-92a被證實具有促進前列腺癌細胞增殖及抑制細胞凋亡的作用[8],但其在前列腺癌細胞侵襲和遷移中的作用及調控機制并不清楚。本研究通過觀察miR-92a對前列腺癌DU145細胞侵襲和遷移的影響并探討其可能的作用機制,旨在揭示miR-92a在前列腺癌轉移中的作用,為前列腺癌的發病機制及治療提供新線索。
1 材料與方法
1.1 材料 miR-92a mimics、miR-92a inhibitor及其陰性對照(廣州銳博生物公司),siRNA-STARD13及其陰性對照(上海吉瑪制藥公司),pcDNA3.1-STARD13過表達載體及其空載體(山東維真生物公司),DMEM培養基(美國Hyclone公司),胎牛血清和胰蛋白酶(杭州四季青公司),兔抗人STARD13多克隆抗體(美國Abcam公司),辣根過氧化酶標記的二抗(北京中杉金橋生物公司),Transwell小室(美國Corning公司),Matrigel基質膠(美國Sigma公司),Trizol試劑和Lipofectamine 2000(美國Invitrogen公司),PCR引物(上海生工生物工程公司),雙熒光素酶報告基因檢測試劑盒、逆轉錄試劑盒和BCA蛋白濃度測定試劑盒(上海碧云天生物公司)。
1.2 細胞及其培養 人前列腺癌細胞株DU145購于美國ATCC。使用含10%胎牛血清的DMEM培養基在5%CO2、100%濕度和37℃細胞培養箱中常規培養DU145細胞。每2天換液1次,待細胞貼壁后,加入0.25%胰蛋白酶消化傳代,待細胞傳至第3代后可應用于實驗。
1.3 細胞轉染 將處于對數生長期的DU145細胞按照2×105個/孔接種至6孔細胞板上,在5%CO2、100%濕度和37℃環境下常規培養;待細胞達60%~70%匯合度時,根據轉染試劑Lipofectamine 2000說明書進行瞬時轉染。其中,將轉染miR-92a mimics、miR-92a inhibitor及其陰性對照的細胞分別標記為miR-92a mimics組、miR-92a inhibitor組、mimics-NC組和inhibitor-NC組;而將轉染siRNA-STARD13、pcDNA3.1-STARD13及相應對照的細胞作為siRNA-STARD13組、pcDNA3.1-STARD13組、siRNA-NC組和pcDNA3.1組。轉染6 h后,更換新鮮培養基繼續培養;待培養48 h 后,收集各組細胞進行后續實驗。
1.4 RT-PCR檢測miR-92a表達 收集轉染48 h后的miR-92a mimics組、miR-92a inhibitor組、mimics-NC組和inhibitor-NC組細胞,采用Trizol法提取細胞總RNA后,使用紫外分光光度計檢測RNA的濃度與純度。將高質量的RNA參照逆轉錄試劑盒說明書步驟進行逆轉錄,再將逆轉錄產物cDNA作為模板,以U6為內參進行PCR擴增,并采用2-ΔΔCt法計算DU145細胞中miR-92a的表達水平。其中,PCR反應條件為先以94℃預變性3 min后,進入40個循環階段:94℃變性30 s、60℃退火30 s、72℃延伸30 s,循環結束后72℃總延伸6 min。PCR反應引物序列為miR-92a 正向引物:5’-CACCTATATTGCACTTGTCC-3’,反向引物:5’-TGCGTGTCGTGGAGTC-3’;U6正向引物:5’-ACCCTGAGAAATACCCTC-ACAT-3’,反向引物:5’-GACGACTGAGCCCCTGATG-3’。
1.5 MTT檢測細胞活力 在96孔板接種各組DU145細胞,每孔1×104個細胞,分別連續培養24、48、72 h后,以20 μl/孔的5 mg/ml MTT溶液37℃孵育4 h,之后每孔加入150 μl/孔的二甲基亞砜37℃震蕩培養10 min,采用酶標儀測定DU145細胞490 nm波長處的吸光度值(OD490),以表示細胞活力。
1.6 Transwell小室實驗檢測細胞侵襲和遷移 在開展侵襲實驗前,以無血清培養基質將Matrigel基質膠按照1∶8比例稀釋后均勻地平鋪到Transwell小室中的上室中,置于37℃下充分融合凝固(在開展遷移實驗前無需該過程)。收集轉染48 h后的miR-92a mimics組、miR-92a inhibitor組、mimics-NC組和inhibitor-NC組細胞,以磷酸緩沖液洗滌2次后,加入無血清培養基制成濃度為105個/ml的細胞懸液。在將Transwell小室放入24孔板之前,在24孔細胞板中先加入含血清的培養基600 μl/孔,放入小室后在小室上室中加入200 μl/孔細胞懸液;置于5%CO2、100%濕度和37℃環境下培養24 h后,將小室取出,以棉簽小心拭去上室中殘留的細胞后,浸入4%多聚甲醛中固定20 min;經0.1%結晶紫染色15 min后,采用顯微鏡觀察穿過濾膜的細胞數,以評價細胞的侵襲或遷移能力。實驗重復3次。后續,siRNA-STARD13組、pcDNA3.1-STARD13組、siRNA-NC組和pcDNA3.1組細胞侵襲和遷移能力采用相同方法檢測。
1.7 雙熒光素酶報告基因實驗檢測miR-92a與STARD13靶向關系 采用生物信息學軟件預測發現miR-92a與STARD13 3’UTR存在互補的結合位點,猜測STARD13可能是miR-92a的潛在靶基因。將STARD13 3’UTR克隆重組至熒光素酶報告基因載體pmirGLO上,作為STARD13-WT質粒;另外,將miR-92a與STARD13 3’UTR的結合位點定點突變后,克隆重組至pmirGLO上,作為STARD13-MUT質粒。參照Lipofectamine 2000說明書將STARD13-WT或STARD13-MUT分別與miR-92a mimics、mimics-NC、miR-92a inhibitor或inhibitor-NC共轉染至DU145細胞中,對應miR-92a mimics組、mimics-NC組、miR-92a inhibitor組或inhibitor-NC組。轉染48 h后收集各組細胞,并參照雙熒光素酶報告基因檢測試劑盒說明書步驟檢測各組細胞的熒光素酶活性。實驗重復3次。
1.8 Western blotting檢測細胞中STARD13蛋白表達 向DU145細胞中加入細胞裂解液抽提細胞總蛋白后,采用BCA法檢測總蛋白的濃度與純度。將蛋白樣品與等量上樣緩沖液混勻后,置于沸水浴中煮沸變性5 min;將變性后的蛋白樣品行SDS-PAGE凝膠電泳分離后,電轉至PVDF膜上。浸入含5%脫脂奶粉的封閉液中封閉2 h后,以STARD13抗體(1∶1 000)和GAPDH抗體(1∶1 000)4℃孵育過夜;次日,再以辣根過氧化酶標記的二抗(1∶5 000)室溫孵育2 h后,暗室中加入化學發光劑顯影曝光。以GAPDH為內參,采用凝膠成像系統掃描分析DU145細胞中STARD13蛋白的表達水平。實驗重復3次。
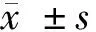
2 結果
2.1 轉染后前列腺癌DU145細胞中miR-92a的表達水平和細胞活力變化 與mimics-NC組比較,miR-92a mimics組細胞中miR-92a的表達水平明顯升高(P<0.05);與inhibitor-NC組比較,miR-92a inhibitor組細胞中miR-92a表達水平明顯降低(P<0.05)。MTT檢測結果顯示,與mimics-NC組比較,miR-92a mimics組細胞24、48和72 h的細胞活力明顯升高(P<0.05);與inhibitor-NC組比較,miR-92a inhibitor組細胞24 h、48 h和72 h的細胞活力明顯降低(P<0.05)。見表1。

表1 4 組細胞中miR-92a 表達水平和細胞活力的比較
2.2 miR-92a對前列腺癌DU145細胞侵襲和遷移的影響 Transwell小室檢測結果顯示,與mimics-NC組比較,miR-92a mimics組細胞侵襲和遷移能力均明顯增強(P<0.05);與inhibitor-NC組比較,miR-92a inhibitor組細胞侵襲和遷移能力均明顯減弱(P<0.05)。見表2。

表2 4 組細胞侵襲和遷移能力的比較
2.3 miR-92a靶基因預測及驗證 TargetScan軟件預測結果顯示,miR-92a和STARD13之間存在互補的結合位點;雙熒光素酶報告基因實驗檢測結果顯示,與相應對照mimics-NC組或inhibitor-NC組比較,miR-92a mimics能夠使轉染STARD13-WT質粒細胞的熒光素酶活性降低,而miR-92a inhibitor能夠使其熒光素酶活性升高(P<0.05);此外,Western blotting檢測結果顯示,與相應對照組比較,miR-92a mimics可使DU145細胞中STARD13蛋白表達水平明顯降低,而miR-92a inhibitor則使STARD13蛋白表達水平明顯升高(P<0.05)。見圖1,表3。

圖1 miR-92a和STARD13靶向關系的驗證;A miR-92a和STARD13之間存在互補的結合位點;B Western blotting檢測STARD13蛋白表達電泳圖

表3 4 組細胞熒光素酶活性和STARD13 蛋白表達水平的比較
2.4 STARD13對前列腺癌DU145細胞活力、侵襲和遷移的影響 Western blotting檢測結果顯示,與siRNA-NC組比較,siRNA-STARD13組細胞中STARD13蛋白表達水平明顯降低(P<0.05);與pcDNA3.1組比較,pcDNA3.1-STARD13組細胞中STARD13蛋白表達水平明顯升高(P<0.05)。MTT檢測結果顯示,與siRNA-NC組比較,siRNA-STARD13組細胞24、48和72 h的細胞活力明顯升高(P<0.05);與pcDNA3.1組比較,pcDNA3.1-STARD13組細胞24、48和72 h的細胞活力明顯降低(P<0.05)。Transwell小室實驗結果結果顯示,siRNA-STARD13組細胞侵襲和遷移能力均明顯高于siRNA-NC組,而pcDNA3.1-STARD13組細胞侵襲和遷移能力均明顯低于pcDNA3.1組(P<0.05)。見圖2,表4。

圖2 Western blotting檢測 STARD13蛋白表達電泳圖

表4 4 組細胞中 STARD13 蛋白表達水平和細胞活力、侵襲、遷移能力比較
3 討論
前列腺癌預后不良是患者死亡的重要因素,而癌細胞浸潤和轉移是導致患者預后不良的關鍵,而腫瘤細胞侵襲和遷移是導致癌細胞轉移的重要生理過程;因此,深入研究和了解前列腺癌細胞發生侵襲和遷移的分子機制對更好的治療前列腺癌具有重要意義。miRNAs是一類不編碼蛋白質且進化上高度保守的小分子RNA,其轉錄本長度約為22個氨基酸,可通過與mRNA互補配對結合調控mRNA表達,在細胞增殖、侵襲和遷移等過程中發揮著重要作用,與包括前列腺癌內在的多種腫瘤的發生發展密切相關[9],例如miR-139[10]、miR-9[11]和miR-451[12]等。作為miRNAs家族中的一員,miR-92a異常表達也可通過影響細胞侵襲和遷移參與腫瘤的惡性進展。本研究針對miR-92a在前列腺癌中的功能和機制進行評估,結果表明,miR-92a在前列腺癌進展中充當重要的癌基因,促進前列腺癌細胞的活力、遷移與侵襲。并且,miR-92a的這些作用是通過靶向前列腺癌細胞中的STARD13基因來實現的,這可能有利于尋找新的前列腺癌的診斷和治療策略。
miR-92a已被證明與腫瘤的發生發展緊密相關,例如Yu等[13]在骨肉瘤中發現,miR-92a可通過靶向調控DKK3表達促進癌細胞增殖、侵襲和遷移;Li等[14]報道指出,食管鱗癌中異常高表達的mR-92a可通過靶向調控PTEN表達促進腫瘤細胞侵襲和遷移。盡管,陳曉博[8]研究指出,miR-92a在前列腺癌中表達上調,且發揮著促增殖和抑凋亡的重要作用,但其在前列腺癌轉移中的作用并不清楚。因此,本研究在前列腺癌DU145細胞中成功上調miR-92a表達后發現,DU145細胞活力、侵襲和遷移能力明顯增強;而下調miR-92a表達后DU145細胞侵襲和遷移能力明顯減弱。結果表明,miR-92a可促進前列腺癌DU145細胞活力、侵襲和遷移。這提示miR-92a在前列腺癌細胞增殖和轉移過程中發揮著重要的促進作用,與前人研究一致,為miR-92a作為促癌因子參與前列腺癌進程提供了新的證據。
本研究采用生物信息學軟件對miR-92a的潛在靶基因進行預測,最終將STARD13作為研究對象。STARD13又名DLC2,定位于13q12.3染色體上,是一種新發現的抑癌基因,其在多種腫瘤中低表達或缺失,在細胞增殖、侵襲和遷移等過程中發揮中重要的調控作用[15]。本研究預測到miR-92a與STARD13之間存在互補的結合位點,同時雙熒光素酶報告基因實驗證實miR-92a可與STARD13靶向結合降低細胞的熒光素酶活性;此外,上調miR-92a表達可使前列腺癌DU145細胞中STARD13蛋白表達水平降低,而下調miR-92a表達則使STARD13蛋白表達水平升高。這些結果表明,STARD13是miR-92a的靶基因,miR-92a可負向調控其表達。Chen等[16]研究指出,STARD13在前列腺癌中表達下調,而上調其表達可抑制腫瘤細胞侵襲和遷移。本研究成功上調STARD13表達后發現,前列腺癌DU145細胞侵襲和遷移能力明顯減弱,而下調STARD13表達后前列腺癌DU145細胞侵襲和遷移能力明顯增強,這與Chen等[16]的報道相符。另外,上調STARD13表達后可以抑制前列腺癌DU145細胞活力,下調時具有相反的效果。該結果進一步證實了STARD13具有抑制前列腺癌細胞增殖和轉移的作用。這些結果提示,miR-92a促進前列腺癌轉移的分子機制與其靶向調控STARD13表達有關。
綜上所述,miR-92a可通過靶向調控STARD13促進前列腺癌DU145細胞侵襲和遷移。該結果進一步揭示了miR-92a在前列腺癌發生發展中的作用,也為以miR-92a為靶點的前列腺癌基因治療提供了新的參考依據。

