磁共振DKI評估慢性腎臟病腎功能價值的初步研究
冒煒, 丁玉芹, 曾蒙蘇, 傅彩霞, 丁小強, 周建軍
慢性腎臟病(chronic kidney disease,CKD)是指患者腎功能受損時間≥3個月,包括腎小球濾過率(glomerular filtration rate,GFR)正常或不正常的腎臟病理損傷、血尿或尿液成分異常以及影像學表現異常,或不明原因的GFR下降(<60 mL/min/1.73m2)大于3個月。CKD持續發展可引起慢性腎功能不全[1]。CKD已經成為全球性的社會公共健康問題之一,發病率逐年增加,近年來,我國的CKD發病率已經達到10.8%[2]。早期診斷CKD及精確評估腎功能損害程度對延緩CKD進展為終末期腎病具有重要意義[3]。臨床評價腎功能常用的指標是通過血清學方法測量GFR,準確測量GFR對于明確CKD的分期、評估腎功能狀態、評價治療效果及調整治療方案都具有重要的意義。已有研究證實磁共振擴散加權成像(diffusion weighted imaging,DWI)可用于評估CKD患者的腎功能[4-5],而擴散峰度成像(diffusion kurtosis imaging,DKI)在DWI的基礎上采用非高斯擴散模型,峰度參數能反映水分子擴散非高斯位移偏離理想高斯分布的程度,從而更敏感地反映組織的微觀結構和病理生理改變[6],對腎臟磁共振功能成像的研究更有優勢。本研究中,筆者旨在探討DKI在評估CKD患者腎功能方面的臨床應用價值。
材料與方法
1.臨床資料
復旦大學附屬中山醫院倫理委員會批準了本研究,所有參與者檢查前簽署了知情同意書。
慢性腎臟病組:根據以下標準前瞻性將2019年12月-2020年12月在本院就診的CKD患者納入研究。納入標準:⑴符合CKD的臨床診斷標準[7];⑵無MRI檢查禁忌證;⑶無其它器官或系統的嚴重疾病;⑷腎臟超聲檢查顯示無嚴重腎萎縮;⑸ MRI圖像質量達到診斷要求。排除標準:⑴MRI圖像質量未達到圖像分析要求者;⑵因幽閉恐懼癥或腹水等原因無法配合磁共振檢查的患者;⑶存在影響腎臟DKI圖像分析的疾病,如腎多發囊腫、腎腫瘤等。最終將70例CKD患者納入本研究,男38例,女32例;年齡16~76歲,平均(49±15)歲。記錄所有CKD患者MRI檢查當日的血清肌酐(SCr)值,根據簡化腎臟病飲食改善公式(modification of diet in renal disease,MDRD)計算估算腎小球濾過率(estimated glomerular filtration rate,eGFR)[8]:
eGFR=186×SCr-1.154×年齡-0.203×0.742(女性) (1)
腎臟病患者生存質量指導(kidney disease outcomes quality initiative,K-DOQI)中CKD的分期標準:1期,eGFR >90 mL/(min·1.73m2);2期,eGFR 60~89 mL/(min·1.73m2);3期,eGFR 30~59 mL/(min·1.73m2);4期,eGFR 15~29 mL/(min·1.73m2);5期,eGFR<15 mL/(min·1.73m2)[9]。根據此分期標準,將本研究中的CKD患者分為2個亞組:輕度腎損害組為eGFR≥60 mL/(min·1.73m2),包括1期19例、2期25例;中重度腎損害組為eGFR<60 mL/(min·1.73m2),包括3期19例、4期5例和5期2例。
對照組:招募20例健康志愿者納入對照組,男11例,女9例;年齡26~72歲,平均(41±16)歲。所有志愿者既往無腎臟相關疾病史和高血壓、糖尿病、系統性紅斑狼瘡等可能影響腎功能的病史,近期未服用腎毒性藥物,血清肌酐和尿素氮均在正常值范圍內,雙腎影像學檢查無陽性發現。
2.MRI檢查方法
磁共振檢查使用Siemens Magnetom Aera 1.5T MR掃描儀和18通道腹部相控陣表面線圈。所有受檢者行磁共振常規序列和DKI檢查,檢查前要求受試者禁食、禁水至少4 h,并囑其保持均勻的呼吸幅度和頻率。常規MRI序列:⑴半傅立葉采集單次激發快速自旋回波序列冠狀面T2WI,TR 1400.00 ms,TE 92.00 ms,層厚5.0 mm,層距1.0 mm,帶寬698 Hz,視野380 mm×380 mm;⑵脂肪抑制容積內插屏氣掃描序列冠狀面、橫軸面T1WI,TR 4.36 ms,TE 2.00 ms,層厚5.0 mm,層距1.0 mm,帶寬400 Hz,視野380 mm×380 mm。DKI采用單次激發自旋平面回波成像(single shot echo planar imaging,SS-EPI)序列,以腎門水平為中心,自由呼吸狀態下行冠狀面掃描,掃描參數:TR 7300.00 ms,TE 66.00 ms,層厚5.0 mm,帶寬1698 Hz,視野380 mm×380 mm,b=0、500、1000、1500、2000和2500 s/mm2。
3.圖像后處理和分析
在不知曉受試者臨床資料的前提下,由2位經驗豐富的放射科醫師進行數據的采集、處理及分析,并且評估兩者測量結果的一致性,然后取2位醫師測量結果的平均值用于后續的統計學分析。使用專用后處理軟件Siemens Body Diffusion Toolbox完成DKI原始圖像的后處理及數據測量。根據非高斯擴散模型及公式(1)計算生成平均擴散系數(mean diffusivity,MD)圖和平均峰度(mean kurtosis,MK)圖:
S(b)=S0·exp (-b·D+b2·D2·K/6)
(2)
其中,S(b)為在設定b值的DKI圖像上的信號強度,S0為b=0 s/mm2圖像上的信號強度,D為擴散系數,K為峰度。
MD反映的是水分子整體的擴散水平,MK反映的是水分子擴散非高斯位移偏離理想高斯分布的程度。我們將右腎作為測量的靶器官,這是因為左腎受呼吸運動及心臟大血管搏動的影響更大[10]。以抑脂T1WI和T2WI冠狀面圖像為參考,確定腎臟皮質和髓質的分布,避開腎竇組織及偽影,在近腎門水平層面的DKI圖像(b=0 s/mm2)上,分別于腎臟的上極、中極和下極的皮質和髓質手動勾畫1個感興趣區(region of interest,ROI),共6個ROI(皮質3個和髓質3個),每個ROI的面積大于5個像素,然后將ROI復制到相同層面的MD和MK圖上,測量腎、皮髓質的MD和MK值。
4.統計學分析
統計學分析使用SPSS 22.0和MedCalc 15.8軟件。計量資料以均數±標準差的形式表示。各組受試者腎臟皮質和髓質的DKI參數值的比較采用配對樣本t檢驗,采用單因素方差分析比較3組受試者腎臟皮質和髓質DKI參數值的差異,進一步采用LSD法進行組間兩兩比較。CKD患者腎臟皮質和髓質DKI參數值與eGFR之間相關性的評估采用Pearson相關性分析,|r|<0.3為低度相關,0.3≤|r|<0.7 為中度相關,0.7≤|r|<1.0為高度相關。采用ROC曲線評估DKI參數值對輕度組與中重度腎損害組及輕度腎損害組與對照組的鑒別診斷效能。對2位醫師測量結果一致性的評估采用組內相關系數(intraclass correlation coefficient,ICC),ICC值>0.75為一致性好。以P<0.05為差異有統計學意義。
結 果
本研究中所有受試者獲得了質量較好的DKI圖像,腎臟形態正常,腎皮質和髓質顯示清晰(圖1)。
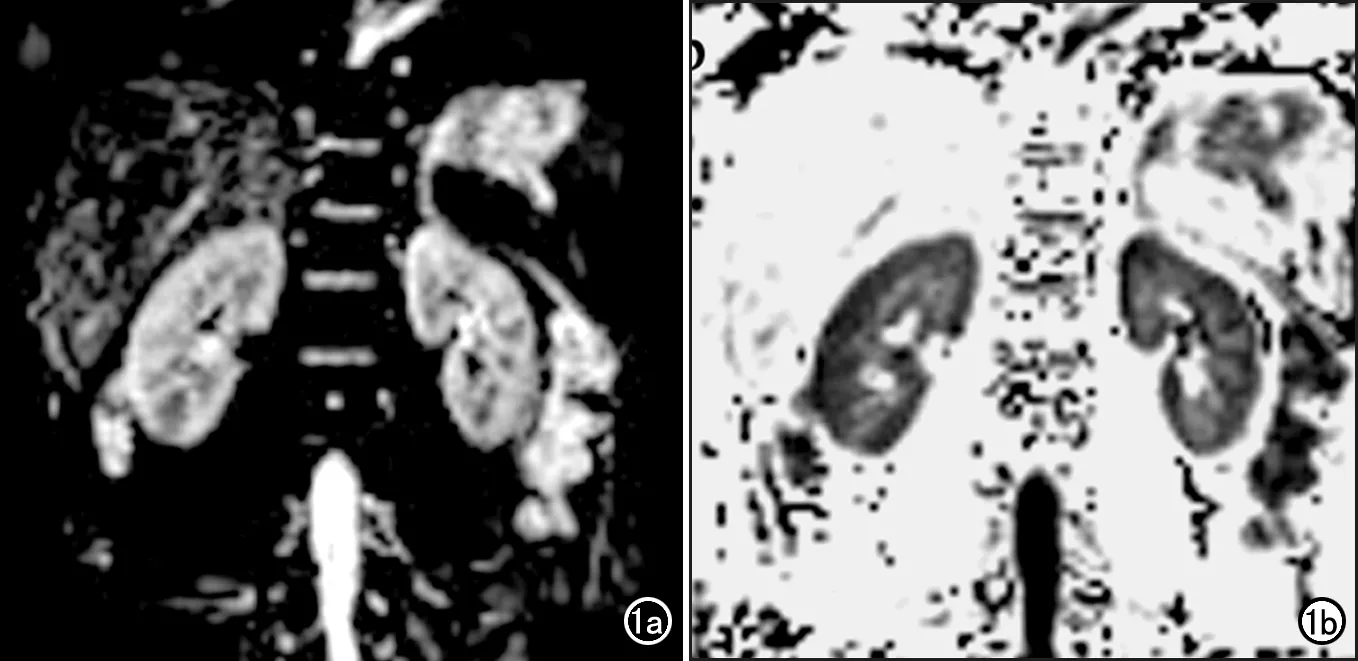
圖1 對照組受試者的DKI參數圖,顯示腎臟形態正常,腎皮質和髓質顯示清晰。a)平均擴散系數圖;b)平均峰度圖。
1.兩位醫師測量結果的一致性
兩位醫師測量的腎臟皮質和髓質的MD和MK值的一致性均較好。測量的皮質MD及MK值的ICC值分別為0.914(95%CI:0.872~0.943)和0.970(95%CI:0.955~0.980),測量的髓質MD及MK值的ICC值分別為0.911(95%CI:0.868~0.941)和0.916(95%CI:0.875~0.944)。
2.DKI參數值的測量結果及比較
對照組、輕度腎損害組及中重度腎損害組的腎皮質和髓質MD和MK值及組間比較結果見表1。三組的腎皮質MD值均明顯高于腎髓質,而腎髓質的MK值均高于腎皮質,差異均有統計學意義(P<0.05)。三組之間腎皮質和髓質的MD值的差異均有統計學意義(F=45.729,P<0.01;F=32.345,P<0.01);三組之間腎皮質和髓質的MK值的差異均有統計學意義(F=61.414,P<0.01;F=52.588,P<0.01)。進一步組間兩兩比較,對照組與輕度腎損害組之間,輕度腎損害組與中重度腎損害組之間,對照組與中重度腎損害組之間,腎皮質和髓質的MD和MK值的差異均有統計學意義(P<0.05)。

表1 各組受試者之間腎皮質和髓質MD和MK值的比較
3.DKI參數值與eGFR的相關性
CKD患者腎皮質和髓質的MD值均與eGFR呈中度正相關(r=0.684,P<0.01;r=0.451,P<0.01);CKD患者腎皮質和髓質的MK值均與eGFR呈高度負相關(r=-0.757,P<0.01;r=-0.719,P<0.01)。
4.DKI參數值的診斷效能
皮質和髓質的MD和MK值鑒別輕度與中重度腎損害組、輕度腎損害組與對照組的診斷效能指標值見表2。輕度與中重度腎損害組的鑒別:以皮質MK值的ROC下面積最大(0.907);皮質MD的截斷值為2.51×10-3mm2/s或皮質MK的截斷值為0.60時鑒別診斷的特異度最高,為95.5%;髓質MK的截斷值為0.65時鑒別診斷的敏感度最高,為80.8%。
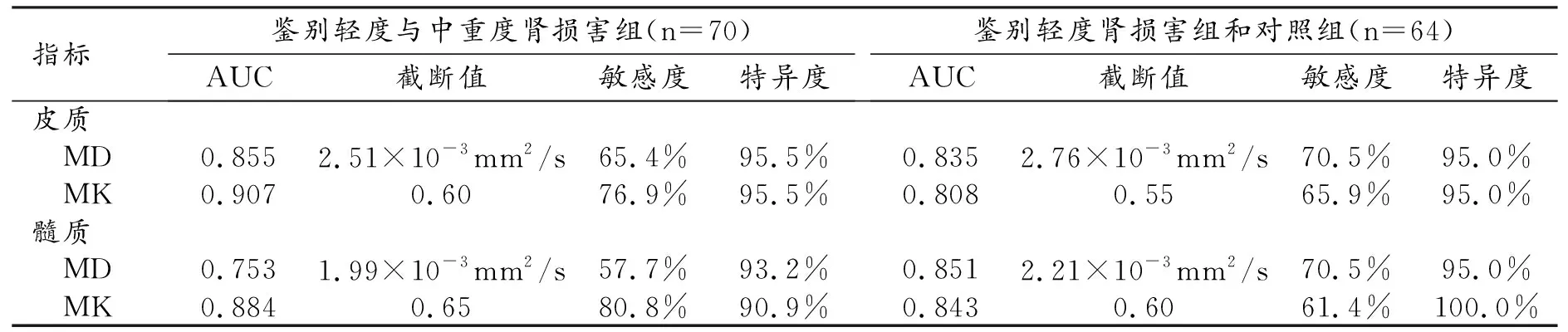
表2 DKI參數對腎功能損害的鑒別診斷效能
輕度腎損害組與對照組的鑒別:以髓質MD值的ROC下面積最大(0.851);當髓質MK值的截斷值為0.60時鑒別診斷的特異度最高,達100.0%;皮質MD的截斷值2.76×10-3mm2/s或髓質MD的截斷值為2.21×10-3mm2/s時鑒別診斷的敏感度最高,均為70.5%。
討 論
CKD患者腎臟的主要病理學改變為腎小管萎縮、腎小球硬化及間質纖維化等,這些病理學變化不僅可以降低腎臟的血流灌注和含水量,還會進一步導致細胞外間隙中水分子的擴散受限,使得腎組織中水分子的擴散運動受到影響[4]。DWI可以通過評估組織內水分子擴散受限的程度來間接反映組織微觀結構的改變[11]。DWI是基于體內水分子擴散運動呈高斯分布的假設,但實際上,組織微觀結構是復雜的,諸如細胞間隙、細胞膜和細胞器等結構會導致組織內水分子擴散運動偏離高斯分布的模式[6],而DKI以非高斯模型為基礎,能反映組織內水分子擴散運動偏離高斯分布的程度[12],從而能更準確地評估腎功能的改變。此外,有研究者認為當b<400 s/mm2時,DKI成像會受到體素內不相干運動效應的影響[13]。因此,本研究中我們采用的一組b值中除0 s/mm2之外,其它b值均大于400 s/mm2,從而盡量避免血流灌注對參數值測量的影響。
1.腎臟皮、髓質間DKI參數值的差異
腎臟皮質的血流灌注比腎髓質豐富,水分子擴散運動更為活躍,而且腎髓質內集合管和腎小管的排列具有顯著的方向性[14],結構比腎皮質更為復雜,腎髓質內管壁等多種因素會限制水分子的擴散運動,使得水分子擴散運動相對于高斯分布偏離地更明顯,因此理論上腎皮質的MD值大于腎髓質,而腎髓質的MK值大于腎皮質。本研究結果顯示,三組受試者的腎皮質MD值均高于腎髓質,而腎皮質的MK值低于腎髓質,差異均有統計學意義(P<0.01),本研究結果與既往的研究結果基本一致[15-16]。
2.CKD患者腎臟DKI參數值的變化
魏偉等[17]通過研究發現,糖尿病患者腎實質的MD值低于健康志愿者,而腎實質的MK值高于健康志愿者,差異均有統計學意義(P<0.05)。與此類似的是,我們的研究結果顯示輕度、中重度腎損害組腎皮質和髓質的MD值均明顯低于對照組,而MK值均明顯高于對照組,差異均有統計學意義(P<0.05)。CKD患者的上述表現可能是因為腎臟所發生的一系列病理學改變所致,包括腎間質纖維化、腎小球硬化和腎小管萎縮等,不僅導致腎臟的血流灌注和含水量減少[4],而且導致腎組織微觀結構更加復雜,限制水分子擴散運動的同時也使得擴散位移偏離高斯分布的程度更顯著。不僅如此,我們還發現,與輕度腎損害組相比,中重度腎損害組皮質和髓質的MD值明顯減低,而MK值明顯增高。Liu等[18]采用DKI評估IgA腎病腎功能時發現,中重度腎損害組腎皮質MK值明顯高于輕度腎損害組,而兩者腎皮質的MD值之間無明顯差異。之所以上述研究結果與本研究結果存在一定的差異,我們認為可能與樣本量大小、DKI參數的設置等因素有關。我們的研究在上述研究的基礎上,不僅擴大了CKD患者的樣本量,而且設置了對照組,同時測量了腎皮質和髓質的MD和MK值,得出的結果和結論應該更具有代表性。此外,Zhou等[15]采用DKI評估糖尿病腎病大鼠的研究發現,患有糖尿病腎病的大鼠腎皮髓質MK值明顯高于健康大鼠,而腎皮髓質MD值明顯低于健康大鼠。這與我們的研究結果類似。Li等[19]利用單側輸尿管結扎大鼠進行DKI評估腎纖維化的研究發現,隨著腎纖維化的進展,大鼠腎皮髓質的MD值會逐漸降低。綜合以上研究和我們研究的結果,似乎可以提示隨著腎功能的不斷衰退,水分子擴散運動的受限及擴散位移偏離高斯分布的程度會進一步加深,從而導致腎皮髓質MK值增高,MD值降低。
3.CKD腎臟eGFR與DKI參數值的關系
我們的研究發現CKD患者腎皮髓質MD值低于對照組,而腎皮髓質MK值高于對照組;并且輕度腎損害組與中重度腎損害組間腎皮髓質MD及MK值的差異均有統計學意義。Liu等[18]采用DKI評估IgA腎病腎功能時發現,腎皮質的MK值與eGFR呈高度負相關關系,與此類似的是,本研究結果顯示CKD患者腎皮質和髓質的MD值與eGFR呈中度正相關關系,腎皮質和髓質的MK值與eGFR呈高度負相關關系。這些結果提示腎臟DKI可以用于評估CKD患者的腎功能。
4.DKI參數評估腎功能損害程度的診斷效能
本研究結果顯示,鑒別輕度與中重度腎損害組,以腎皮質MK值的ROC下面積最大;而鑒別輕度腎損害組與對照組,以髓質MD值的ROC下面積最大。與本研究結果類似的是,Liu等[18]的研究結果亦顯示腎皮質MK值鑒別輕度與重度腎小球硬化的ROC下面積最大。而魏偉等[17]通過研究發現,腎實質MK值鑒別早期糖尿病腎病患者與健康志愿者的ROC下面積最大。我們認為可能是因為他們的研究測量的是腎實質的DKI參數值,未將腎皮質和髓質分開測量,從而導致研究結果與我們的結果間存在差異。綜上所述,我們的研究結果顯示DKI不僅可以用來診斷輕度腎損害(早期CKD)患者,還可以用于評估CKD的分期。
5.本研究的優勢和局限性
本研究的優勢有以下幾個方面:首先,組織微觀結構的復雜性(細胞間隙、細胞膜和細胞器等)會導致組織內水分子擴散運動呈非高斯分布的模式,而傳統的DWI技術是基于體內水分子擴散運動呈高斯分布的假設,所以本研究中采用的是DKI技術,較DWI能更準確地反映腎組織內水分子的擴散運動情況,本研究結果相比于以往的采用DWI評估慢性腎臟病的研究結果應該更準確[4,20-21];其次,本研究中采用的b值中除0 s/mm2之外,其它均大于400 s/mm2,從而盡量避免了血流灌注對參數值測量的影響,相對于其它腎臟DKI的研究[22],本研究中DKI參數的測量值應該更精確;最后,本研究中設置了健康對照組,相比于以往DKI評估腎臟病的研究[18],本研究的結論應該更具代表性和適用性。
當然,本研究也存在局限性:首先,本研究缺少CKD患者腎臟穿刺活檢的病理結果,未能研究DKI評估CKD病理分型的價值;其次,本研究的樣本量不足,未能將CKD患者按1~5期進行分組研究。
綜上所述,DKI可以為CKD腎功能的評估提供有價值的信息。

