磷酸鹽和鈣的添加對Bacillus C075礦化重金屬Pb的影響
湯 鼎, 王 暉, 姜 毅, 趙興青
常州大學環境與安全工程學院, 江蘇 常州 213164
鉛(Pb)因具有熔點低、延展性好、耐蝕性強等獨特性能,已被廣泛用于鉛汽油、汽車、鉛酸電池等領域中[1]. 同時由于人類活動的增加,如采礦、電池制造、汽油消耗以及有色金屬的開采等,在過去5年中,全球有超過80×104t的Pb被釋放到環境中[2-3]. 重金屬Pb具有難降解性和長期持久性,可通過食物鏈對人類的生理健康造成嚴重威脅[4]. 人體中的痕量Pb會損害器官、智力、骨骼發育、腎臟以及神經系統等功能[5-7],因此Pb污染的治理迫在眉睫. 目前土壤中修復Pb的途徑主要有物理法、化學法和生物法. 但是傳統的物理化學方法(如化學沉淀、離子交換和吸附等)都有其局限性,包括去除率低、成本高、操作復雜、對土壤結構和理化性質造成影響以及產生其他有毒物質等[8-9]. 微生物因其生物選擇性好、無毒和無二次污染等特點引起了人們的廣泛關注,被認為是一種成本低、前景好的新技術[10-12].
在生物修復技術中,微生物誘導的P礦化是一種新型土壤修復方法. 在P礦化過程中,通過添加P,微生物產生的代謝產物(如磷酸酶)可以增加P的利用率,然后介導有毒離子礦化[13-15]. 通過P(如磷粉或磷灰石)對土壤進行處理后可以增強焦晶石〔Pyro[Pb5(PO4)3X (X為Cl、F、OH)]〕的形成,并且該礦化物的溶解度(Ksp,10-85~10-60)極低,因此以焦晶石形式存在的Pb對環境的危害極低,在土壤修復礦化方面極為有利[16-17].
近年來,國內外在微生物礦化重金屬方面開展了一系列研究. Macaskie等[18]發現革蘭氏陰性菌Citrobactersp.可通過磷酸化產生大量磷酸氫根離子,并在細胞表面形成礦物質以從溶液中去除重金屬鎘(Cd),其去除率可達到65%. Jin等[19]發現進行P增溶處理的Enterobactersp.可通過將Pb固定為不溶性的磷酸鉛礦物質來抵抗Pb. Ryan等[20]用羥基磷灰石對土壤進行改良,孵育240 d后通過擴展的X射線吸收精細結構(EXAFS)的光譜發現,土壤中Pb的平均局部分子鍵和環境發生變化,并顯示出化學提取物與焦晶石的高度相似性,表明P的加入可將土壤中的Pb轉化為焦晶石. 然而,目前關于利用微生物礦化處理重金屬Pb污染的研究大多集中在通過微生物本身處理Pb污染方面,并且處理效率低且修復過程緩慢,而忽視了加入其他物質(如P和Ca)提高修復效率的可能性.
因此,進一步探討提高微生物修復土壤中Pb的效率具有重要的現實意義. 在利用微生物修復重金屬Pb的過程中,加入P可以有效提高其對Pb的礦化效率. 在Pb污染的土壤中同時加入P和Ca可以進一步促進Pb有效性的降低,原因可能是降低了重金屬對微生物的毒害作用,以及形成了某種新的礦化物并且增加了更多吸附位點,進而降低了土壤中Pb的有效性[21].
該研究利用從安徽銅陵獅子山礦區周邊重金屬污染土壤中篩選出的一株對Pb耐受的菌株BacillusC075,在進行微生物礦化重金屬的試驗中加入P和Ca,研究P和Ca對微生物和重金屬Pb礦化率的影響. 通過添加P和Ca分析微生物礦化重金屬Pb的最佳c(Ca2+),通過動力學曲線、FT-IR和XRD分析酶和官能團對菌株礦化Pb的影響以及礦化物的主要成分,根據SEM-EDS和BET分析菌株和礦化物的形貌結構以及礦化過程中菌株表面產生的變化,進而深入了解P和Ca在微生物礦化Pb的過程中作用及其重要性,以期為更加有效去除土壤中的重金屬Pb提供依據.
1 材料與方法
1.1 菌株篩選及培養
選用菌株是從安徽銅陵獅子山礦區周圍重金屬污染土壤中分離出來的一株耐Pb芽孢桿菌,其編號為BacillusC075 (GenBank登錄號為MK907784). 將該菌株接種到LB培養基(魚粉蛋白胨濃度為10 g/L,NaCl濃度為5 g/L,酵母浸膏濃度為5 g/L)中,并置于37 ℃、170 r/min的恒溫搖床中培養.
1.2 P和Ca的添加對細菌生長的影響
一般情況下,BacillusC075能將Pb礦化成礦化物沉淀Pb5(PO4)3OH,由該礦化物的化學分子式可知,Pb和P的分子比為5∶3,在該礦化試驗中所用母液為c〔Pb(NO3)2〕=10 mmol/L和c〔Ca(NO3)2〕=100 mmol/L的溶液,分析P對微生物的影響試驗中所用母液是c(KH2PO4)為6 mmol/L和c〔Ca(NO3)2〕分別為10、50、100、200、500 mmol/L的溶液. 將試驗分為2組,每組均設置3個平行試驗. 在2組含有pH為7.0的75 mL LB培養基中分別加入KH2PO4溶液10 mL〔c(P)為0.6 mmol/L〕和無菌水10 mL,最后均加入OD600=1.0 nm的菌株溶液5 mL. 將樣品置于37 ℃、170 r/min的恒溫搖床中振蕩培養24 h,并每隔3 h取1 mL菌液用分光光度計測其OD600值,以此確定P對菌株生長的影響.
為了探討不同c(Ca2+)下細菌的生長情況,在含有pH為7.0的75 mL LB培養基中分別加入KH2PO4和Ca(NO3)2溶液10 mL,設置體系c(P)為0.6 mmol/L,c〔Ca(NO3)2〕分別為0、1、5、10、20、50 mmol/L,且在每組錐形瓶中接種OD600=1.0 nm的菌株溶液5 mL,無菌水定容至100 mL(每組均設置3個平行試驗). 將樣品于37 ℃、170 r/min的恒溫搖床中培養24 h,并每隔3 h取一次樣,用紫外分光光度計測其OD600值,通過c(Ca2+)對細菌生長的影響情況確定最佳的c(Ca2+).
1.3 Ca的添加對細菌耐受性的影響
基于1.2節的試驗數據,設置體系c(Ca2+)為10 mmol/L. 將試驗分為3組(每組試驗3個重復),加菌組中每錐形瓶含有65 mL LB培養基均加入OD600=1.0的菌株溶液5 mL,菌+Pb組加入Pb(NO3)2溶液10 mL〔c(Pb2+)為1 mmol/L〕,菌+Pb+Ca組加入Pb(NO3)2溶液10 mL〔c(Pb2+)為1 mmol/L〕和Ca(NO3)2溶液10 mL〔c(Ca2+)為10 mmol/L〕,所有反應組用無菌水定容至100 mL. 將3組樣品置于37 ℃、170 r/min的恒溫搖床中培養24 h,每隔2 h取一次樣,用紫外分光光度計測其OD600值,通過菌株的生長量確定Ca添加對細菌Pb耐受性的影響.
1.4 P和Ca的添加對Pb2+礦化的影響
將礦化試驗分為4組(每組試驗3個重復),加菌組中每錐形瓶含有65 mL LB培養基均加入OD600=1.0的菌株溶液5 mL和Pb(NO3)2溶液10 mL〔c(Pb2+)為1 mmol/L〕,菌+Pb+P組加入KH2PO4溶液10 mL〔c(P)為0.6 mmol/L〕,菌+Pb+P+Ca組加入KH2PO4溶液10 mL〔c(P)為0.6 mmol/L〕和Ca(NO3)2溶液10 mL〔c(Ca2+)為10 mmol/L〕,空白對照組為不接菌的Pb(NO3)2溶液+LB體系,所有反應組均用無菌水定容至100mL. 將這4組樣品置于搖床中,在37 ℃、170 r/min下振蕩培養24 h,觀察其沉淀情況,離心后取其上清液,用火焰原子吸收光譜法測其Pb2+的濃度.
1.5 菌株礦化Pb的動力學曲線
配制c(Pb2+)分別為10、20、50、100、200 mg/L的重金屬溶液,調節pH為7.0,分別向其中加入5 mL的菌液,在37 ℃下水浴加熱. 反應2 h后測定上清液中殘留的c(Pb2+),計算反應初速率V0,繪制1/V0-1/c(Pb2+)曲線,并計算最大酶促反應速率(Vmax)和米氏常數(Km)[22].
1.6 FT-IR及XRD分析
將干燥的樣品研磨后,以樣品與溴化鉀(光譜純)以體積比1∶100混合進行壓片,在10 t/cm2下靜壓2 min. 采用Perkin-Elmer-Spectrum One型傅里葉變換紅外光譜儀(Nicolt A vatar 370,美國尼高力儀器公司)收集波長范圍為 4 000~500 cm-1處的紅外光譜數據,且其掃描準確度為4 cm-1[23].
利用D-MAX2500型X-射線衍射儀(XRD,日本理學株式會社)對沉淀物的礦物成分進行測定. 制樣方法同上,樣品充分干燥后研磨至300目(48 μm),即可上機測定. 試驗條件:電壓40 kV,管電流100 mA,CuKα=1.540 56 ?,掃描角度(2θ)為5°~80°,誤差小于0.02°,在0.02°/(0.2 s)條件下收集數據[24]. 所得結果用MDI Jade 5和Origin 8.0分析軟件進行編輯處理.
1.7 SEM-EDS和BET分析
采用將離心(8 000 r/min,5 min)收集到的沉淀物先用2.5%戊二醛固定液固定1.5 h,離心后的沉淀再用乙醇按30%、50%、70%、90%、100%的梯度分別脫水15~20 min,將干燥后的樣品研磨后噴金后即可上機. 試驗用樣品在穩定電壓15 kV的條件下,利用JSM-6360 LA型掃描電子顯微鏡&能譜儀(SEM & EDS,日本電子株式會社)對礦物沉淀的結構形態進行觀察,并且利用EDS對礦物沉淀成分進行詳細的元素分析. 最后再利用介孔材料比表面積及孔徑分析儀(BET ASAP2020,美國康塔儀器公司)對礦化物的比表面積、孔徑和吸附能力進行分析.
2 結果與討論
2.1 P和Ca的添加對細菌生長的影響
P和Ca的添加對BacillusC075的影響如圖1所示. 圖1(a)表明,有、無P添加對BacillusC075的生長過程以及進入對數期的時間基本一致,其生長量變化也極小,進一步證明當添加c(P)為0.6 mmol/L時對BacillusC075的生長有一定促進作用. 李文飛等[25]以枯草芽孢桿菌(Bacillussubtilis)為培養對象,并通過在培養基中不添加P和添加P來分析P對菌株生長的影響,結果是添加P的菌株具有更大的生長直徑和更高的OD值. 這說明P對菌株生長沒有抑制作用,與試驗結果一致.

圖1 P和Ca添加對Bacillus C075菌株生長的影響Fig.1 The effect of P and Ca addition on strain Bacillus C075
由圖1(b)可見,添加c〔Ca(NO3)2〕為0、1、5、10、20、50 mmol/L的一系列試驗中培養的細菌生長過程趨勢一致,但是加Ca組的細菌進入對數期的時間比不加Ca組的要短,并快速進行分裂繁殖,當達到穩定期時,加Ca組比不加Ca組的OD600值要高. 從圖1(b)也可以看出,在一定濃度范圍內,隨著c(Ca2+)增加,細菌濃度也隨之增加,且在c(Ca2+)為10 mmol/L時細菌濃度最高,但是當c(Ca2+)繼續增至50 mmol/L時,Ca2+對細菌生長存在明顯的抑制效果. Zhao等[26]發現,添加Ca2+可以有效降低重金屬對Bacillussp. T124的毒害作用,從而使得菌株活性增加,這是因為Ca2+能夠結合部分重金屬從而降低重金屬在環境中的濃度. Bhattacharya等[27]發現,加入Ca2+后,粘液鏈球菌(Streptococcusmarcescens)和陰溝腸桿菌EMB19(EnterobactercloacaeEMB19)的活性明顯提高,并且對重金屬的去除率更高. 王新花等[28]利用施氏假單胞菌(Pseudomonasstutzeri)誘導碳酸鈣共沉淀對Pb進行修復試驗,發現細菌生長量會隨著c(Ca2+)的提高表現為先增后減,表明存在一個最佳Ca2+投加量. 在各種濃度Cd2+脅迫下,添加一定量的Ca2+能促進幼苗生長,當c(Ca2+)為10 mmol/L時,菌株生長量最高,表明Ca2+和K+對Cd2+的脅迫作用存在最佳濃度效應[29]. 因此后續試驗中加Ca組菌株能維持較高OD600,這樣有利于保持高濃度的菌株并維持反應持續進行.
2.2 Ca的添加對細菌耐受性的影響
由2.1節試驗結果可知,P的添加對BacillusC075的生長有促進作用但并不顯著,因此該部分著重討論Ca2+對細菌耐受性的影響. 由圖2可見,加入Pb后菌株生長量與不加Pb對比有明顯降低,表明Pb對菌株生長有明顯的抑制作用;加Ca組中菌株生長量有所提高,對Pb2+的耐受性有所增強. 由Ca2+對細菌生長量的影響結果可知,一定濃度的Ca2+能最大程度地提高細菌生長量,增強菌株對Pb的耐受性. 究其原因:一方面是由于Ca的添加能促進細菌分裂,提高細菌生長速率;另一方面,Ca2+與Pb2+會發生螯合作用生成共沉淀物,從而降低了c(Pb2+),使Pb對菌株生長的抑制作用有所減弱,從而增強了細菌對Pb的耐受性[30-31]. 田晶晶等[32]發現在37 ℃下,添加6%的碳酸鈣能有效改善環境的pH,極大促進芽孢桿菌CGMCC 9951(BacilluscoagulansCGMCC 9951)生長,從而提高對重金屬的耐受性. 添加Ca2+極有可能使得Ca2+與Pb2+進行鰲合生成共沉淀物,從而降低Pb的毒性,提高細菌的耐受性.

圖2 Ca添加對Bacillus C075菌株耐受Pb的影響Fig.2 The effect of Ca addition on strain Bacillus C075 tolerance to Pb
2.3 P和Ca的添加對Pb2+礦化率的影響
相關研究表明,含磷物質的添加可以降低土壤中Pb的有效性,磷化合物是通過形成穩定Pb-P礦物質來降低Pb的遷移性[15]. 微生物對重金屬的礦化作用可降低重金屬的遷移能力和生物有效性,是其可應用于重金屬污染修復的重要原因之一[33]. P的添加對BacillusC075礦化重金屬Pb的影響結果如圖3所示. 從不接菌的對照試驗中可以看出,隨著時間的延長,Pb的去除率變化不大. 對于加菌組,比較P添加對礦化的影響時發現,P添加后菌株對重金屬Pb的礦化率有一定程度的提高,其去除量由72 mg/L增至89 mg/L,增加了23.6%. 這表明菌株通過自身的酶、官能團或是其他方式降低了環境中Pb的含量及其生物可利用性,菌株能通過酶化作用降解培養基中的底物,使得溶液中c(PO43-)增加,然后Pb2+會在酶的作用下與PO43-生成Pb5(PO4)3OH沉淀. 在此礦化過程中,細胞外聚合物和細胞壁提供吸附位點[34-35]. 由圖1(a)可見,P的添加對細菌生長的影響幾乎可以忽略,但P的添加直接增加了反應體系中的PO43-,確保菌株在Pb2+礦化過程中有足夠的PO43-,從而進一步提高了Pb2+的礦化率. Zhang等[36]也得到了類似結果,他們在BacillusZKJ對Pb2+的礦化試驗過程中發現,細菌在代謝過程中會將有機磷轉化為磷酸根,隨著溶液中PO43-濃度的不斷增加,細胞外聚合物會與Pb2+立即螯合. Teng等[37]的研究同樣發現,LeclerciaadecarboxylataL1-5在200 mg/L的P溶液中將Pb2+礦化為Pb5(PO4)3OH. 在Pb生物礦化過程中,細菌細胞充當成核位點,以支持Pb5(PO4)3OH晶體生成,這可進一步提高Pb2+去除率,并且使礦化產物更穩定、更致密[36].
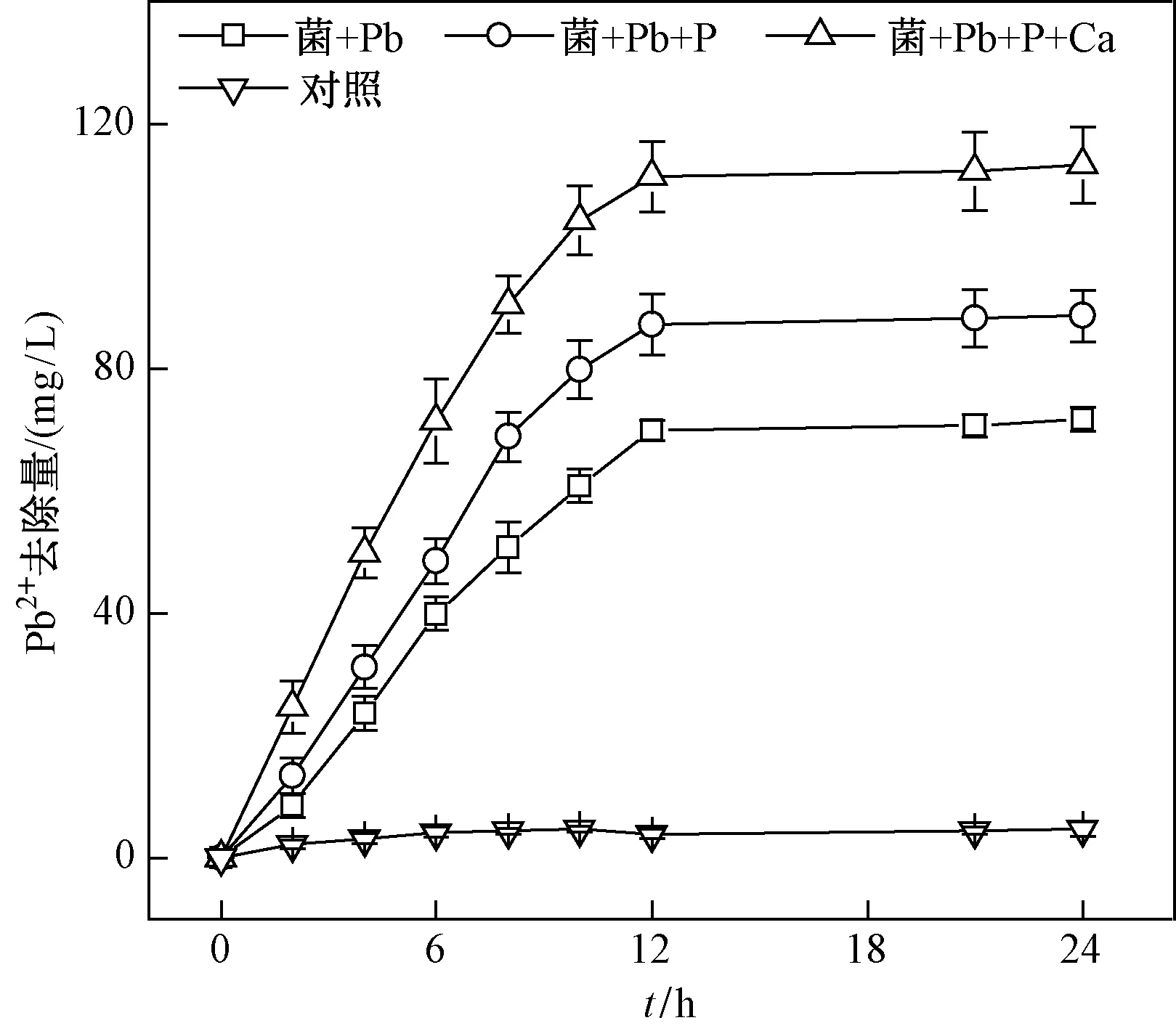
圖3 P和Ca添加對Bacillus C075菌株礦化Pb2+的影響Fig.3 The influence of P and Ca addition on the mineralization of Pb2+ by strain Bacillus C075
礦化過程中,Ca的添加對BacillusC075的生長繁殖和耐受性均有一定影響,進而影響了菌株對Pb2+的礦化率. 加Ca前后BacillusC075對Pb2+去除率的影響如圖3所示,其去除率均隨著時間的增加而提高,反應12 h后趨于穩定,去除量從89 mg/L提高到113 mg/L,同比增加了26.9%,去除率增加了56.9%. 并且與未加Ca的兩組對照相比,加Ca后BacillusC075對Pb2+的去除率在0~12 h內快速上升. 由圖1(b)可見,Ca的添加提高了菌株的生物活性,加Ca后的菌株具有較快的分裂能力,在一定程度上縮短了細菌進入對數期的時間,細菌得以快速繁殖,進而使得加Ca后的BacillusC075對Pb2+的去除量最大且最先達到平衡狀態. Tu等[38]在利用Bacillussp. dwc-2去除鈾(U)時發現,隨著接種系統中孵育時間的增加,鈾的去除率也在增加,表明微生物活性在生物礦化中起著重要作用. 一些陰離子的存在也會影響生物礦化效率,如Wei等[39]發現,NH4+能促進P相關礦化物的形成,而CO32-的存在則會降低礦化效率. Ca的添加能有效降低環境中的CO32-,而生成的碳酸鈣反而會促進菌株生長,加速了礦化過程. Qian等[40]使用真菌PenicilliumchrysogenumCS1進一步探討了加Ca后的菌株對重金屬Cr和Pb的去除影響,觀察到土壤中有更多可交換態重金屬離子與碳酸鹽結合. 土壤中可交換Cr的比例由41.60%降至1.95%,可交換Pb的比例由41.27%降至2.19%,這表明Ca的添加能進一步促進菌株對重金屬的礦化率[40]. 由此可見,加入一定濃度的Ca2+會提高BacillusC075對Pb2+的礦化率,進一步證明了Ca2+在其礦化過程中的作用.
2.4 菌株礦化Pb2+的動力學分析
為探究BacillusC075礦化過程中的磷酸酶活性和礦化反應程度,測定不同Pb2+初始濃度下菌株的反應速率V0,繪制菌株礦化Pb2+的動力學曲線(見圖4).
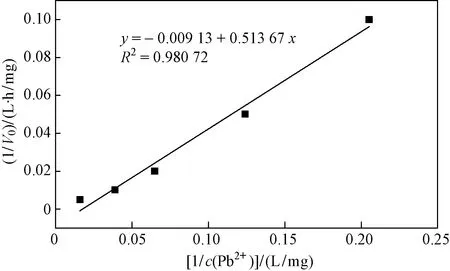
圖4 Bacillus C075菌株礦化Pb2+的動力學曲線Fig.4 Kinetic curve of strain Bacillus C075 mineralized Pb2+
根據中間復合物學說,酶促反應分兩步進行:第一步底物S與酶E形成中間復合物ES;第二步ES復合物分解形成產物,釋放出游離酶,Michaelis等[41]據此推導出米氏方程. 米氏方程表示底物濃度與酶反應速率之間的定量關系:
V=Vmax[S]/(Km+[S])
(1)
式中:V為瞬時速率,mg/(h·g);[S]為底物濃度,mg/L;Vmax為最大酶促反應速率,mg/(h·g);Km為米氏常數.
當底物濃度很低時,反應速度隨底物濃度的增加而上升,而當底物濃度很高時,所有的酶被飽和,酶促反應速率達到最大,即Vmax.Km為酶的特性常數,僅與酶的性質有關,與酶濃度無關,Km越小,表示菌株與磷酸酶的親和力越強,越有利于反應[41]. 從曲線擬合得到解析式y=-0.009 13+0.513 67x,計算得出Vmax=1/0.009 13=109.53 mg/(h·g),Pb的相對原子質量為207.2,故Km=0.513 67×1 000/(0.009 13×207.2)=271.53 μmol/L.BacillussphaericusAND 303的Km為158.12 μmol/L,與所用菌株數值差異不顯著,這表明細菌與磷酸酶的親和力較強,更有利于礦化反應的進行[42]. 隨著c(Pb2+)的增加,酶促反應速率不斷增大,這是由于底物濃度的增加為菌株提供了更多的酶反應對象,從而促進了反應進行,為反應提供了更大的反應初速率V0. 這表明隨著重金屬濃度的增加,菌株的初始反應速率并未受到影響,這一方面排除了底物濃度對菌株礦化重金屬Pb的影響;另一方面表明,可能是由于其他方面的影響(如生長量、官能團和吸附位點等)導致隨著重金屬濃度持續增加,菌株的礦化能力有所降低. Teng等[37]在研究P增溶性細菌固定Pb時發現,磷酸酶活性和礦化反應呈正相關,磷酸酶活性可作為礦化反應的良好指標. Wei等[39]利用Bacillusthuringiensis016對UO22+進行固定化研究,發現和缺乏酶的細胞碎片相比,完整細胞對UO22+具有更好的生物礦化能力. 這說明酶活性會影響菌株對重金屬的礦化作用.
2.5 礦化物的FT-IR及XRD分析


圖5 P和Ca添加前后礦化物的FT-IR和XRD圖譜Fig.5 FT-IR and XRD patterns of the mineralization before and after P and Ca addition
為了進一步確定礦化物的組成,采用XRD對其進行定性分析,結果如圖5(b)所示. 在未加P和Ca的樣品圖譜中出現了一個較強且窄的衍射峰,通過與PDF標準卡(PDF#08-0259)比較,發現二者相似度很高,所以可以確定生成的礦化物是Pb5(PO4)3OH. 由圖5(b)可見,P的添加未改變礦化產物種類,但添加P后樣品圖譜中的衍射峰峰值更高、更尖銳,表明加P后礦化物的結晶度較未加P的樣品更好. 由此可知,P的添加雖然不會對礦化物種類產生影響,但提高了礦化物的結晶度和純度,使礦化物更穩定. Zhao等[46]對Phanerochaetechrysoporium礦化Pb2+的礦化產物進行XRD分析,結果表明礦化產物同樣為Pb5(PO4)3OH. Zhang等[36]利用溶磷菌對Pb2+進行礦化,XRD結果顯示,溶磷菌礦化Pb2+的產物為Pb3(PO4)2或Pb5(PO4)3OH 沉淀. 他們的結果與筆者試驗所得結論相一致. 當同時添加P和Ca時,Ca的加入使得礦化物類型發生了改變,Pb2+替換了羥基磷酸鈣中Ca2+的晶格[47],從而形成了Ca2Pb8(PO4)6(OH)2. 這與Chen等[13]的研究結果類似,他們利用Bacilluscereus12-2探討其對Pb2+的礦化機制,發現在該細菌誘導的Pb2+生物礦化過程中,Ca不僅作為細菌細胞的必要成分,同時也可進一步用于形成結晶礦物——Ca2.5Pb7.5(PO4)6(OH)2. Govarthanan等[48]在研究Baciliussp.KK1對尾礦中Pb的生物礦化的意義時指出,重金屬離子以替代Ca2+的晶格的形式形成新的沉淀,從而提高礦化效率.
2.6 礦化物的SEM和EDS以及BET分析
細菌活動中的礦化過程能控制礦化物的成核和生長[11,49],外界環境變化也會對礦化物種類產生影響. 對加P和Ca后的樣品進行SEM分析,以便觀察礦化物的分布情況. 由圖6可見,未加P和Ca的空白試驗組的礦化物沉淀以顆粒狀團聚,粒徑大小不一,顆粒間結合比較緊密,團聚狀態十分良好. P和Ca的添加使得芽孢桿菌表面附著的沉淀物明顯增多,并且礦化物的產品更穩定、更致密. 這也進一步證明了P和Ca的添加能提高BacillusC075對Pb2+的礦化率. Zhang等[36]在利用BacillusZKJ礦化去除Pb時發現,將細菌接種到含P培養基中能進一步提高去除率,并使得礦化產物更加穩定和致密.

圖6 P和Ca添加前后礦化物的SEM和EDS圖譜Fig.6 SEM and EDS spectra of mineralization before and after P and Ca addition
為進一步得到沉淀物的元素組成,分別對P和Ca添加前后的樣品進行EDS能譜分析. 由圖6可見,在未加Ca的條件下,加P前后沉淀物的EDS能譜發生了變化,P峰和Pb峰的強度明顯增強,表明P的添加會促進菌株對Pb2+的吸附. 此外,加Ca后礦化物的EDS譜圖中Ca峰和P峰有很大程度的增強. 這可歸因于Ca的添加促進了細胞生長以及菌株對PO43-的利用率,從而進一步提高了對Pb2+的去除效果. 由EDS和XRD譜圖可知,加Ca前后的礦化物由Pb5(PO4)3OH轉變為Ca2Pb8(PO4)6(OH)2,表明Ca的添加改變了BacillusC075礦化Pb2+的產物類型. 而周吉峙等[50]發現,Ca2Pb8(PO4)6(OH)2擁有更好的化學穩定性和熱穩定性,在400 ℃下仍然不會被分解.
為探究BacillusC075礦化過程中菌株表面的剩余吸附面積和吸附位點的變化,分別對P和Ca添加前后的樣品進行BET分析. 由圖7(a)可見,等溫線呈下降趨勢,在較低相對壓力下其N2吸附量幾乎為0(圖中呈現為負值),在飽和蒸氣壓下驟然升至18.02 cm3/g,其比表面積為 0.760 4 m2/g,孔容為0 cm3/g. 這表明菌株表面已經沒有吸附位點,吸附能力達到飽和狀態,吸附受到限制[51]. 由圖7(b)可見,加入P后的礦化物的等溫線與未加P和Ca的礦化物的等溫線類似,但是在較低相對氣壓下N2吸附量呈上升趨勢且為正值,在飽和氣壓下升至26.78 cm3/g,比表面積為13.088 0 m2/g,孔容為 0.001 460 cm3/g. 這表明在加入P之后,菌株有更大的吸附面積和更多的吸附位點,吸附能力顯著提高. 由圖7(c)可見,加入P和Ca后的礦化物的等溫線出現明顯變化,在較低相對壓力下吸附量呈升高趨勢,且一直增加至飽和蒸氣壓下的最大值27.80 cm3/g,其比表面積為 8.501 6 m2/g,孔容為 0.002 957 cm3/g. 這表明在加入Ca以后,雖然吸附面積減少了,但是吸附點位增加了,使得整體的吸附能力提高. 而在加入P和Ca后礦化物的等溫線中間段出現了吸附回滯帶,表明菌株表面存在毛細凝聚體系. 中孔毛細凝聚填滿后,菌株表面還有大孔徑的孔或者吸附質分子相互作用較強,可能吸附形成多分子層,吸附等溫線繼續上升直至出現吸附終止平臺,停止吸附[51]. 總而言之,加入P組的吸附效果優于不加P組,而加入P和Ca的吸附效果最佳.

圖7 P和Ca添加前后礦化物的BET圖Fig.7 BET spectra of mineralization before and after P and Ca addition
3 結論
a) P的添加對BacillusC075的生長有一定促進作用,但并不顯著,但Ca2+能顯著促進細菌的生長,并且增強了細菌對Pb2+的耐受性. 添加的最佳c(Ca2+)為10 mmol/L.
b) 在加入P和Ca后,BacillusC075對Pb2+的去除率有顯著提升,加入P后的去除量與不加P相比提高了23.6%,而同時加入P和Ca后的去除量與不加P相比則提高了56.9%.
c) 在加入P后,BacillusC075能將Pb2+誘導礦化生成Pb5(PO4)3OH,P的添加增加了菌株表面吸附面積和吸附位點,提高了礦化率,并未影響礦化物的種類. 同時添加P和Ca后不僅顯著提高了菌株對Pb2+的礦化率,還最大程度地利用了外加的Ca,進而改變了礦化物的種類,生成了Pb5(PO4)3OH和Ca2Pb8(PO4)6(OH)2,Ca2Pb8(PO4)6(OH)2擁有更好的穩定性. 因此,P和Ca的添加在微生物修復重金屬污染方面具有較為廣闊的應用前景.

