腸道菌群的環(huán)境毒理學(xué)研究:現(xiàn)狀與展望
劉月月, 王 琛, 趙曉麗, 吳豐昌, 白英臣, 滕苗苗, 汪 霞, 時(shí) 迪
中國(guó)環(huán)境科學(xué)研究院, 環(huán)境基準(zhǔn)與風(fēng)險(xiǎn)評(píng)估國(guó)家重點(diǎn)實(shí)驗(yàn)室, 北京 100012
腸道菌群是寄居在宿主腸道中微生物群落的總稱(chēng),其與宿主互利共生,可以通過(guò)菌體的自身成分、代謝物、衍生物等調(diào)節(jié)腸道局部免疫平衡,參與機(jī)體免疫微環(huán)境的塑造,幫助宿主完成多種生理生化功能[1]. 越來(lái)越多的流行病學(xué)與毒理學(xué)研究表明,腸道菌群紊亂和失衡與多種人類(lèi)非傳染性疾病(non-communicable diseases, NCDs)密切相關(guān). 腸道菌群異常(如多樣性降低、特定成員和功能改變等)可能參與糖尿病[2]、非酒精性脂肪肝[3]、炎癥性腸病[4]、自身免疫性關(guān)節(jié)炎[5]、肥胖癥[6]、哮喘等[7]等多種疾病的發(fā)生. 此外,短鏈脂肪酸、脂多糖、次級(jí)膽汁酸等腸道菌群的代謝產(chǎn)物和衍生物,也能與宿主的一些生理途徑相互作用,并通過(guò)“腦—腸—腸道菌群軸”誘發(fā)自閉癥[8]、代謝綜合征[9]、老年癡呆癥[10]等疾病.
隨著現(xiàn)代社會(huì)的快速發(fā)展,化學(xué)物質(zhì)的制造量和使用量日益增長(zhǎng),這些物質(zhì)會(huì)釋放到環(huán)境中,通過(guò)多種環(huán)境介質(zhì)及食物鏈對(duì)人類(lèi)和動(dòng)物健康產(chǎn)生影響,其中經(jīng)口暴露是絕大部分污染物產(chǎn)生毒害效應(yīng)的暴露途徑[11]. 腸道菌群與宿主的胃腸消化系統(tǒng)是人類(lèi)及眾多環(huán)境生物抵御外源污染物侵襲的第一層屏障. 研究[12-13]證實(shí),腸道菌群易受飲食和抗生素等外源因素的影響,且對(duì)環(huán)境污染物表現(xiàn)出極高的敏感性. 環(huán)境污染物的暴露可以改變腸道菌群的豐度和多樣性,進(jìn)而誘導(dǎo)與菌群失調(diào)相關(guān)的毒理學(xué)癥狀,最終影響宿主健康. 污染物可以通過(guò)動(dòng)物的“腦—腸—腸道菌群軸”系統(tǒng)雙向調(diào)節(jié)機(jī)制,以菌群代謝產(chǎn)物和衍生物為“信使”,影響內(nèi)分泌、神經(jīng)系統(tǒng)的組成和宿主行為. 由于腸道菌群的敏感性及對(duì)宿主多種全身性生理功能發(fā)育的重要影響,研究污染物對(duì)腸道菌群及宿主健康的交互作用已經(jīng)成為環(huán)境毒理學(xué)領(lǐng)域的新興熱點(diǎn).
鑒于微生物菌群的重要作用,目前以美國(guó)、日本、加拿大和歐盟為代表的發(fā)達(dá)國(guó)家和地區(qū),在共同完成“人類(lèi)基因組計(jì)劃”(2000年)之后,又戰(zhàn)略部署了一系列支持微生物組相關(guān)的研究計(jì)劃[14](見(jiàn)圖1). 2006年中國(guó)與法國(guó)啟動(dòng)了“中法人體腸道元基因組”合作,隨著歐洲其他國(guó)家的加入,該合作已上升為中歐人類(lèi)微生物組合作[15]. 這些研究計(jì)劃能深度解讀微生物群和疾病之間的關(guān)聯(lián),為探索環(huán)境污染物對(duì)腸道菌群產(chǎn)生的毒性效應(yīng)提供基礎(chǔ).
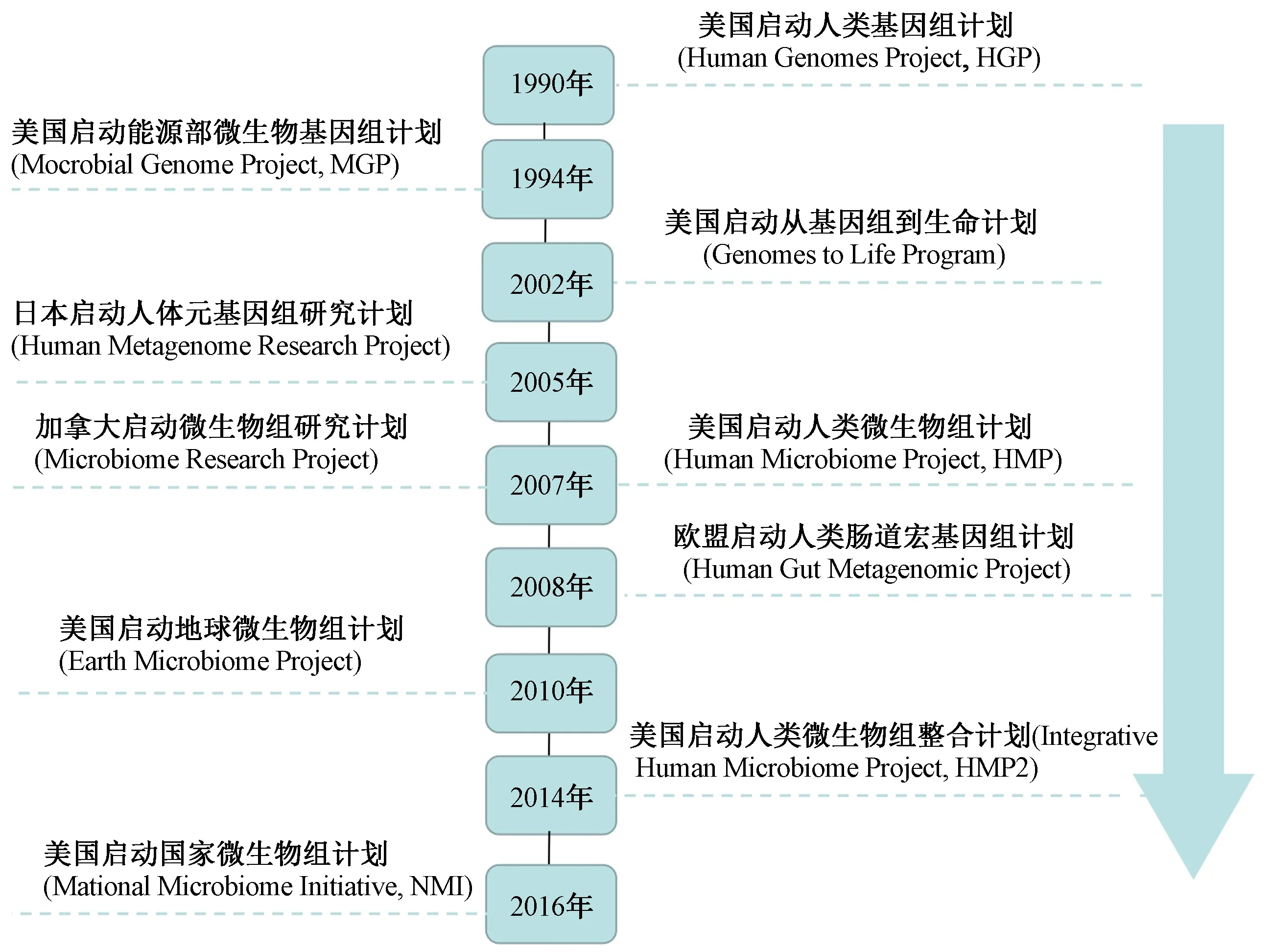
圖1 國(guó)際上與微生物組相關(guān)的研究計(jì)劃Fig.1 International research projects related to the microbiome
該文在簡(jiǎn)述目前腸道菌群研究方法和環(huán)境毒理學(xué)進(jìn)展的基礎(chǔ)上,從組織學(xué)、病理學(xué)、生理學(xué)等角度系統(tǒng)歸納了近年來(lái)關(guān)于環(huán)境污染物對(duì)腸道菌群的干擾作用,總結(jié)了近年來(lái)環(huán)境污染物對(duì)腸道菌群多樣性和豐富度的影響以及腸道菌群與宿主健康互作機(jī)制. 并對(duì)腸道菌群毒理學(xué)研究中存在的問(wèn)題和研究方向進(jìn)行了探討與展望,以期對(duì)環(huán)境污染物的新型致毒機(jī)理研究和環(huán)境風(fēng)險(xiǎn)評(píng)價(jià)提供一定參考.
1 腸道菌群的研究方法
歷史上對(duì)微生物組的探索主要限于對(duì)致病性菌群的選擇性培養(yǎng),而多數(shù)菌群因?yàn)榉侵虏⌒浴⒎N群含量低和培養(yǎng)條件難度大等原因,所受關(guān)注較少. 近年來(lái),分析微生物組的方法和標(biāo)準(zhǔn)獲得快速發(fā)展,新興技術(shù)的發(fā)展和應(yīng)用使得人們可以更加全面地確定腸道菌群的組成,解析菌群的結(jié)構(gòu)和功能. 這使得探索環(huán)境污染物與腸道菌群潛在的因果關(guān)系、研究相關(guān)微生物介導(dǎo)的疾病發(fā)生機(jī)制成為可能[16-17]. 常用的微生物組分析技術(shù)如表1所示,目前高通量測(cè)序方法已成為研究環(huán)境污染物對(duì)腸道菌群影響中最普遍的技術(shù)手段.

表1 腸道菌群的研究方法歸納
2 環(huán)境污染物對(duì)腸道菌群的干擾作用及機(jī)制
2.1 環(huán)境污染物對(duì)腸道菌群的干擾作用
醫(yī)用藥物的過(guò)度使用以及農(nóng)藥殘留、重金屬污染、持久性有機(jī)污染物、新污染物污染等產(chǎn)生的生態(tài)和健康危害已經(jīng)引起世界范圍內(nèi)的廣泛研究. 盡管這些環(huán)境污染物的毒理學(xué)研究已不斷擴(kuò)展和深入,但是針對(duì)腸道微生物開(kāi)展的環(huán)境毒理學(xué)研究尚處于起步階段. 一般認(rèn)為,腸道及腸道微生物系統(tǒng)是經(jīng)口暴露的污染物進(jìn)入機(jī)體后的第一層暴露接觸點(diǎn),也是防御污染物毒害作用的第一層屏障[11]. 與機(jī)體的其他靶器官相比,腸道微生物更易受到環(huán)境污染物的暴露,其變化也能夠直接反映污染物的潛在毒性作用[12-13]. 針對(duì)目前廣泛研究的幾種典型環(huán)境污染物,該文從污染物種類(lèi)、應(yīng)用、環(huán)境來(lái)源以及對(duì)腸道菌群的影響等方面做了歸納整理,以期為進(jìn)一步開(kāi)展污染物生態(tài)毒理學(xué)研究和風(fēng)險(xiǎn)評(píng)估提供參考. 由于污染物的生物利用度取決于各種因素,如污染物本身的物理化學(xué)特性,與宿主的接觸時(shí)間、接觸劑量、宿主自身吸收能力等,該研究進(jìn)一步整理分析了幾種典型環(huán)境污染物在不同暴露濃度、暴露時(shí)間下對(duì)腸道菌群的影響和對(duì)宿主的毒性效應(yīng)(見(jiàn)表2). 越來(lái)越多的研究[23]證明,腸道菌群會(huì)受到不同污染物暴露的影響,進(jìn)而直接或間接對(duì)宿主的健康產(chǎn)生影響.

表2 幾種典型環(huán)境污染物對(duì)不同生物腸道菌群毒理研究歸納
2.2 環(huán)境污染物影響腸道菌群和宿主健康的作用機(jī)制
環(huán)境污染物被人類(lèi)和動(dòng)物體內(nèi)腸道吸收后,通過(guò)影響腸道菌群的生理活動(dòng),破壞機(jī)體腸道屏障,導(dǎo)致腸道組織損傷,進(jìn)一步引發(fā)宿主代謝失調(diào)、免疫系統(tǒng)、神經(jīng)系統(tǒng)、內(nèi)分泌系統(tǒng)紊亂等多種復(fù)雜結(jié)果,從而影響宿主健康. 此外,環(huán)境污染物通過(guò)菌群的介導(dǎo)作用也會(huì)增加宿主的易感性,導(dǎo)致炎癥、病原體侵染等,加劇污染物的毒性(見(jiàn)圖2).

圖2 環(huán)境污染物暴露影響腸道菌群和宿主健康的潛在作用機(jī)制Fig.2 The potential mechanism of environmental pollutants on gut microbiota and host health
2.2.1破壞腸道屏障功能和完整性
腸道菌群在維持宿主腸道完整性和功能上發(fā)揮著重要作用:一方面,腸道上皮細(xì)胞及部分定植于此的共生微生物菌群構(gòu)成了保護(hù)宿主抵御病原菌侵染的物理性屏障[52-53];另一方面,腸道菌群可以將食物成分轉(zhuǎn)化為含吲哚的代謝物,促進(jìn)潘氏細(xì)胞和杯狀細(xì)胞分泌防御素、抗菌肽和粘蛋白,以助于維持腸道屏障的完整性[54]. 腸道上皮屏障完整性一旦受到破壞,也會(huì)為致病性菌群的移位提供條件,誘發(fā)腸道炎癥[55]. 研究[56-57]表明,腸道菌群中的雙歧桿菌、類(lèi)桿菌等有益菌群產(chǎn)生的短鏈脂肪酸(SCFAs)可以通過(guò)多種機(jī)制作用于腸道以維持腸道屏障完整性,抑制腸道炎癥. SCFAs通過(guò)GPR (如GPR43、GPR109A)信號(hào)通路促進(jìn)腸樹(shù)突狀細(xì)胞(DC)和Th1細(xì)胞分泌白細(xì)胞介素(IL-10、IL-18)和AMP,促進(jìn)調(diào)節(jié)性T細(xì)胞(Treg)的發(fā)育,抑制促炎Th17細(xì)胞的增殖,促進(jìn)腸屏障功能的增強(qiáng). 腸道菌群的代謝物——次級(jí)膽汁酸可以通過(guò)法尼類(lèi)X受體(FXR)和纖維母細(xì)胞生長(zhǎng)因子19(FGF19)調(diào)控腸隱窩再生及傷口修復(fù)、維持腸道屏障完整性和抑制病原體移位定植[58]. 環(huán)境污染物暴露能夠抑制或殺滅有益菌群,改變有益菌群代謝產(chǎn)物(短鏈脂肪酸、次級(jí)膽汁酸等)的含量,進(jìn)而影響代謝產(chǎn)物發(fā)揮緩解宿主腸道炎癥、調(diào)節(jié)腸道屏障的功能. 例如,咪唑作為殺菌劑會(huì)造成哺乳動(dòng)物和水生生物腸道損傷. 暴露于濃度為 1 000 μg/L的咪唑21 d可顯著誘導(dǎo)成年斑馬魚(yú)腸道微生物區(qū)系失調(diào),有益菌群——擬桿菌屬、另枝菌屬、艾克曼菌屬的豐度均明顯降低,以及腸道粘蛋白分泌紊亂[24]. 口服25、50和100 mg/kg咪唑28 d會(huì)誘發(fā)小鼠腸道菌群失調(diào)和結(jié)腸炎癥[59]. 此外,有機(jī)磷農(nóng)藥殺蟲(chóng)劑毒死蜱可以破壞小鼠腸道屏障完整性,引發(fā)炎癥,導(dǎo)致腸道菌群中變形菌門(mén)豐度的增加,擬桿菌門(mén)豐度的減少[60]. 除了上述污染物外,其他有機(jī)污染物如甾體雌激素雌二醇、除草劑阿特拉津同樣也能介導(dǎo)腸道損傷[51].

續(xù)表2
腸道菌群是腸道免疫反應(yīng)的有效刺激因子,在免疫功能中扮演著重要角色[61]. 腸道菌群及其代謝產(chǎn)物通過(guò)與免疫系統(tǒng)相互作用,傳遞促進(jìn)免疫細(xì)胞成熟和免疫功能正常發(fā)育的神經(jīng)信號(hào)[62],腸道菌群(擬桿菌、乳桿菌等)可以誘導(dǎo)抗菌肽(AMPs)、免疫球蛋白A (IgA)的表達(dá),從而防御病原體[63]. 腸道菌群通過(guò)激活自身表位進(jìn)而驅(qū)動(dòng)Th1、Th17和調(diào)節(jié)性T細(xì)胞(CD4+、CD25+、Foxp3+)分化、B細(xì)胞反應(yīng),促進(jìn)機(jī)體對(duì)無(wú)害抗原的耐受,參與宿主的免疫應(yīng)答和組織修復(fù)[64]. 腸道菌群的代謝產(chǎn)物通過(guò)抑制組蛋白去乙酰化酶(HDAC),并激活GPR41、GPR43、TLR4-TRIF信號(hào)通路以促進(jìn)缺氧誘導(dǎo)因子1α (HIF1α)及芳香烴受體(AhR)、干擾素刺激基因(interferon-stimulated gene,ISG)的表達(dá),促進(jìn)細(xì)胞因子白介素(IL-6、IL-22、IL-18等)的產(chǎn)生[54,65],從而調(diào)節(jié)腸道巨噬細(xì)胞的活性,促進(jìn)病原體清除,維持免疫內(nèi)環(huán)境的穩(wěn)定和阻止自身免疫疾病的發(fā)展. 環(huán)境污染物暴露可以通過(guò)影響這些有益菌群的增殖進(jìn)而干擾宿主的免疫系統(tǒng). 相關(guān)研究[66]發(fā)現(xiàn),連續(xù)3周對(duì)小鼠經(jīng)口暴露三氯生,能夠通過(guò)腸道菌群改變小鼠結(jié)腸中免疫細(xì)胞和白介素基因(IL-6)的表達(dá),誘導(dǎo)結(jié)腸炎. 將小鼠連續(xù)暴露于濃度為10、250 μg/L的重金屬砷中,其腸道菌群豐度和多樣性均發(fā)生改變,引發(fā)微生物中抗砷和亞硝酸鹽還原酶基因表達(dá)變化,造成宿主細(xì)胞內(nèi)氧化應(yīng)激損傷并產(chǎn)生過(guò)量的一氧化氮,而氧化應(yīng)激環(huán)境中過(guò)量的一氧化氮會(huì)影響細(xì)胞生長(zhǎng)或傳遞異常的信號(hào),進(jìn)而產(chǎn)生免疫毒性[67]. 另有研究[68]指出,大鼠連續(xù)13周暴露于納米銀中會(huì)降低厚壁菌門(mén)的豐度,并擾亂大鼠回腸中免疫調(diào)節(jié)基因(TLR2、TLR4、GPR43和FOXp3)的表達(dá),影響大鼠免疫功能和整體穩(wěn)態(tài).
2.2.2引發(fā)代謝失調(diào)
短鏈脂肪酸、脂多糖、次級(jí)膽汁酸、咪唑丙酸、支鏈氨基酸、吲哚及其衍生物等一系列的菌群代謝產(chǎn)物和衍生物可作為菌群的“信使”,通過(guò)激活迷走神經(jīng)、刺激腸內(nèi)分泌細(xì)胞、傳輸免疫介導(dǎo)信號(hào)等途徑作用于大腦,從而對(duì)腦細(xì)胞(如神經(jīng)元、少突膠質(zhì)細(xì)胞、星形膠質(zhì)細(xì)胞、小膠質(zhì)細(xì)胞和內(nèi)皮細(xì)胞)產(chǎn)生細(xì)胞特異性的影響[69-70],影響宿主能量穩(wěn)態(tài)、食欲、胰島素敏感性、內(nèi)分泌調(diào)節(jié)等,從而調(diào)控宿主代謝[71-72]. 環(huán)境污染物可以通過(guò)影響腸道微生物而使宿主的代謝產(chǎn)物發(fā)生改變. 研究[27]證實(shí),小鼠暴露于低劑量抗生素后,通過(guò)改變小鼠體內(nèi)腸道菌群代謝短鏈脂肪酸的過(guò)程,從而影響正常宿主肝臟脂質(zhì)和膽固醇代謝調(diào)節(jié). 小鼠連續(xù)4周暴露于重金屬砷(10 mg/L)中會(huì)改變腸道內(nèi)相關(guān)菌群的豐度,進(jìn)而影響宿主正常的脂質(zhì)、氨基酸、膽汁酸代謝[32];將小鼠連續(xù)暴露于10 mg/L的鎘10周后,腸道內(nèi)變形菌門(mén)、厚壁菌門(mén)豐度均顯著降低,血清中脂多糖水平升高并引發(fā)肝臟炎癥和能量代謝失調(diào)[73]. 相似的研究結(jié)論也在水生生物魚(yú)類(lèi)中得到證實(shí):孔雀魚(yú)幼魚(yú)連續(xù)暴露于聚苯乙烯微塑料(粒徑32~40 μm)28 d,魚(yú)體腸道中的變形菌豐度顯著增加,參與脂質(zhì)代謝的放線菌門(mén)和浮霉菌門(mén)豐度均顯著減少,最終降低了魚(yú)體消化、代謝和防御功能[74]. 此外,納米氧化鋅[41]、有機(jī)磷農(nóng)藥二嗪磷[75]及2,3,7,8-四氯二苯并呋喃(TCDF)等多種污染物均可干擾腸道菌群,從而造成宿主代謝紊亂[76].
毒理學(xué)研究[30]表明,環(huán)境污染物作用于腸道菌群后也能夠改變宿主的生長(zhǎng)發(fā)育. 菌群產(chǎn)生的SCFAs增加,可刺激腸道內(nèi)分泌細(xì)胞釋放胰高血糖素樣肽-1(GLP1)、空腹肽,同時(shí)減少胃饑餓素的分泌,刺激厭食激素的產(chǎn)生,導(dǎo)致宿主食物攝入量顯著減少,對(duì)宿主代謝和體重控制發(fā)揮重要作用[77]. 將蚯蚓連續(xù)28 d暴露于砷(濃度為70~280 mg/kg)后發(fā)現(xiàn),腸道中擬桿菌門(mén)豐度增加、鏈霉菌科豐度降低,并伴隨體重下降和死亡率上升的現(xiàn)象[78]. 將黑水虻連續(xù)10 d分別暴露于銅(濃度為100~800 mg/kg)和鎘(濃度為10~80 mg/kg)后,觀察到腸道菌群紊亂且體重發(fā)育受到抑制[30]. 有研究[27,79]發(fā)現(xiàn),環(huán)境污染物暴露能夠通過(guò)腸道菌群進(jìn)一步改變生物體對(duì)胰島素的敏感程度,從而導(dǎo)致宿主體重增加. 例如,青霉素等抗生素被小鼠攝入后能夠造成腸道菌群失衡,影響胰島素代謝調(diào)節(jié)因子和代謝酶基因的異常表達(dá),導(dǎo)致小鼠體內(nèi)脂肪含量及體重上升. 小鼠在殺蟲(chóng)劑毒死蜱[60]、重金屬鉛[33]的暴露研究中,也在其體內(nèi)觀察到了類(lèi)似的組織生理變化.
2.2.3影響神經(jīng)行為
近年來(lái),生物和醫(yī)學(xué)領(lǐng)域的學(xué)者深入系統(tǒng)地開(kāi)展了腸道微生物對(duì)生物體神經(jīng)系統(tǒng)和生物行為的研究,發(fā)現(xiàn)腸道菌群及其代謝物能夠作為控制信號(hào)分子從腸腔傳輸?shù)矫宰呱窠?jīng)和腸神經(jīng)系統(tǒng),調(diào)節(jié)GABA和5-HT等神經(jīng)遞質(zhì)的濃度,直接或間接地影響神經(jīng)系統(tǒng),調(diào)控宿主行為[80]. 然而,目前關(guān)于污染物通過(guò)腸道微生物介導(dǎo)神經(jīng)行為的毒理學(xué)研究還非常有限. 有研究[81]推測(cè),人類(lèi)的很多精神性疾病可能與污染物暴露影響到腸道菌群有關(guān). 關(guān)于該領(lǐng)域的環(huán)境毒理學(xué)研究還有待進(jìn)一步深入開(kāi)展.
3 結(jié)論與展望
腸道菌群在維持宿主健康上起著至關(guān)重要的作用,也為挖掘環(huán)境污染物新的毒性終點(diǎn)和作用機(jī)制提供了研究方向. 然而,關(guān)于腸道菌群的環(huán)境毒理學(xué)研究在一些關(guān)鍵性科學(xué)問(wèn)題上依然面臨挑戰(zhàn): ①環(huán)境污染物暴露導(dǎo)致的宿主健康損傷與腸道菌群失調(diào)常相伴而生,很多研究結(jié)果只是證明了二者之間的相關(guān)性,在因果關(guān)系上依然缺乏系統(tǒng)研究. 這種研究結(jié)果上的因果關(guān)系缺失,可能為推斷污染物的作用機(jī)制帶來(lái)困難. ②腸道菌群在不同生物體中存在種間特異性和種內(nèi)差異性,同一個(gè)體在不同的生長(zhǎng)發(fā)育階段也存在差異. 選擇不同本底值的試驗(yàn)對(duì)象是否會(huì)給現(xiàn)有的研究結(jié)論造成影響,這也是一個(gè)值得關(guān)注的問(wèn)題.
對(duì)于這些關(guān)鍵問(wèn)題的闡釋?zhuān)枰椒▽W(xué)的創(chuàng)新和技術(shù)手段的進(jìn)步. 期待在未來(lái)研究中可以在以下兩個(gè)方面重點(diǎn)加強(qiáng)方法學(xué)的開(kāi)發(fā)和投入: ①開(kāi)發(fā)模式生物,尤其是本底值清晰的生物品系和無(wú)菌品系. 對(duì)比試驗(yàn)?zāi)軌蚋忧逦仃U釋腸道微生物的作用,也是破解研究腸道菌群和宿主健康互作因果關(guān)系的關(guān)鍵. ②開(kāi)發(fā)體外腸道菌群培養(yǎng)技術(shù)和腸道模擬系統(tǒng),通過(guò)變量控制,依據(jù)“科赫法則”開(kāi)展腸道菌群穩(wěn)態(tài)形成機(jī)制、腸道菌群恢復(fù)試驗(yàn)、環(huán)境因子對(duì)腸道菌群影響等研究.

